Facultad de Ciencias Medicas Unidad Didctica de Qumica















- Slides: 23

Facultad de Ciencias Medicas Unidad Didáctica de Química ENLACE QUIMICO Semana No. 2 Capítulo 5 Licda. Bárbara Toledo

ENLACE QUIMICO Fuerzas de atracción que unen a los átomos en las moléculas y a los iones en los cristales.

ENLACE QUIMICO El tipo de enlace en una sustancia determina sus propiedades físicas y químicas así como la atracción que una sustancia ejerce sobre otra.

CLASIFICACIÓN IONICO: Fuerzas electrostáticas entre partículas de carga opuesta. COVALENTE: Resulta de compartir electrones entre dos átomos. METALICO: Unión de los átomos en los cristales metálicos.

ESTRUCTURA DE LEWIS Es la forma de destacar los electrones de valencia de los átomos. Cada electrón de valencia se representa con un punto alrededor del símbolo del elemento. . . K ▪ ; ▪ Al. ▪ ; : S :

REGLA DEL OCTETO Tendencia de los átomos a ganar o perder electrones para completar ocho electrones de valencia. El hidrógeno y el helio obedecen la Regla del Dueto

REGLA DEL OCTETO Los metales pierden electrones se oxidan Los no metales ganan electrones se reducen

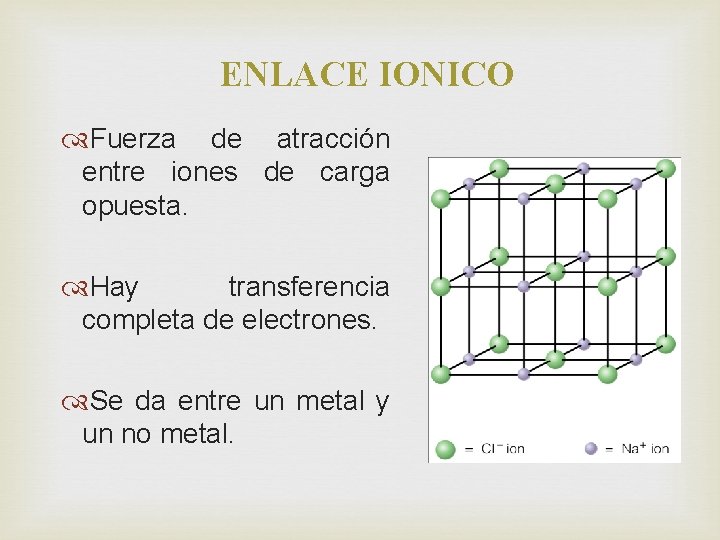
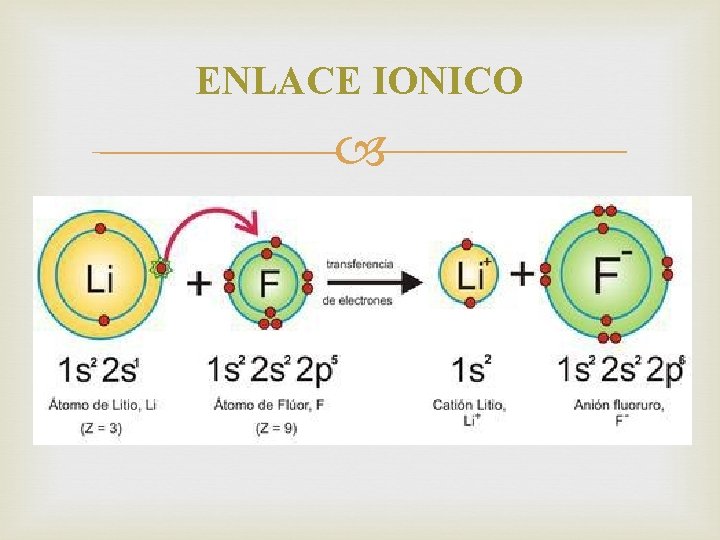
ENLACE IONICO Fuerza de atracción entre iones de carga opuesta. Hay transferencia completa de electrones. Se da entre un metal y un no metal.

ENLACE IONICO

ENLACE IONICO PROPIEDADES Forma un compuesto iónico. Son sólidos cristalinos estables Tienen altos puntos de fusión > a 300° Muchos son solubles en agua. Son compuestos neutros

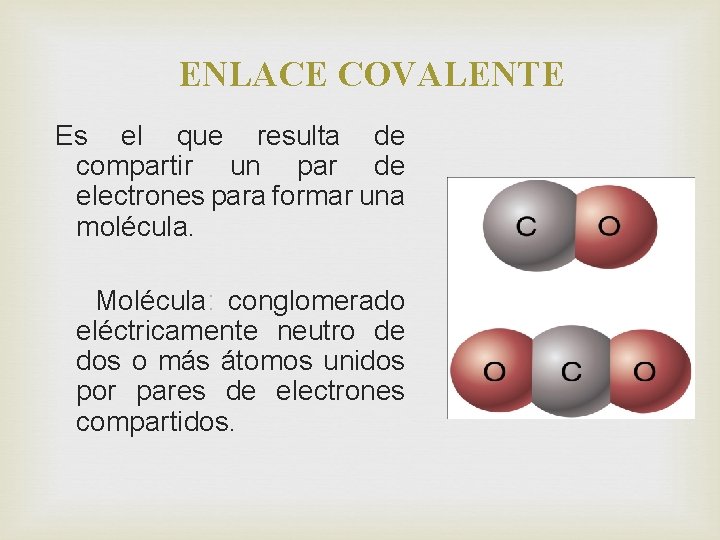
ENLACE COVALENTE Es el que resulta de compartir un par de electrones para formar una molécula. Molécula: conglomerado eléctricamente neutro de dos o más átomos unidos por pares de electrones compartidos.

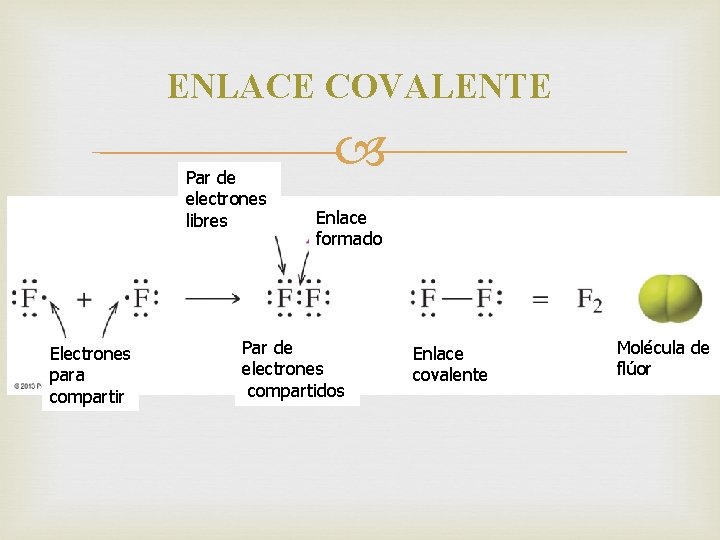
ENLACE COVALENTE Par de electrones libres Electrones para compartir Enlace formado Par de electrones compartidos Enlace covalente Molécula de flúor

ENLACE COVALENTE Este puede formar un: Enlace simple: cuando se comparte un par de electrones Ej. I 2, Cl 2, Br 2 Enlace doble: cuando se comparten dos pares de electrones Ej. CO 2

ENLACE COVALENTE Enlace triple: cuando se comparten tres pares de electrones. Ej. N 2 Enlace coordinado: un átomo es el que aporta los dos electrones al enlace. Ej. SO 2

ENLACE COVALENTE Los átomos de los elementos más electronegativos ejercen mayor atracción sobre los electrones compartidos.

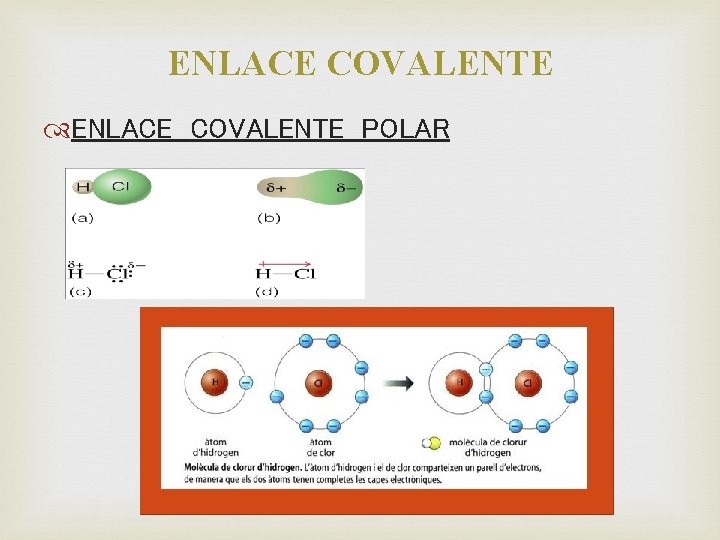
ENLACE COVALENTE Clasificación ENLACE COVALENTE POLAR Los electrones se comparten de manera desigual entre dos átomos no metálicos diferentes. El átomo más electronegativo tendrá mayor atracción por el par de electrones compartidos.

ENLACE COVALENTE POLAR

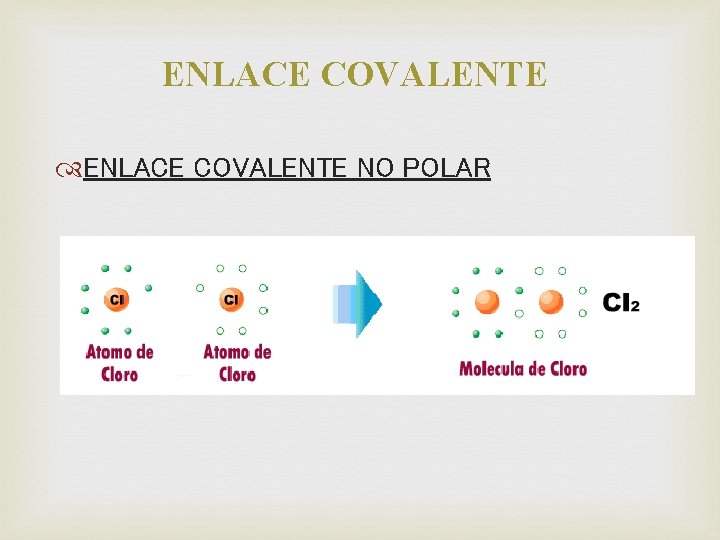
ENLACE COVALENTE • ENLACE COVALENTE NO POLAR • Los electrones se comparten de manera equitativa entre dos átomos del mismo elemento. • Ocurre entre átomos no metálicos idénticos

ENLACE COVALENTE NO POLAR

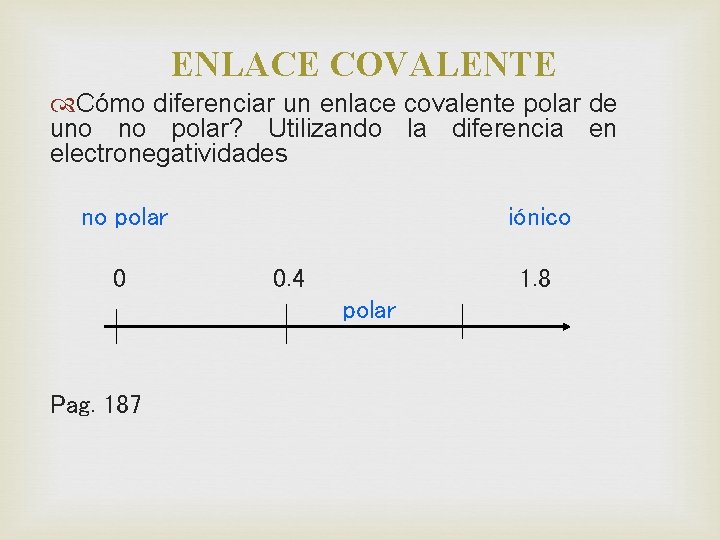
ENLACE COVALENTE Cómo diferenciar un enlace covalente polar de uno no polar? Utilizando la diferencia en electronegatividades no polar 0 iónico 0. 4 1. 8 polar Pag. 187

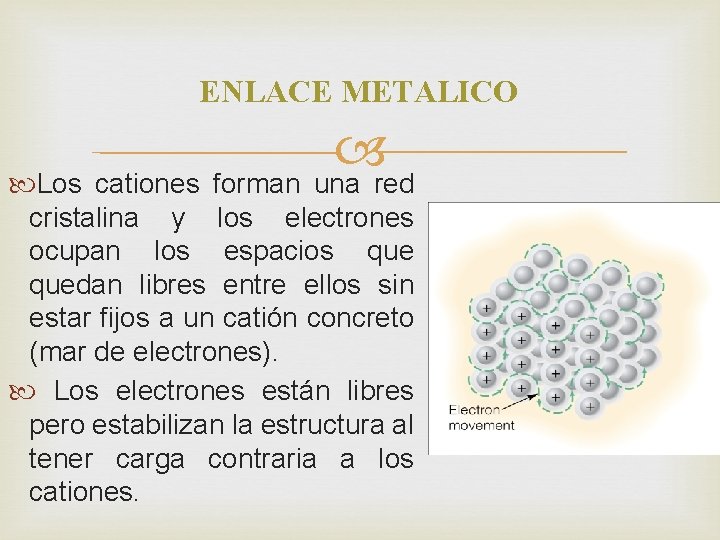
ENLACE METALICO Los cationes forman una red cristalina y los electrones ocupan los espacios quedan libres entre ellos sin estar fijos a un catión concreto (mar de electrones). Los electrones están libres pero estabilizan la estructura al tener carga contraria a los cationes.

RESUMEN http: //concurso. cnice. mec. es/cnice 2005/93_iniciacion_interactiva_materia /curso/materiales/enlaces/activfinal. htm Enlace iónico Enlace metálico covalente Partículas iones moléculas átomos Estado físico sólido, gas, líquido sólidos Conductividad no eléctrica (sólido) No si Solubilidad polar-polar apolar-apolar insolubles solvente polar

FIN
 Facultad de ciencias médicas y biológicas umsnh
Facultad de ciencias médicas y biológicas umsnh Instituto superior de ciencias medicas
Instituto superior de ciencias medicas Pliegues asimétricos
Pliegues asimétricos Universidad de ciencias medicas sancti spiritus
Universidad de ciencias medicas sancti spiritus Facultad de ciencias quimicas unach
Facultad de ciencias quimicas unach Universidad de el salvador facultad de ciencias economicas
Universidad de el salvador facultad de ciencias economicas Facultad de ciencias economicas tucuman
Facultad de ciencias economicas tucuman Universidad de el salvador facultad de ciencias economicas
Universidad de el salvador facultad de ciencias economicas Facultad de ciencias agricolas uce
Facultad de ciencias agricolas uce Facultad de ciencias universidad mayor
Facultad de ciencias universidad mayor University of pecs faculty of health sciences
University of pecs faculty of health sciences Unionpyme easy software contable gratuito
Unionpyme easy software contable gratuito Facultad de ciencias físicas ucm
Facultad de ciencias físicas ucm Universidad de los andes facultad de ciencias
Universidad de los andes facultad de ciencias Facultad de ciencias economicas tucuman
Facultad de ciencias economicas tucuman Bangolou
Bangolou Ciencias naturales unidad 1
Ciencias naturales unidad 1 Didctica
Didctica Etapa adisciplinar
Etapa adisciplinar Didctica
Didctica Leyes del proceso docente educativo
Leyes del proceso docente educativo Imideo g nérici
Imideo g nérici Unidad decena centena unidad de mil
Unidad decena centena unidad de mil Recordatorio de citas medicas
Recordatorio de citas medicas












































