Entstehung von Toxinen in der Umwelt Die kosysteme


























- Slides: 31

Entstehung von Toxinen in der Umwelt � Die Ökosysteme der Erde erbringen für uns lebenswichtige, unverzichtbare Dienstleistungen, die “ecosystem services“ � Ökosysteme können aber auch – als Reaktion auf anthropogene Belastungen - Fehlleistungen erbringen, indem sie Toxine erzeugen und diese akkumulieren. Beispiele sind � Methylquecksilber Toxische Algenblüten/Domoinsäure Wasservogel-Botulismus � �

Botulinum-Neurotoxin � � � � � Das gefährlichste natürliche Toxin. Wird von Clostridium botulinum (und einigen anderen Clostridium. Arten) in die Umgebung ausgeschieden (Exotoxin). Diese Bakterien kommen ubiquitär im Erdboden vor. Botulinumtoxine sind hochmolekulare Proteinkomplexe. Blockade der Signalübertragung zwischen Nerven und Muskeln. Die Ausschüttung von Acetylcholin wird gehemmt. Typ A ist am meisten toxisch für Menschen (Aufnahme von 10 µg ist tödlich). Lebensmittelvergiftung durch z. B. verdorbene Wurst. Typ C verursacht Botulismus bei Vögeln (für den Menschen nicht gefährlich) wenn in flachen Gewässern hohe Temperaturen, Sauerstoffmangel und ein großes Nährstoffangebot vorhanden sind. Aufgenommen wird das Toxin vor allem über Insektenlarven, die selbst dagegen unempfindlich sind und in denen sich das Toxin akkumuliert.


B EU Grenzwert 1 µg/L Hg (im Trinkwasser) Anthropogen unbelastetes Wasser hat 5 -20 ng/L Hg B Grenzwert Raubfische 1 mg/kg, übrige 0, 5 mg/kg (Frischgewicht) Das Umweltqualitätsziel der Europäischen Wasserrahmenrichtlinie für Quecksilber in Fischen liegt bei 20 µg/kg Frischgewicht

Maternal consumption of fish is believed to be the major route of exposure for newborns. The methylation of mercury in the aquatic environment is a critical step toward accumulation of this toxic metal in the aquatic food chain. Me. Hg+ is produced in the environment primarily by anaerobic bacteria that exist in most natural settings. Me. Hg+ levels in aquatic systems vary widely and do not necessarily correlate to the total amount of mercury in water or sediments but depend on the productivity of the anaerobic microorganisms that can methylate mercury and the bioavailability of inorganic Hg(II) that can be taken up by these bacteria. Source: dx. doi. org/10. 1021/es 304370 g | Environ. Sci. Technol. 2013, 47, 2441− 2456

Eutrophication hypothesis � The premise for the “eutrophication hypothesis” is that Hg(II) conversion to Me. Hg+ in sediments is influenced by the efficiency of methylation by microorganisms, and the concentration and bioavailability of Hg(II) � which are in turn controlled by inorganic and organic complexing agents in both the solid and porewater phases. � Organic material (OM) -rich sites have (on average) higher methylation rates which is consistent with the notion that OM helps support microbial communities and enhances methylation.

Organische Quecksilberverbindungen • Wichtig ist ausschließlich die Oxidationsstufe +II • Monoorganyle RHg. X, Diorganyle R 2 Hg • linear gebaut • Kovalente Bindung Hg-C • relativ geringe Bindungsenergien 50 – 200 k. J/mol • kann leicht homolytisch unter Bildung von Radikalen gespalten werden (thermische oder photolytische Zersetzung) • Lebensdauer in der Atmosphäre nur wenige Stunden

Gefährlichkeit des Dimethylquecksilbers Karen Wetterhahn (1948 -1997) war Chemikerin und Professorin am Dartmouth College in New Hampshire. Sie beschäftigte sich mit der Toxizität von Schwermetallen. 1996 Unfall im Labor: zwei Tropfen Dimethylquecksilber (von der Pipettenspitze) drangen durch ihre Latexhandschuhe und kamen auf ihre Haut. Sie führte alle vorgeschriebenen Sicherheitsmaßnahmen durch und wurde dann nicht weiter untersucht/behandelt. 1997 Mehrere Monate später wurde sie plötzlich krank. Sie erinnerte sich an den Vorfall mit dem Dimethylquecksilber, und wurde untersucht. Trotz sofort begonnener Therapie mit Dimercaptopropansulfonsäure starb sie an der Quecksilbervergiftung. Die Verwendung von Dimethylquecksilber als Standard in der NMRSpektroskopie (199 Hg nuclear magnetic resonance NMR) wurde daraufhin eingestellt. 0, 1 ml (300 mg) der Verbindung über die Haut aufgenommen sind bereits tödlich. Die Haut nimmt es innerhalb von 15 sec auf.

Die Bildung des Methylquecksilbers in der Umwelt die biochemische Quecksilbermethylierung in der Umwelt wird durch Mikroorganismen verursacht Eine wichtige Bakteriengruppe für die Quecksilbermethylierung sind Sulfat-reduzierende Bakterien in Sedimenten, z. B. Desulphovibrio desulfuricans, die Methylierung von Hg 2+ wird vermutlich durch synergistische Wechselwirkungen mit methanogenen Archaeen unterstützt Meerwasser: 2, 7 g L-1 Sulfat

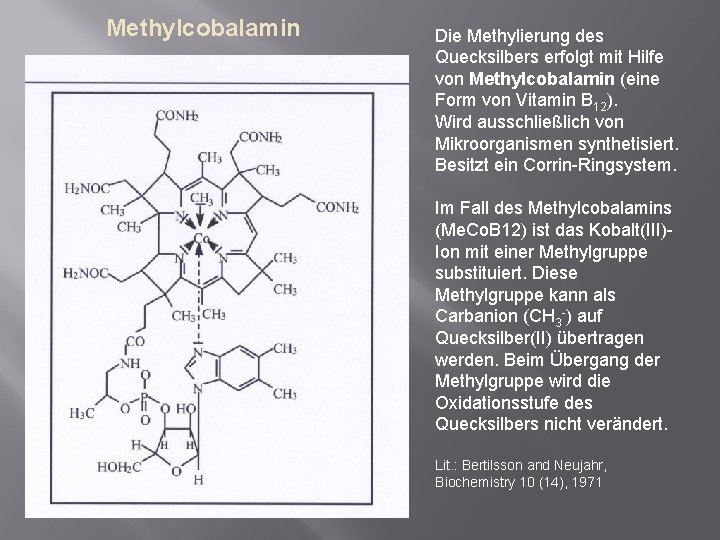
Methylcobalamin Die Methylierung des Quecksilbers erfolgt mit Hilfe von Methylcobalamin (eine Form von Vitamin B 12). Wird ausschließlich von Mikroorganismen synthetisiert. Besitzt ein Corrin-Ringsystem. Im Fall des Methylcobalamins (Me. Co. B 12) ist das Kobalt(III)Ion mit einer Methylgruppe substituiert. Diese Methylgruppe kann als Carbanion (CH 3 -) auf Quecksilber(II) übertragen werden. Beim Übergang der Methylgruppe wird die Oxidationsstufe des Quecksilbers nicht verändert. Lit. : Bertilsson and Neujahr, Biochemistry 10 (14), 1971

Entstehung von Dimethylquecksilber auch bei der Zersetzung von Monomethylquecksilber in Anwesenheit von H 2 S (H 2 S wird durch die mikrobielle Sulfatreduktion in reduzierenden Sedimenten gebildet): 2 CH 3 Hg+ + S 2 - → CH 3 Hg-S-Hg. CH 3 → (CH 3)2 Hg + Hg. S

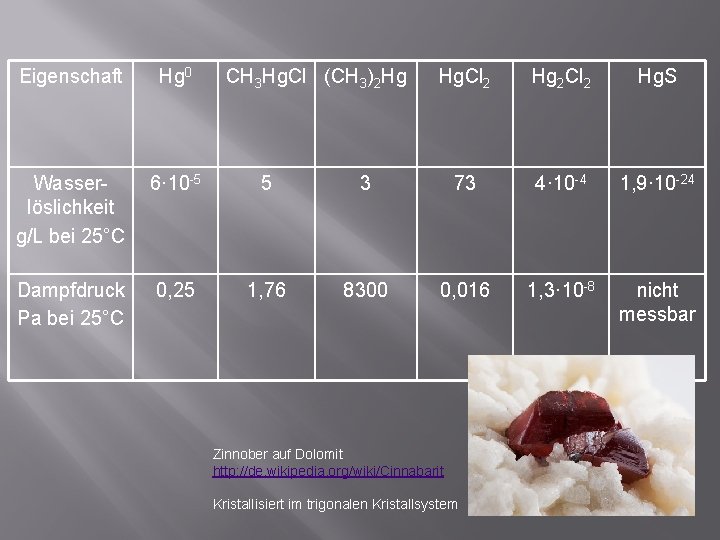
Eigenschaft Hg 0 CH 3 Hg. Cl (CH 3)2 Hg Wasserlöslichkeit g/L bei 25°C 6· 10 -5 5 Dampfdruck Pa bei 25°C 0, 25 1, 76 Hg. Cl 2 Hg 2 Cl 2 Hg. S 3 73 4· 10 -4 1, 9· 10 -24 8300 0, 016 1, 3· 10 -8 nicht messbar Zinnober auf Dolomit http: //de. wikipedia. org/wiki/Cinnabarit Kristallisiert im trigonalen Kristallsystem

Quecksilber in der Atmosphäre � Mit Hg Dampf gesättigte Raumluft enthält bei 25°C 18 mg/m 3 � MAK Wert 0, 02 mg/m 3 Ab 0, 1 mg/m 3 Hg am Arbeitsplatz kommt es zu neurologischen Störungen wie Zittern der Hände, Appetitlosigkeit, Vergesslichkeit � In der Gasphase liegt Hg einatomig vor � Die Konzentration von Hg Dampf in der Atmosphäre liegt in unbelasteten Gebieten bei 1 ng/m 3 � Hg bindet an Chlorid enthaltende Aerosole und an Rußpartikel, nicht an Sulfat- oder Nitrat- Aerosole � Hg kommt vor allem durch trockene Deposition der Aerosolpartikel zum Erdboden und in die Gewässer. 2015 wurde in Krakau (Polen) eine Hg Deposition von 47, 3 ng m-2 d-1 gemessen. � Wo viel Ruß produziert wird, ist die Quecksilberbelastung höher. � Lit. : Styszko et al. , Comptes Rendus Chimie 18 (2015), 1183 -1191

Ab 1914 bis Mitte der 1980 er Jahre: Hohe Quecksilberbelastung der Böden in der Landwirtschaft durch Hg-gebeiztes Saatgut. Verwendet wurden Phenylquecksilberchlorid, Phenylquecksilberacetat, Ethylquecksilberchlorid u. a. Der größte Teil des Weizens wurde weltweit mit Hg gebeizt, wirkte vor allem gegen Pilze. In Österreich erst seit 1992 verboten.

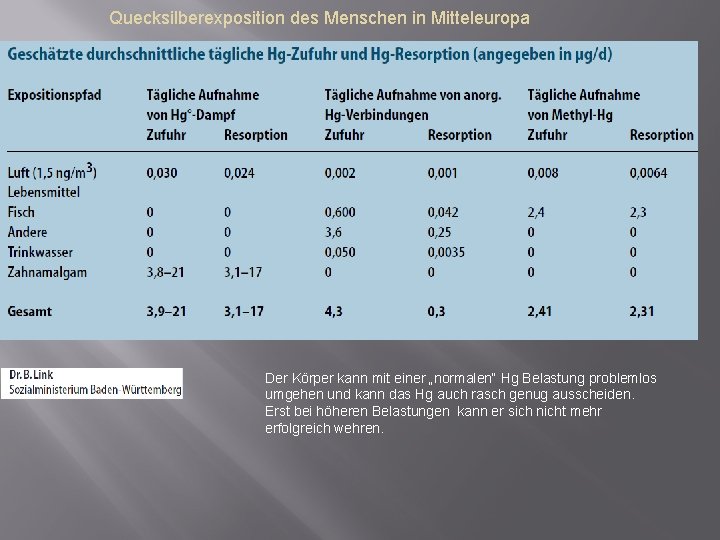
Quecksilberexposition des Menschen in Mitteleuropa Der Körper kann mit einer „normalen“ Hg Belastung problemlos umgehen und kann das Hg auch rasch genug ausscheiden. Erst bei höheren Belastungen kann er sich nicht mehr erfolgreich wehren.

Blut-Hirn-Schranke/Blut-Plazenta-Schranke gut durchlässig für unpolare Hg(0) und organische Hg(II)-Verbindungen nicht durchlässig für anorganische Hg(II)-Salze schnelle Aufnahme von Hg(0) über die Lunge ins Blut in Erythrozyten, Leber und Gehirn wird Hg(0) zu Hg(II) oxidiert bei chronischer Exposition: Transport von Hg(0) ins Gehirn, Umsetzung zu Hg 2+ führt zur Akkumulation, da Hg 2+ nicht mehr aus dem Gehirn hinausdiffundieren kann Es kommt aber (langsam) auch wieder zur Reduktion zu Hg(0) Ausscheidung nach inhalativer Aufnahme mit den Fäzes und mit dem Urin Hg(0) kann auch abgeatmet werden, oder über die Haut abgedampft, Halbwertszeit im Gehirn 19 Tage, In den Nieren 58 Tage

EFSA – European Food Safety Authority � � Tolerierbare wöchentliche Aufnahme von Methylquecksilber (TWI – tolerable weekly intake) TWI=1, 3 µg CH 3 Hg+ pro kg Körpergewicht

Hohe und steigende Quecksilberbelastung in der Arktis � Die troposphärische Lebensdauer von Hg 0 beträgt 2 Jahre (schlechte Wasserlöslichkeit, geringe chem. Reaktivität). Daher kann es sich gleichmäßig in der Troposphäre verteilen und ist daher auch über den Polen vorhanden, wo keine Emissionen stattfinden. � Brom in der Atmosphäre: � Qucksilber(II)bromid löst sich in Wasser (6 g/L bei 20°C) und wird daher von den Niederschlägen ausgewaschen � dies führt bei Sonnenaufgang zu Beginn des Frühlings zu einem starken Absinken der Hg 0 Konzentration über der Arktis bzw. Antarktis und zugleich zu einer Anreicherung von Hg im arktischen bzw. antarktischen Eis und Boden � Klimawandel: der Rückzug des Meereises verstärkt diesen Effekt durch vermehrte Emissionen von Bromverbindungen aus dem Ozean (“Bromexplosion” im Frühjahr). Als Quelle des Bromoxids kommt der photochem. Abbau natürlicher halogenorganischer Verbindungen in Frage, die aus dem biologisch sehr aktiven Schelfgebiet emittiert werden (vor allem Bromoform (CHBr 3) und Dibrommethan). (Meerwasser enthält 68 mg/L Bromid). � Lit. : Seigneur, C. , Lohman, K. , 2008. Effect of bromine chemistry on the atmospheric mercury cycle. Journal of Geophysical Research 113, D 23309. doi: 10. 1029/2008 JD 010262.


Quecksilber in der Arktis • z. B. Polarfüchse (Vulpes lagopus) akkumulieren Hg im Körper, wenn sie in küstennahen Gebieten leben und sich von im Meer lebender Beute ernähren. • die Jungtiere des Polarfuchses weisen wegen der hohen Quecksilberkonzentrationen derzeit stark steigende Sterblichkeitsraten auf. Die Messungen wurden mittels AAS an Haarproben historischer und rezenter Polarfüchse jeweils desselben Gebietes durchgeführt Citation: Bocharova N, Treu G, Czirják GÁ, Krone O, Stefanski V, et al. (2013) Correlates between Feeding Ecology and Mercury Levels in Historical and Modern Arctic Foxes (Vulpes lagopus). PLo. S ONE 8(5): e 60879. doi: 10. 1371/journal. pone. 0060879

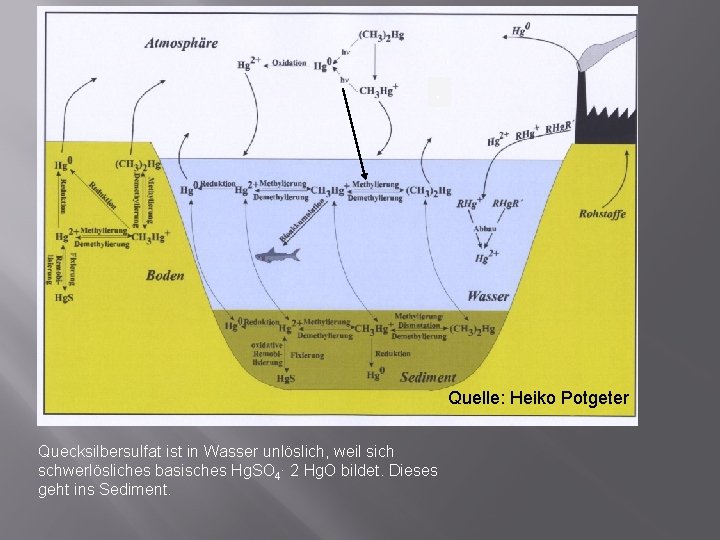
. Quelle: Heiko Potgeter Quecksilbersulfat ist in Wasser unlöslich, weil sich schwerlösliches basisches Hg. SO 4∙ 2 Hg. O bildet. Dieses geht ins Sediment.



Methylquecksilber in Gewässern: Photolytischer Abbau durch Sonnenlicht � Die Demethylierung von Methylquecksilber in Gewässern erfolgt biologisch oder durch UV Licht (Wellenlänge <400 nm) � Der photolytische Prozess ist dominant � Der Abbau durch Sonnenlicht in Süßwasserseen erfolgt relativ rasch, � jedoch wesentlich langsamer in marinen Gewässern! � Die Abbaurate hängt vom Liganden ab: CH 3 Hg-Thiol. Komplexe mit Huminstoffen werden rasch abgebaut, da im Zuge photochemischer Prozesse Singulett-Sauerstoff sowie oxidierende Spezies wie Hyperoxid, Peroxid und OH Radikale entstehen � Bei hohen Chloridkonzentrationen (wie im Meerwasser) liegt Methylquecksilber als Chloridkomplex vor, der nur sehr langsam abgebaut wird. (Lit. : Tong Zhang und Heileen Hsu-Kim, Nature Geoscience 3, 2010)

Huminstoffe als Initiatoren von Abbauprozessen in Gewässern Quelle: Guderian/Gunkel (Hrsg. ): Handbuch der Umweltveränderungen und Ökotoxikologie – Aquatische Systeme. Springer, 2000.


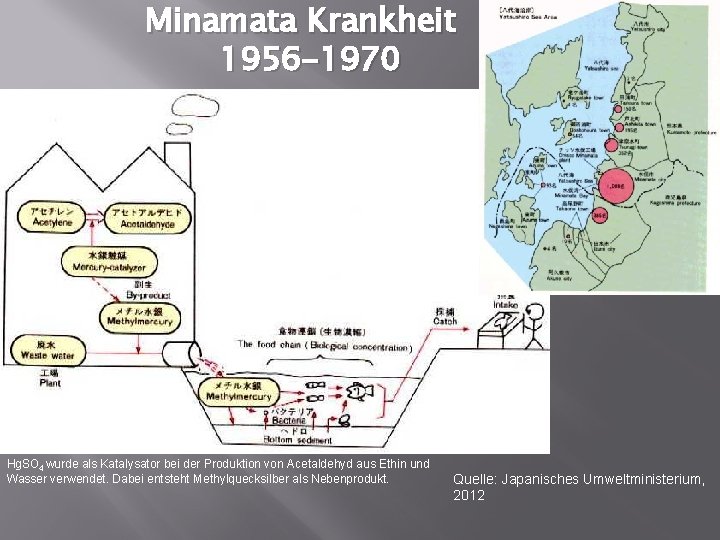
Minamata Krankheit 1956 -1970 Hg. SO 4 wurde als Katalysator bei der Produktion von Acetaldehyd aus Ethin und Wasser verwendet. Dabei entsteht Methylquecksilber als Nebenprodukt. Quelle: Japanisches Umweltministerium, 2012

� Beginning in the Taisho period (1912 -1926), pollution of the ocean by the wastewater from the Chisso factory occasionally became a problem. � However, from 1932 to 1968 the company continued to use inorganic mercury as a catalyst in producing acetaldehyde, which was used to produce acetic acid and vinyl chloride. � Methyl mercury, a by-product of the production process, was discharged virtually untreated into the sea until 1966. � Even after Chisso knew its factory wastewater was the cause of Minamata disease, it did not suspend operations. � 12, 617 people have been officially recognized as patients affected by mercury � http: //www. soshisha. org/english/10 tishiki_e/10 chisiki_3_e. pdf Der japanische Umweltminister Nobuteru Ishihara (rechts) und der Direktor des Umweltprogramms der Vereinten Nationen (Unep), Achim Steiner, erinnern an die mehr als 3000 Todesopfer Foto: AFP

Quecksilber � � Die weltweite größte Lagerstätte, in Form des Quecksilbererzes Zinnober (Hg. S), beherbergt das südspanische Almadén, dieses Bergwerk existierte schon im 12. Jahrhundert. Ihren Höhepunkt erreichte die Produktion 1941. Im Jahr 2000 stellte die Erzgrube ihren Betrieb ein. Die größten Quecksilberproduzenten sind aktuell China und Kirgistan. � Insgesamt hat der Mensch seit 1850 etwa 200 000 Tonnen Quecksilber in die Umwelt gebracht z. B. im 19. und 20. Jahrhundert durch die Chloralkalielektrolyse nach dem Amalgamverfahren. Der größte Teil davon ist noch nicht immobilisiert sondern befindet sich im Quecksilberkreislauf des Ozeans. � Inzwischen herrschen zumindest in der EU und den USA strenge Richtlinien für den Umgang mit Quecksilber. In Asien, Afrika und Südamerika hat die Umweltverschmutzung mit Quecksilber aber noch immer bedenkliche Dimensionen. � Quecksilber verteilt sich großräumig um die Erde. Jede lokale Quelle ist ein globales Problem, vor allem für den Ozean. Der Mensch hat den natürlichen Quecksilberkreislauf um einen Faktor 3 erhöht.

Quecksilber-Konvention der vereinten Nationen � 2013 haben in Minamata 110 Staaten die Quecksilber. Konvention der Vereinten Nationen unterzeichnet. Seitdem das Übereinkommen im August 2017 in Kraft getreten ist, dürfen in den Vertragsstaaten keine neuen Quecksilberminen mehr eröffnet werden. � Das Ziel der Konvention ist es, den Ausstoß von Quecksilber in die Atmosphäre drastisch zu senken. � Derzeit entsteht ein wichtiger Anteil des Quecksilberdampfs, der in die Natur entlassen wird, bei der Verbrennung von Kohle in Kraftwerken. � In einigen Entwicklungsländern wird Quecksilber in beträchtlichem Maß für die Gewinnung von Gold in kleingewerblichen, oft improvisierten Minen eingesetzt. Weltweit sind das im Jahr rund 1000 Tonnen.

Fischsterben in Vietnam 2016 in Hanois größtem See durch Industrieabwässer
 Hans joas die entstehung der werte
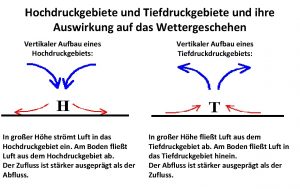
Hans joas die entstehung der werte Hoher luftdruck auswirkung
Hoher luftdruck auswirkung Entstehung der glühbirne
Entstehung der glühbirne Slidetodoc.com
Slidetodoc.com Entstehung der jahreszeiten
Entstehung der jahreszeiten Was machst du für die umwelt?
Was machst du für die umwelt? Von der hexe die einen drachen heiratet
Von der hexe die einen drachen heiratet Die mier en die springkaan
Die mier en die springkaan Der daumen pflückt die pflaumen
Der daumen pflückt die pflaumen Polarlichter entstehung
Polarlichter entstehung Brandenburgische konzerte entstehung
Brandenburgische konzerte entstehung Alkoholfahne entstehung
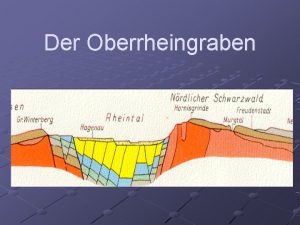
Alkoholfahne entstehung Entstehung des oberrheingrabens
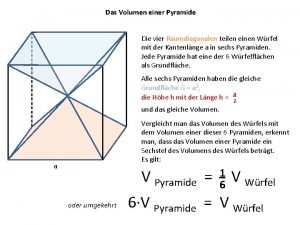
Entstehung des oberrheingrabens Raumdiagonale pyramide
Raumdiagonale pyramide Entstehung eines fossils
Entstehung eines fossils Neuralplatte
Neuralplatte Gewerbesalz verwendung
Gewerbesalz verwendung Schneemaul
Schneemaul Entstehung eines tsunami
Entstehung eines tsunami Sabrina thelen
Sabrina thelen Mensch und umwelt realschule
Mensch und umwelt realschule Umwelt globalisierung
Umwelt globalisierung Sandra scarr
Sandra scarr Umwelt
Umwelt Entwicklungspsychopathologie definition
Entwicklungspsychopathologie definition Umwelt macht schule
Umwelt macht schule Umwelt-und-bauen/
Umwelt-und-bauen/ Steuerbord vor backbord
Steuerbord vor backbord Erasmus von rotterdam beeinflusst von
Erasmus von rotterdam beeinflusst von Geschichte von den vier kerzen
Geschichte von den vier kerzen Spätherbst in venedig
Spätherbst in venedig Die einigung italiens
Die einigung italiens