Efectos anomricos Qumica Computacional Dr Carlos Rius Alonso















- Slides: 20

Efectos anoméricos Química Computacional Dr. Carlos Rius Alonso

Introducción b Algunos azúcares tienen un equilibrio entre dos isómeros. Este efecto se presenta cuando se encuentran monosacáridos que pueden formar hemicetales los cuales se ciclizan en dos estructuras diferentes conocidas como anómeros.

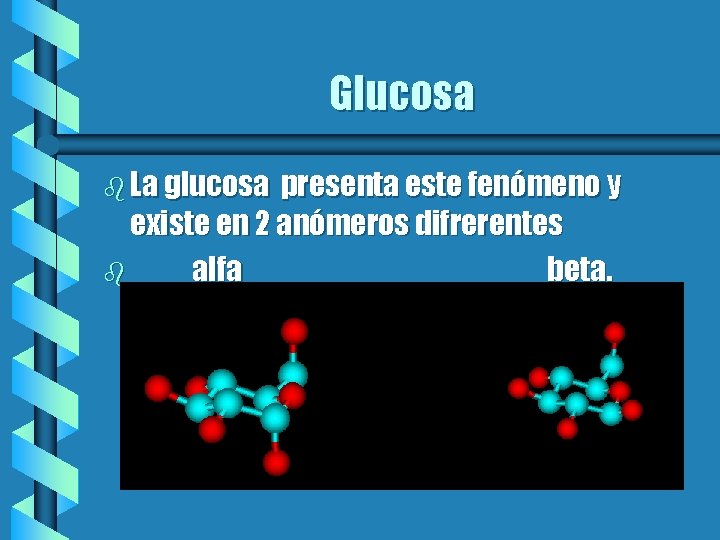
Glucosa b La glucosa presenta este fenómeno y existe en 2 anómeros difrerentes b alfa beta.

Glucosa II b El anómero que se encuentra en menor proporción es el alfa tiene un grupo OH axial en el carbono 2. El anómero beta tiene el OH ecuatorial, esto va de acuerdo a lo que se sabe con respecto a los ciclohexanos sustituidos donde las posiciones ecuatoriales son preferidas a las axiales por efectos estéricos.

Glucosa III b Sin embargo cuando se preparan derivados de la glucosa se ve que los alfa son más estables que los beta. b Axial Ecuatorial % alfa %beta b A OH H 36 64 b B OCH 3 H 67 33 b C OC(=O)CH 3 88 12

Preferencia anomérica b Esta preferencia por la sustitución axial conoce como efecto anomérico. b Compuesto Dif entre alfa y beta en Kcal/mol • • A B C D -0. 33 0. 42 1. 6 se

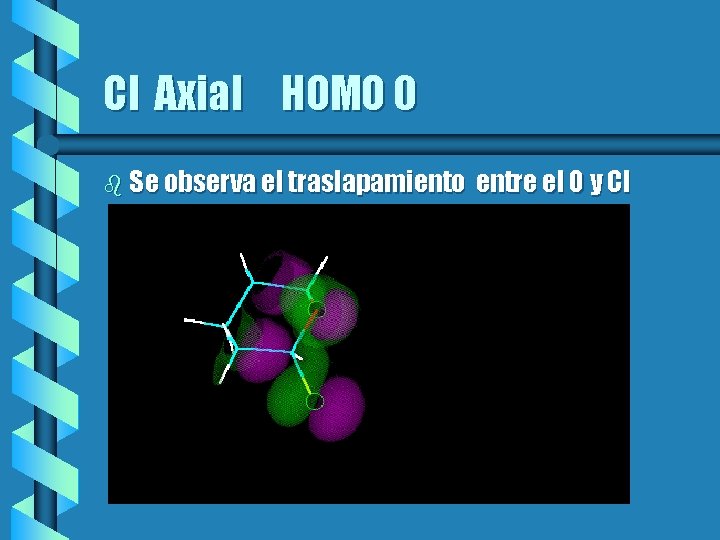
Cloro. Tetrahidropirano b Otros compuestos muestran este efecto anomérico y se puede racionalizar en base a los orbitales frontera y las interacciones con los átomos electronegativos vecinos. b Los anómeros más estables serán aquellos que tenga un mejor traslapamiento entre los orbitales de los pares electrónicos del Oxígeno y los del heteroátomo de C 2.

Clorotetrahidropirano II b En el caso del clorotetrahidropirano hay un traslapamiento más efectivo cuando el Cl es axial que cuando es ecuatorial. b Para poder visualizar esto en las gráficas siguientes se muestra los dos compuestos con sus orbitales correspondientes.

Cl Axial HOMO 0 b Se observa el traslapamiento entre el O y Cl

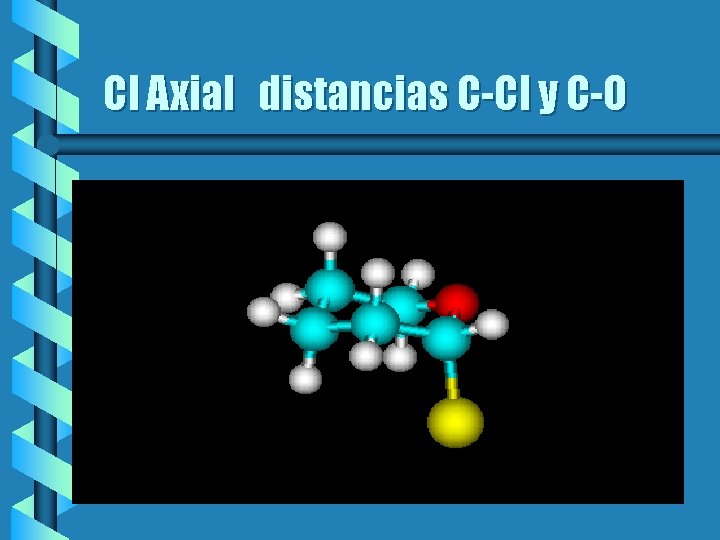
Efecto de los orbitales en las uniónes C-Cl y C-O b La interacción de los orbitales afectan las uniónes C 2 -0 y C 2 -Cl. La unión C 2 -0 debe de ser más fuerte y por lo tanto de menor longitud que C 6 -O en la configuración axial y en la ecuatorial deben de ser iguales. La unión C 2 -Cl debe ser más debil y por lo tanto más larga en la configuración axil. Y más corta en la ecuatorial.

Cloro Axial Distancias b Los valores de las uniones son: b En la unión C-Cl mide 1. 7946 b En la unión C 2 -O es de 1. 407 b La distancia C 6 -0 es de 1. 428

Cl Axial distancias C-Cl y C-O

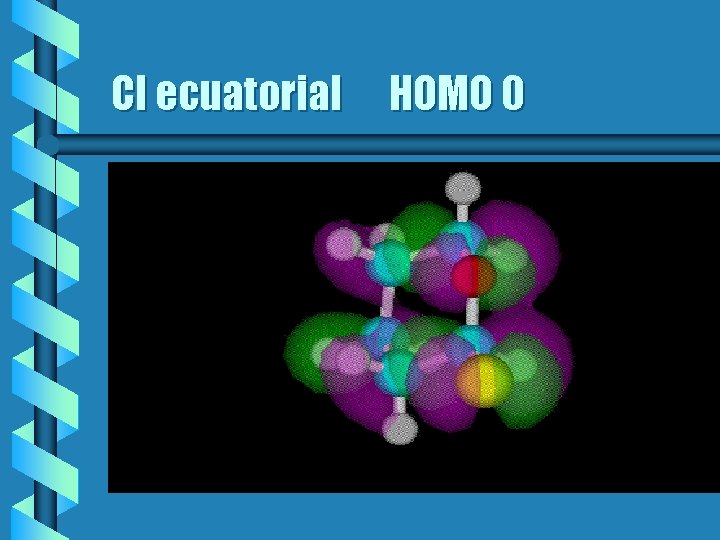
Cl ecuatorial orbitales b Cuando se calculan los orbitales moleculares HOMO 0 del compuesto ecuatorial se observa que no hay un traslapamiento entre los orbitales de los electrones del O y el Cl. Lo que reduce su estabilidad.

Cl ecuatorial HOMO 0

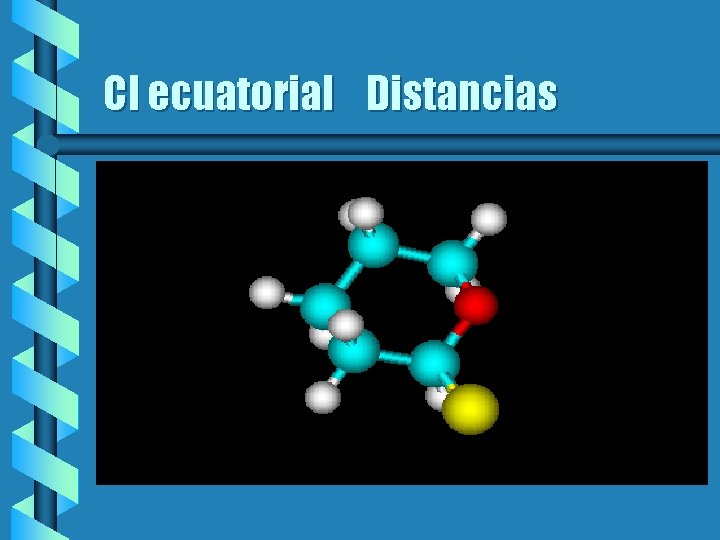
Cl ecuatorial distancias b En el caso del Cl ecuatorial no hay el intercambio efectivo de orbitales, las uniones de C-0 son iguales y la de C-Cl es más corta b C 2 -0 1. 4259 b C 6 -0 1. 4259 b C-Cl 1. 7698

Cl ecuatorial Distancias

Experimento b En la presente práctica tendremos que calcular las estabilidades relativas de una serie de compuestos para interpretar cual de ellos es más estable por el efecto anomérico. b Los cálculos se harán en AM 1 y utilizaremos los calores de formación.

Compuestos b Iniciaremos los cálculos con el clorociclohexano (A) (dif de energía en los confórmeros experimental 0. 5 Kcal/mol) y con el 2 -clorotetrahidro-pirano (B) (dif de energía 1. 8 Kcal/mol) b Hay que construir los confórmeros axiales y ecuatoriales

Resolver b Comparar la energía teórica con la experimental. b Analizar las longitudes de las uniones b Analizar los orbiltales HOMO b Hacer estos cálculos para los tetrahidropiranos donde el sustituyente sea: CF 3; NO 2; CN; F; Br.

Resolver II b Obtener los valores para los confórmeros del metilciclohexano y para el 2 -metiltetrahidropirano. Explicar usando los calores de formación obtenidos con AM 1 el porque la preferencia ecuatorial se reduce en el anillo del tetrahidropirano.
 Formulas estructurales
Formulas estructurales Cual es el grupo funcional de los alquinos
Cual es el grupo funcional de los alquinos 1 1-diclorociclopentano
1 1-diclorociclopentano Carlos rius
Carlos rius Julio casares medrano
Julio casares medrano Bosc equatorial
Bosc equatorial Aritmética computacional
Aritmética computacional Complexidade computacional
Complexidade computacional Complexidade computacional
Complexidade computacional Sistema computacional
Sistema computacional Psiquiatria computacional
Psiquiatria computacional Ufrj
Ufrj Auditoria computacional
Auditoria computacional Complexidade computacional
Complexidade computacional Carolina alonso gonzalez
Carolina alonso gonzalez Jhonny alonso
Jhonny alonso Jairo alonso bautista
Jairo alonso bautista Estatica fetal
Estatica fetal Amparo rocha alonso
Amparo rocha alonso Alonso formula alquinos
Alonso formula alquinos Buteno
Buteno