Departamento de Ciencias Prof Carolina Guerra EL AGUA











- Slides: 17

Departamento de Ciencias Prof. : Carolina Guerra EL AGUA v. Comprender las características del agua en las soluciones

INTRODUCCIÓN El agua constituye entre el 50 y el 90% de la masa de los seres vivos. Es la única sustancia que se presenta en los 3 estados de la materia con gran estabilidad. Tiene propiedades extraordinarias y puede disolver gran cantidad de sustancias.

¿CUÁL ES LA COMPOSICIÓN DEL AGUA? El agua contiene dos átomos de hidrogeno y uno de oxígeno. Su formación es una reacción exotérmica (libera gran cantidad de energía) y en cambio la separación de átomos es endergónica (consume energía).

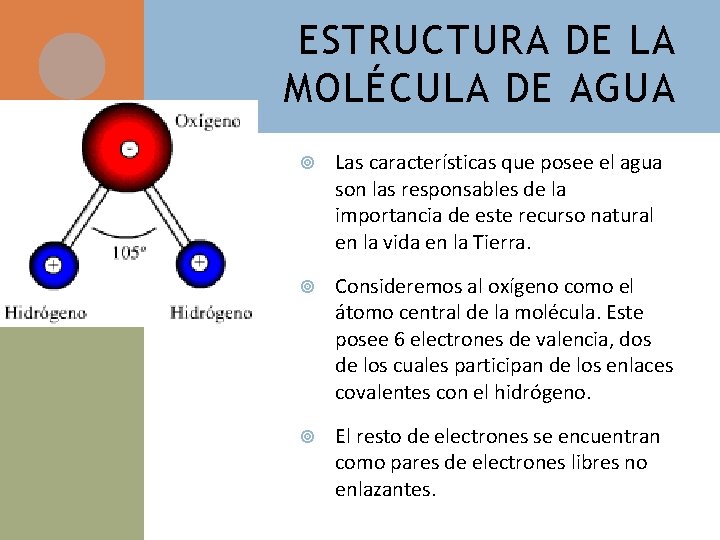
ESTRUCTURA DE LA MOLÉCULA DE AGUA Las características que posee el agua son las responsables de la importancia de este recurso natural en la vida en la Tierra. Consideremos al oxígeno como el átomo central de la molécula. Este posee 6 electrones de valencia, dos de los cuales participan de los enlaces covalentes con el hidrógeno. El resto de electrones se encuentran como pares de electrones libres no enlazantes.

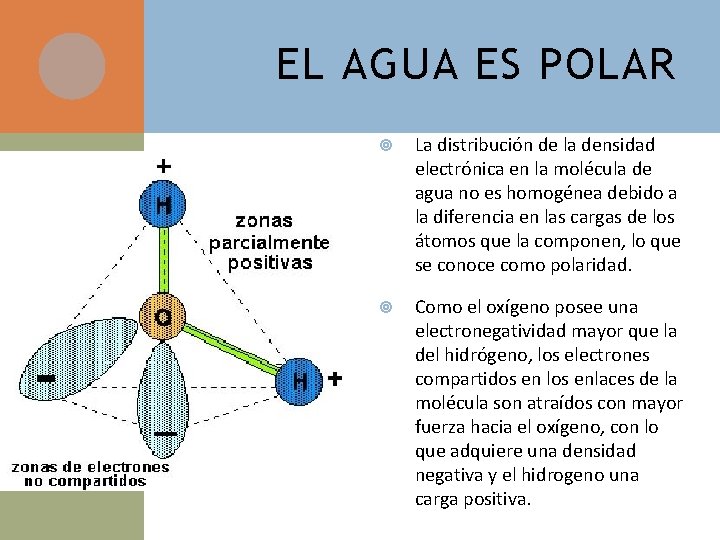
EL AGUA ES POLAR La distribución de la densidad electrónica en la molécula de agua no es homogénea debido a la diferencia en las cargas de los átomos que la componen, lo que se conoce como polaridad. Como el oxígeno posee una electronegatividad mayor que la del hidrógeno, los electrones compartidos en los enlaces de la molécula son atraídos con mayor fuerza hacia el oxígeno, con lo que adquiere una densidad negativa y el hidrogeno una carga positiva.

EL AGUA Y SUS INTERACCIONES En las moléculas de agua, el extremo positivo (hidrógenos) resulta atraído por el extremo negativo (oxígeno) de la molécula mas cercana. Esto sucede entre todas las moléculas de agua, formando una red. Estas interacciones se conocen como puentes de hidrógenos.


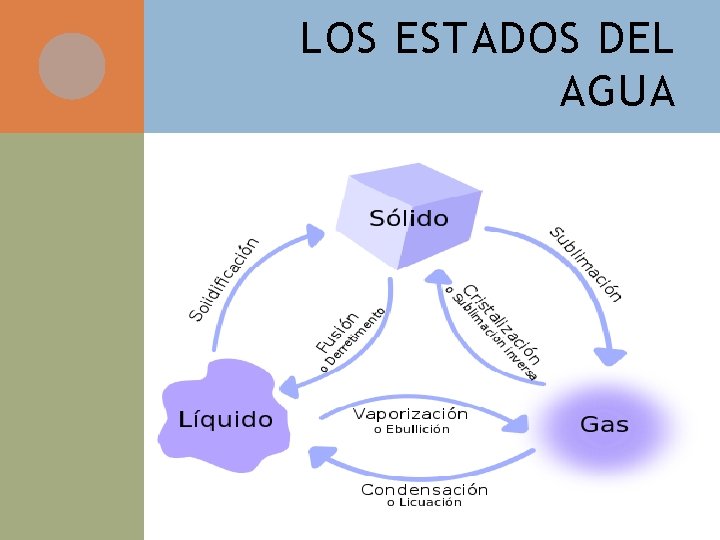
LOS ESTADOS DEL AGUA

PROPIEDADES DEL AGUA Es importante considerar las diferencias entre una propiedad y una característica. Una característica es algo común a un grupo de sustancias o elementos, pero que no siempre es igual en todos sus aspectos. Por ejemplo, si algo es amarillo puede ser más o menos claro. Una propiedad es algo constante a todo el conjunto. Por ejemplo, el agua siempre ebulle a la misma temperatura si las condiciones son las mismas (nivel del mar a 760 mm de Hg)

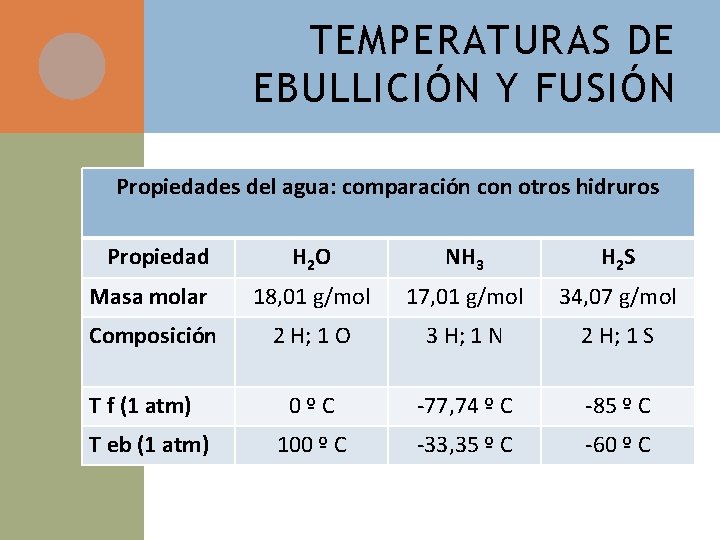
TEMPERATURAS DE EBULLICIÓN Y FUSIÓN Propiedades del agua: comparación con otros hidruros Propiedad H 2 O NH 3 H 2 S Masa molar 18, 01 g/mol 17, 01 g/mol 34, 07 g/mol Composición 2 H; 1 O 3 H; 1 N 2 H; 1 S 0ºC -77, 74 º C -85 º C 100 º C -33, 35 º C -60 º C T f (1 atm) T eb (1 atm)

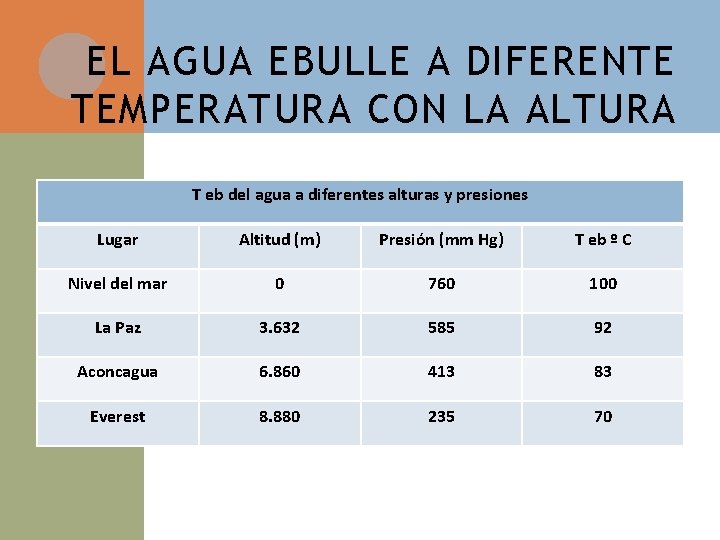
EL AGUA EBULLE A DIFERENTE TEMPERATURA CON LA ALTURA T eb del agua a diferentes alturas y presiones Lugar Altitud (m) Presión (mm Hg) T eb º C Nivel del mar 0 760 100 La Paz 3. 632 585 92 Aconcagua 6. 860 413 83 Everest 8. 880 235 70

¿CÓMO SE EXPLICA EL COMPORTAMIENTO ANÓMALO DE LA DENSIDAD DEL AGUA? Si se disminuye la temperatura del agua a partir de los 100 ºC, se va produciendo una contradicción del volumen, lo que implica un incremento de la densidad del agua. La máxima contracción o la densidad máxima del agua se alcanzan a los 3, 98 º C. Si se continúa con el descenso de la temperatura, pero ahora desde los 3, 98 º C, el volumen aumenta y la densidad disminuye; esto ocurre hasta los 0º C, en que el agua se solidifica.

Es por esta razón que el paso de agua líquida a hielo va acompañado de un considerable incremento de volumen: 100 L de agua líquida a 0º C producen 109, 08 L de hielo a la misma temperatura. Es lo que observas cuando dejas congelando agua en un vaso o en botella: su volumen aumenta. ¿Por qué el hielo flota en el agua?

CAPACIDAD CALORÍFICA Se define como la cantidad de energía necesaria para elevar la temperatura de un gramo de la sustancia en un Kelvin o en un grado Celsius. Las unidades son J/g K o cal/g ºC En el caso del agua, corresponde a 1 cal/gºC o a 4, 18 J/gºC Este valor se define como caloría. La capacidad calorífica del agua es muy alta. Esto implica que el agua es capaz de almacenar mucha energía.

TENSIÓN SUPERFICIAL Las fuerzas de cohesión entre las moléculas de la superficie de un líquido son las responsables de la tensión superficial. Las moléculas de agua que se ubican en la superficie del líquido tienen contacto con las moléculas de agua que están debajo de ellas, no con las del interior del líquido. Por este motivo, las moléculas que se encuentran en la superficie se cohesionan con más fuerza a aquellas que están inmediatamente bajo ellas y así forman un flim o membrana elástica en la superficie del líquido.


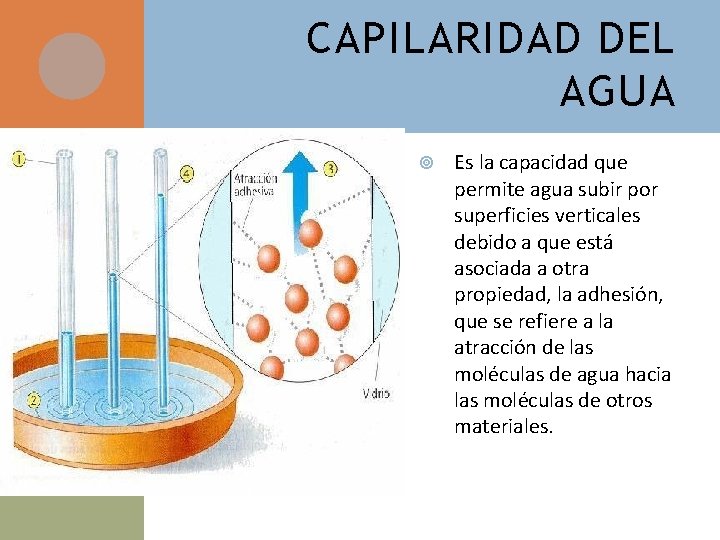
CAPILARIDAD DEL AGUA Es la capacidad que permite agua subir por superficies verticales debido a que está asociada a otra propiedad, la adhesión, que se refiere a la atracción de las moléculas de agua hacia las moléculas de otros materiales.
 Ies suel ciencias naturales
Ies suel ciencias naturales Virginia, maryland, north carolina, south carolina, georgia
Virginia, maryland, north carolina, south carolina, georgia Georgia, south carolina, north carolina, virginia, maryland
Georgia, south carolina, north carolina, virginia, maryland Map of north carolina and south carolina
Map of north carolina and south carolina Virginia, maryland, north carolina, south carolina, georgia
Virginia, maryland, north carolina, south carolina, georgia Preparatoria abierta en puebla
Preparatoria abierta en puebla La señora guajardo compra un departamento
La señora guajardo compra un departamento Projeto doutorado
Projeto doutorado Organización del departamento de enfermería
Organización del departamento de enfermería Potencialidad productiva de cochabamba
Potencialidad productiva de cochabamba Organigrama de departamento de contabilidad
Organigrama de departamento de contabilidad Departamento ceres
Departamento ceres Objetivos del departamento de enfermería
Objetivos del departamento de enfermería Departamento solicitante
Departamento solicitante Huila clima
Huila clima Departamento forestal
Departamento forestal Finestra terapeutica
Finestra terapeutica Departamento de zootecnia ufpr
Departamento de zootecnia ufpr