COMPLEJOS podrn GIOMAR PINILLA SILVA COLEGIO CHAMPAGNAT UNIVERSIDAD



![Corchetes [ ] dentro de estos se escriben los elementos que conforman la esfera Corchetes [ ] dentro de estos se escriben los elementos que conforman la esfera](https://slidetodoc.com/presentation_image_h/c2957a2e6c7a4b589aaa2e65920352ac/image-5.jpg)













![EJERCICIOS 1. Cuál es el nombre sistemático del complejo [Cr(H 20)4 Cl 2]Cl • EJERCICIOS 1. Cuál es el nombre sistemático del complejo [Cr(H 20)4 Cl 2]Cl •](https://slidetodoc.com/presentation_image_h/c2957a2e6c7a4b589aaa2e65920352ac/image-19.jpg)


- Slides: 21

COMPLEJOS podrán GIOMAR PINILLA SILVA COLEGIO CHAMPAGNAT UNIVERSIDAD PEDAGÓGICA NACIONAL

¿QUÉ SON LOS COMPUESTOS DE COORDINACIÓN? • Complejo o quelato, es una sustancia química constituida típicamente por un átomo central, con orbitales de valencia desocupados, (metal de transición). Esfera de coordinación.

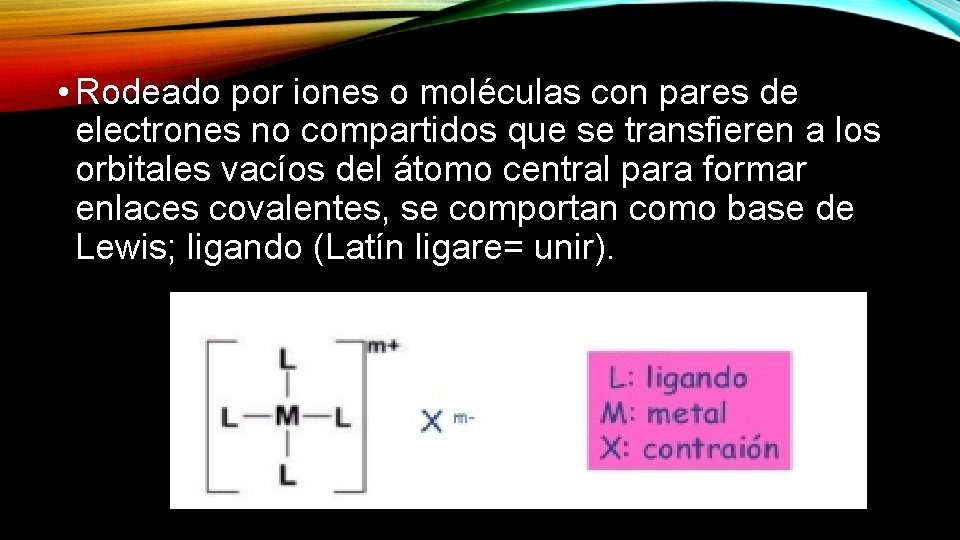
• Rodeado por iones o moléculas con pares de electrones no compartidos que se transfieren a los orbitales vacíos del átomo central para formar enlaces covalentes, se comportan como base de Lewis; ligando (Latín ligare= unir).

GEOMETRÍA • Tetraédrica – cuadrada plana = (4) ligandos • Octaédrica = (6) ligandos
![Corchetes dentro de estos se escriben los elementos que conforman la esfera Corchetes [ ] dentro de estos se escriben los elementos que conforman la esfera](https://slidetodoc.com/presentation_image_h/c2957a2e6c7a4b589aaa2e65920352ac/image-5.jpg)
Corchetes [ ] dentro de estos se escriben los elementos que conforman la esfera de coordinación, separando las otras partes del compuesto.

Los cuatro ligandos de amoniaco, están enlazados directamente al cobre.

o. Alfred Werner (1866 -1919) o 1893; Demostró que las moléculas neutras que participaban en la formación de un complejo, estaban directamente enlazadas a un metal. o. Valencia primaria= número de oxidación (iones) o. Valencia secundaria=número de coordinación, ligandos (neutros o iones). HISTORIA

USOS DE LOS COMPLEJOS • Medicina (cascada de coagulación) • Laboratorios • Pinturas • Productos de limpieza

COLOR • Una sustancia posee color, cuando absorbe determinadas longitudes de onda electromagnéticas en el espectro visible • La absorción en las diferentes longitudes de onda es debido a la transición de dos estados energéticos. • En los complejos : Depende del metal – el estado de oxidación de este, el ligando unido y la concentración.

NOMENCLATURA • El catión se escribe antes que el anión.

• En un ion complejo, primero se nombran los ligandos, en orden alfabético y al final el ion metálico. • El nombre de los ligandos aniónicos terminan en la letra (o).


• El ligando neutro suele tomar el nombre de la molécula. EXCEPCINES: H 20 (acuo) CO 2 (carbonilo) NH 3 (amino)


• Si el ligando contiene algún prefijo griego, se utilizan los prefijos bis(2)- tris (3)- tetraquis (4) para indicar el número de ligandos presentes. • EJEMPLO: Si están dos ligandos iguales sería: di (Etilen amino)2, el nombre correspondiente es: Bis(Etilendiamino)

• El número de oxidación del metal se escribe en número romano después del nombre del metal. • EJEMPLO: [Cr(NH 3)4 Cl 2]- ; EL número romano es (III) indicando el número de oxidación del Cr. Se nombra: Ion tetraminodiclorocromo(III)

• Si el complejo es un anión, su nombre termina en ato, si el complejo es neutro o catiónico no se usa ningún sufijo. EJEMPLO: [Fe(CN)6]-4 Ion hexacianoferrato(II).

![EJERCICIOS 1 Cuál es el nombre sistemático del complejo CrH 204 Cl 2Cl EJERCICIOS 1. Cuál es el nombre sistemático del complejo [Cr(H 20)4 Cl 2]Cl •](https://slidetodoc.com/presentation_image_h/c2957a2e6c7a4b589aaa2e65920352ac/image-19.jpg)
EJERCICIOS 1. Cuál es el nombre sistemático del complejo [Cr(H 20)4 Cl 2]Cl • 2. Formula del: Cloruro de Pentaaminoclorocobalto(III). Hexacianoferrato (III) de galio.

BIBLIOGRAFÍA • Chang, Raymond Química, 7 ed. Mc. Graw-Hill, México, 1999.

• Gracias
 Marista terra vermelha
Marista terra vermelha Champagnat sie web
Champagnat sie web Uniforme marcellin champagnat
Uniforme marcellin champagnat Marcellin champagnat biography
Marcellin champagnat biography Jean marie granjon
Jean marie granjon Gustavo rojas pinilla
Gustavo rojas pinilla Podrn
Podrn Oscar pinilla
Oscar pinilla Carta de reintegro laboral
Carta de reintegro laboral Subasta
Subasta Podrn
Podrn Podrn
Podrn Clases esqui la pinilla
Clases esqui la pinilla Forma exponencial numeros complejos
Forma exponencial numeros complejos Es un indicador de salud
Es un indicador de salud 10 sonidos complejos
10 sonidos complejos Complejos en forma polar
Complejos en forma polar Pasar de polar a binomica
Pasar de polar a binomica Propiedades de los numeros complejos
Propiedades de los numeros complejos Esfingolipidos ejemplos
Esfingolipidos ejemplos Sistemas mecanicos
Sistemas mecanicos Forma binómica
Forma binómica