CANCERS DU PANCRAS DE LINTESTIN GRLE ET DES









- Slides: 37

CANCERS DU PANCRÉAS, DE L’INTESTIN GRÊLE ET DES VOIES BILIAIRES

Cancers du pancréas, de l’intestin grêle et des voies biliaires CANCER DU PANCRÉAS

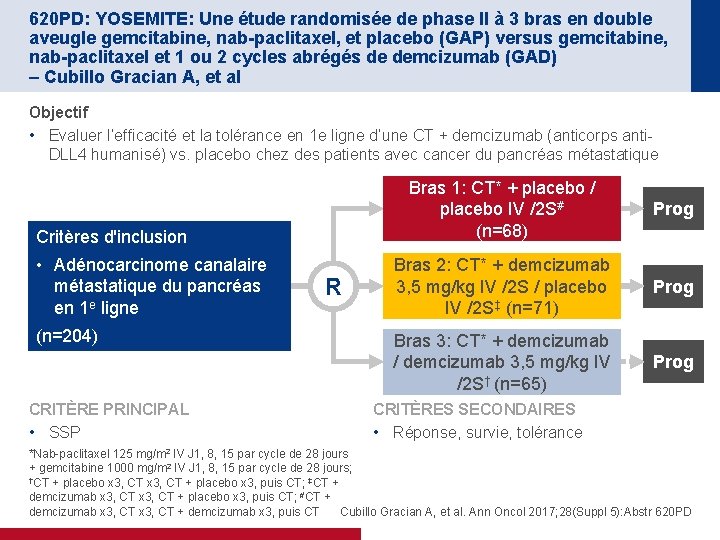
620 PD: YOSEMITE: Une étude randomisée de phase II à 3 bras en double aveugle gemcitabine, nab-paclitaxel, et placebo (GAP) versus gemcitabine, nab-paclitaxel et 1 ou 2 cycles abrégés de demcizumab (GAD) – Cubillo Gracian A, et al Objectif • Evaluer l’efficacité et la tolérance en 1 e ligne d’une CT + demcizumab (anticorps anti. DLL 4 humanisé) vs. placebo chez des patients avec cancer du pancréas métastatique Critères d'inclusion • Adénocarcinome canalaire métastatique du pancréas en 1 e ligne (n=204) CRITÈRE PRINCIPAL • SSP R Bras 1: CT* + placebo / placebo IV /2 S# (n=68) Prog Bras 2: CT* + demcizumab 3, 5 mg/kg IV /2 S / placebo IV /2 S‡ (n=71) Prog Bras 3: CT* + demcizumab / demcizumab 3, 5 mg/kg IV /2 S† (n=65) Prog CRITÈRES SECONDAIRES • Réponse, survie, tolérance *Nab-paclitaxel 125 mg/m 2 IV J 1, 8, 15 par cycle de 28 jours + gemcitabine 1000 mg/m 2 IV J 1, 8, 15 par cycle de 28 jours; †CT + placebo x 3, puis CT; ‡CT + demcizumab x 3, CT + placebo x 3, puis CT; #CT + demcizumab x 3, puis CT Cubillo Gracian A, et al. Ann Oncol 2017; 28(Suppl 5): Abstr 620 PD

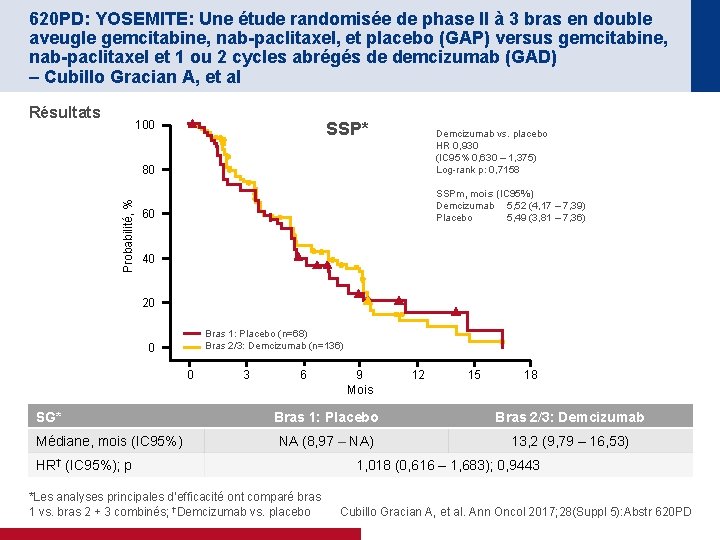
620 PD: YOSEMITE: Une étude randomisée de phase II à 3 bras en double aveugle gemcitabine, nab-paclitaxel, et placebo (GAP) versus gemcitabine, nab-paclitaxel et 1 ou 2 cycles abrégés de demcizumab (GAD) – Cubillo Gracian A, et al Résultats Probabilité, % 100 SSP* 80 Demcizumab vs. placebo HR 0, 930 (IC 95% 0, 630 – 1, 375) Log-rank p: 0, 7158 60 SSPm, mois (IC 95%) Demcizumab 5, 52 (4, 17 – 7, 39) Placebo 5, 49 (3, 81 – 7, 36) 40 20 Bras 1: Placebo (n=68) Bras 2/3: Demcizumab (n=136) 0 0 SG* Médiane, mois (IC 95%) 3 6 9 Mois 12 15 18 Bras 1: Placebo Bras 2/3: Demcizumab NA (8, 97 – NA) 13, 2 (9, 79 – 16, 53) HR† (IC 95%); p *Les analyses principales d’efficacité ont comparé bras 1 vs. bras 2 + 3 combinés; †Demcizumab vs. placebo 1, 018 (0, 616 – 1, 683); 0, 9443 Cubillo Gracian A, et al. Ann Oncol 2017; 28(Suppl 5): Abstr 620 PD

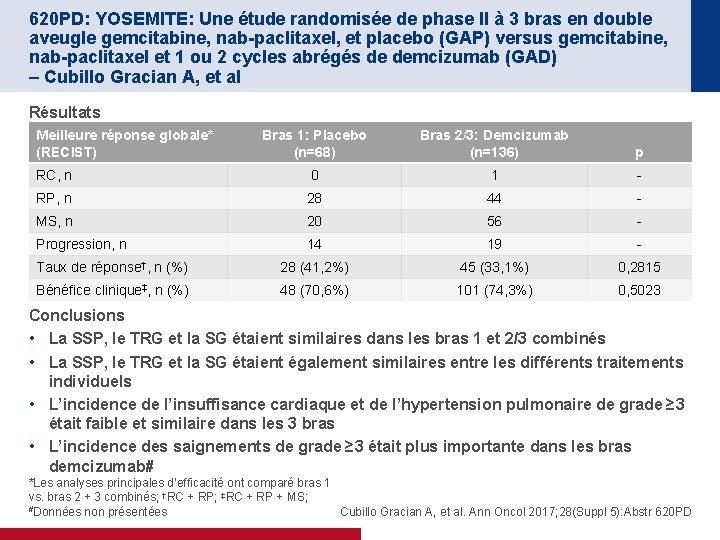
620 PD: YOSEMITE: Une étude randomisée de phase II à 3 bras en double aveugle gemcitabine, nab-paclitaxel, et placebo (GAP) versus gemcitabine, nab-paclitaxel et 1 ou 2 cycles abrégés de demcizumab (GAD) – Cubillo Gracian A, et al Résultats Meilleure réponse globale* (RECIST) Bras 1: Placebo (n=68) Bras 2/3: Demcizumab (n=136) p RC, n 0 1 - RP, n 28 44 - MS, n 20 56 - Progression, n 14 19 - Taux de réponse†, n (%) 28 (41, 2%) 45 (33, 1%) 0, 2815 Bénéfice clinique‡, n (%) 48 (70, 6%) 101 (74, 3%) 0, 5023 Conclusions • La SSP, le TRG et la SG étaient similaires dans les bras 1 et 2/3 combinés • La SSP, le TRG et la SG étaient également similaires entre les différents traitements individuels • L’incidence de l’insuffisance cardiaque et de l’hypertension pulmonaire de grade ≥ 3 était faible et similaire dans les 3 bras • L’incidence des saignements de grade ≥ 3 était plus importante dans les bras demcizumab# *Les analyses principales d’efficacité ont comparé bras 1 vs. bras 2 + 3 combinés; †RC + RP; ‡RC + RP + MS; #Données non présentées Cubillo Gracian A, et al. Ann Oncol 2017; 28(Suppl 5): Abstr 620 PD

621 PD: Une étude de phase 2 b de l’éryaspase en association avec gemcitabine ou FOLFOX en traitement de 2 e ligne chez des patients avec adénocarcinome du pancréas métastatique (NCT 02195180) – Hammel P, et al Objectif • Evaluer l’éryaspase + CT en 2 e ligne chez des patients avec adénocarcinome du pancréas métastatique Critères d'inclusion • Adénocarcinome métastatique du pancréas • Echec d’une 1 e ligne Eryaspase 100 U/kg J 3, 17 + CT* /4 S (n=95) Prog CT* seule x 6 /4 S (n=46) Prog R 2: 1 • ECOG PS 0– 1 (n=141) CRITÈRE PRINCIPAUX • SG + SSP (asparagine synthétase [ASNS] 0/1+): étude positive si HR <0, 85 quelle que soit la significativité *Gemcitabine 1000 mg/m 2 30 min IV J 1, 8, 15 ou m. FOLFOX 6 (oxaliplatine 85 mg/m 2 IV J 1, 15 + leucovorine 200 mg/m 2 IV J 1, 15 + 5 FU 400 mg/m 2 IV + 5 FU 2400 mg/m 2 J 1, 15 perfusion continue J 1, 2 et J 15, 16) CRITÈRES SECONDAIRES • SG + SSP dans les populations clés • TRG, tolérance, Qo. L Hammel P, et al. Ann Oncol 2017; 28(Suppl 5): Abstr 621 PD

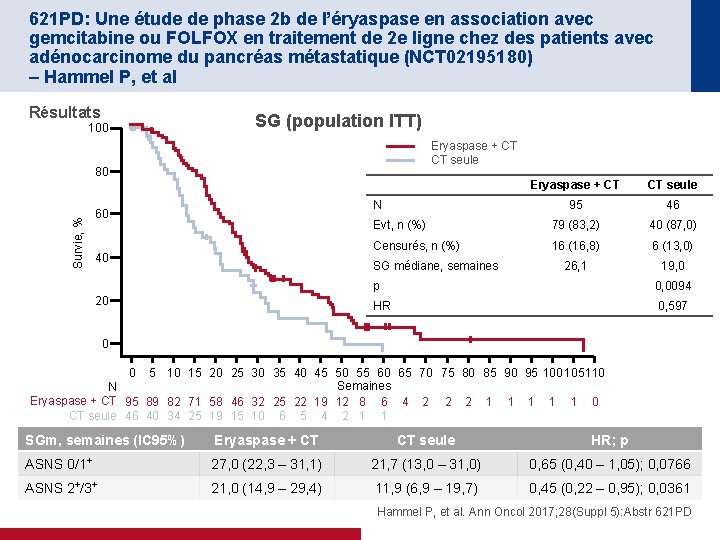
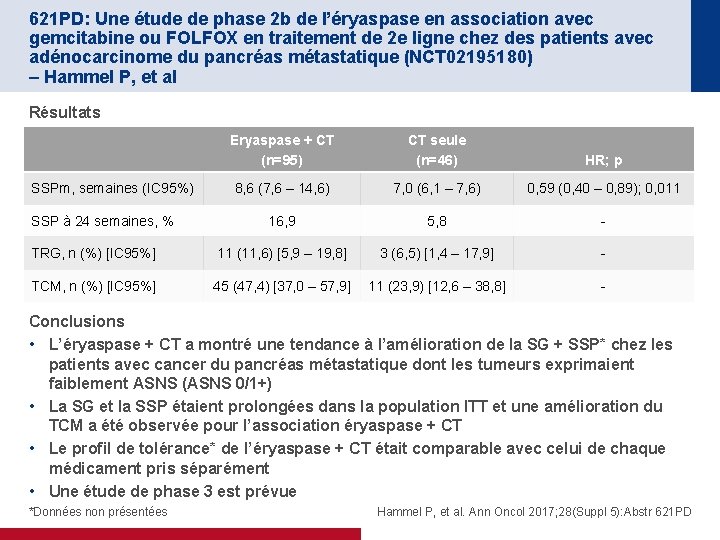
621 PD: Une étude de phase 2 b de l’éryaspase en association avec gemcitabine ou FOLFOX en traitement de 2 e ligne chez des patients avec adénocarcinome du pancréas métastatique (NCT 02195180) – Hammel P, et al Résultats 100 SG (population ITT) Eryaspase + CT CT seule Survie, % 80 Eryaspase + CT CT seule 95 46 Evt, n (%) 79 (83, 2) 40 (87, 0) Censurés, n (%) 16 (16, 8) 6 (13, 0) 26, 1 19, 0 N 60 40 SG médiane, semaines 20 p 0, 0094 HR 0, 597 0 0 5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 80 85 90 95 100 105 110 Semaines N Eryaspase + CT 95 89 82 71 58 46 32 25 22 19 12 8 6 4 2 2 2 1 1 1 0 CT seule 46 40 34 25 19 15 10 6 5 4 2 1 1 SGm, semaines (IC 95%) Eryaspase + CT CT seule HR; p ASNS 0/1+ 27, 0 (22, 3 – 31, 1) 21, 7 (13, 0 – 31, 0) 0, 65 (0, 40 – 1, 05); 0, 0766 ASNS 2+/3+ 21, 0 (14, 9 – 29, 4) 11, 9 (6, 9 – 19, 7) 0, 45 (0, 22 – 0, 95); 0, 0361 Hammel P, et al. Ann Oncol 2017; 28(Suppl 5): Abstr 621 PD

621 PD: Une étude de phase 2 b de l’éryaspase en association avec gemcitabine ou FOLFOX en traitement de 2 e ligne chez des patients avec adénocarcinome du pancréas métastatique (NCT 02195180) – Hammel P, et al Résultats Eryaspase + CT (n=95) CT seule (n=46) HR; p 8, 6 (7, 6 – 14, 6) 7, 0 (6, 1 – 7, 6) 0, 59 (0, 40 – 0, 89); 0, 011 16, 9 5, 8 - TRG, n (%) [IC 95%] 11 (11, 6) [5, 9 – 19, 8] 3 (6, 5) [1, 4 – 17, 9] - TCM, n (%) [IC 95%] 45 (47, 4) [37, 0 – 57, 9] 11 (23, 9) [12, 6 – 38, 8] - SSPm, semaines (IC 95%) SSP à 24 semaines, % Conclusions • L’éryaspase + CT a montré une tendance à l’amélioration de la SG + SSP* chez les patients avec cancer du pancréas métastatique dont les tumeurs exprimaient faiblement ASNS (ASNS 0/1+) • La SG et la SSP étaient prolongées dans la population ITT et une amélioration du TCM a été observée pour l’association éryaspase + CT • Le profil de tolérance* de l’éryaspase + CT était comparable avec celui de chaque médicament pris séparément • Une étude de phase 3 est prévue *Données non présentées Hammel P, et al. Ann Oncol 2017; 28(Suppl 5): Abstr 621 PD

622 PD: Nab-Paclitaxel plus gemcitabine chez les patients avec cancer du pancréas localement avancé (CPLA): résultats d’analyse intermédiaire d’efficacité et de tolérance de l’étude de phase 2 LAPACT – Philip PA, et al Objectif • Evaluer l’efficacité et la tolérance du nab-paclitaxel + gemcitabine en 1 e ligne chez des patients avec cancer du pancréas localement avancé (CPLA) non résécable Critères d'inclusion • CPLA non prétraité, non résécable (n=107) Phase d’induction Nab-paclitaxel* + gemcitabine† CRITÈRE PRINCIPAL • DET *125 mg/m 2 /3 à 4 S ≤ 6 cycles; † 1000 mg/m 2 /3 à 4 S ≤ 6 cycles Choix de l’investigateur: • Nab-paclitaxel + gemcitabine • RCT • Résection chirurgicale CRITÈRES SECONDAIRES • TCM, TRG, SSP, SG, tolérance, Qo. L Philip PA, et al. Ann Oncol 2017; 28(Suppl 5): Abstr 622 PD

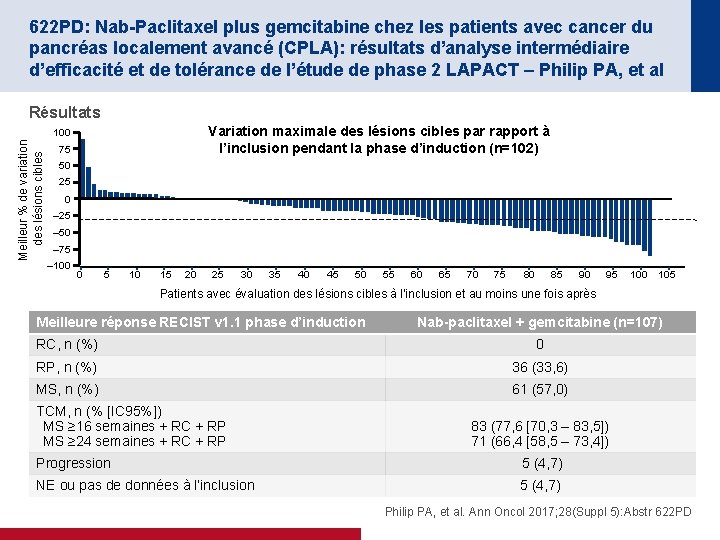
622 PD: Nab-Paclitaxel plus gemcitabine chez les patients avec cancer du pancréas localement avancé (CPLA): résultats d’analyse intermédiaire d’efficacité et de tolérance de l’étude de phase 2 LAPACT – Philip PA, et al Résultats Variation maximale des lésions cibles par rapport à l’inclusion pendant la phase d’induction (n=102) Meilleur % de variation des lésions cibles 100 75 50 25 0 – 25 – 50 – 75 – 100 0 5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 80 85 90 95 100 105 Patients avec évaluation des lésions cibles à l’inclusion et au moins une fois après Meilleure réponse RECIST v 1. 1 phase d’induction Nab-paclitaxel + gemcitabine (n=107) RC, n (%) 0 RP, n (%) 36 (33, 6) MS, n (%) 61 (57, 0) TCM, n (% [IC 95%]) MS ≥ 16 semaines + RC + RP MS ≥ 24 semaines + RC + RP 83 (77, 6 [70, 3 – 83, 5]) 71 (66, 4 [58, 5 – 73, 4]) Progression 5 (4, 7) NE ou pas de données à l’inclusion 5 (4, 7) Philip PA, et al. Ann Oncol 2017; 28(Suppl 5): Abstr 622 PD

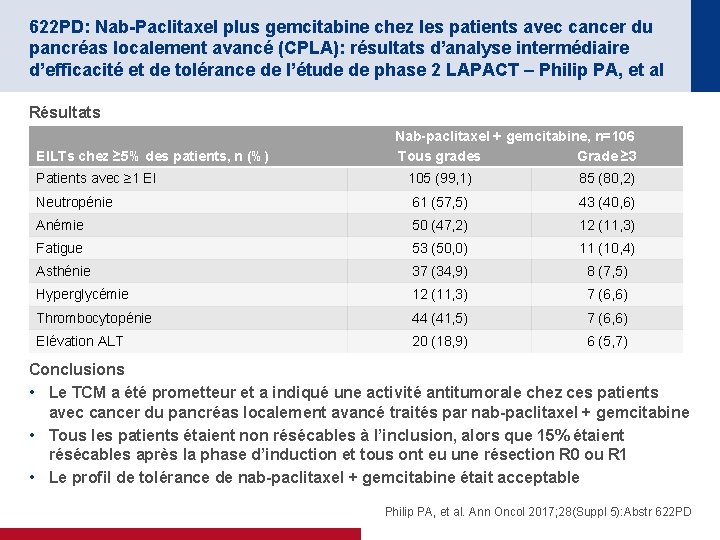
622 PD: Nab-Paclitaxel plus gemcitabine chez les patients avec cancer du pancréas localement avancé (CPLA): résultats d’analyse intermédiaire d’efficacité et de tolérance de l’étude de phase 2 LAPACT – Philip PA, et al Résultats EILTs chez ≥ 5% des patients, n (%) Nab-paclitaxel + gemcitabine, n=106 Tous grades Grade ≥ 3 Patients avec ≥ 1 EI 105 (99, 1) 85 (80, 2) Neutropénie 61 (57, 5) 43 (40, 6) Anémie 50 (47, 2) 12 (11, 3) Fatigue 53 (50, 0) 11 (10, 4) Asthénie 37 (34, 9) 8 (7, 5) Hyperglycémie 12 (11, 3) 7 (6, 6) Thrombocytopénie 44 (41, 5) 7 (6, 6) Elévation ALT 20 (18, 9) 6 (5, 7) Conclusions • Le TCM a été prometteur et a indiqué une activité antitumorale chez ces patients avec cancer du pancréas localement avancé traités par nab-paclitaxel + gemcitabine • Tous les patients étaient non résécables à l’inclusion, alors que 15% étaient résécables après la phase d’induction et tous ont eu une résection R 0 ou R 1 • Le profil de tolérance de nab-paclitaxel + gemcitabine était acceptable Philip PA, et al. Ann Oncol 2017; 28(Suppl 5): Abstr 622 PD

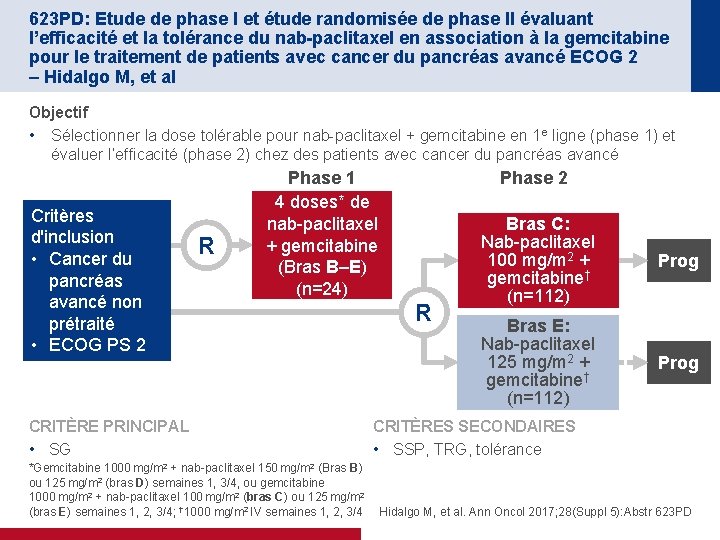
623 PD: Etude de phase I et étude randomisée de phase II évaluant l’efficacité et la tolérance du nab-paclitaxel en association à la gemcitabine pour le traitement de patients avec cancer du pancréas avancé ECOG 2 – Hidalgo M, et al Objectif • Sélectionner la dose tolérable pour nab-paclitaxel + gemcitabine en 1 e ligne (phase 1) et évaluer l’efficacité (phase 2) chez des patients avec cancer du pancréas avancé Critères d'inclusion • Cancer du pancréas avancé non prétraité • ECOG PS 2 R Phase 1 4 doses* de nab-paclitaxel + gemcitabine (Bras B–E) (n=24) CRITÈRE PRINCIPAL • SG *Gemcitabine 1000 mg/m 2 + nab-paclitaxel 150 mg/m 2 (Bras B) ou 125 mg/m 2 (bras D) semaines 1, 3/4, ou gemcitabine 1000 mg/m 2 + nab-paclitaxel 100 mg/m 2 (bras C) ou 125 mg/m 2 (bras E) semaines 1, 2, 3/4; † 1000 mg/m 2 IV semaines 1, 2, 3/4 Phase 2 R Bras C: Nab-paclitaxel 100 mg/m 2 + gemcitabine† (n=112) Prog Bras E: Nab-paclitaxel 125 mg/m 2 + gemcitabine† (n=112) Prog CRITÈRES SECONDAIRES • SSP, TRG, tolérance Hidalgo M, et al. Ann Oncol 2017; 28(Suppl 5): Abstr 623 PD

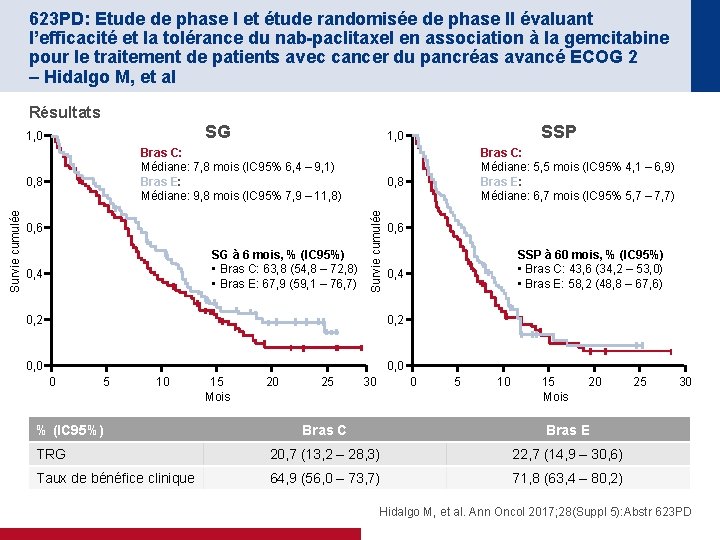
623 PD: Etude de phase I et étude randomisée de phase II évaluant l’efficacité et la tolérance du nab-paclitaxel en association à la gemcitabine pour le traitement de patients avec cancer du pancréas avancé ECOG 2 – Hidalgo M, et al Résultats SG 1, 0 Bras C: Médiane: 7, 8 mois (IC 95% 6, 4 – 9, 1) Bras E: Médiane: 9, 8 mois (IC 95% 7, 9 – 11, 8) 0, 6 SG à 6 mois, % (IC 95%) • Bras C: 63, 8 (54, 8 – 72, 8) • Bras E: 67, 9 (59, 1 – 76, 7) 0, 4 0, 6 0, 2 0, 0 5 10 % (IC 95%) 15 Mois 20 25 30 SSP à 60 mois, % (IC 95%) • Bras C: 43, 6 (34, 2 – 53, 0) • Bras E: 58, 2 (48, 8 – 67, 6) 0, 4 0, 2 0 Bras C: Médiane: 5, 5 mois (IC 95% 4, 1 – 6, 9) Bras E: Médiane: 6, 7 mois (IC 95% 5, 7 – 7, 7) 0, 8 Survie cumulée 0, 8 SSP 1, 0 0 5 10 15 Mois 20 Bras C Bras E TRG 20, 7 (13, 2 – 28, 3) 22, 7 (14, 9 – 30, 6) Taux de bénéfice clinique 64, 9 (56, 0 – 73, 7) 71, 8 (63, 4 – 80, 2) 25 30 Hidalgo M, et al. Ann Oncol 2017; 28(Suppl 5): Abstr 623 PD

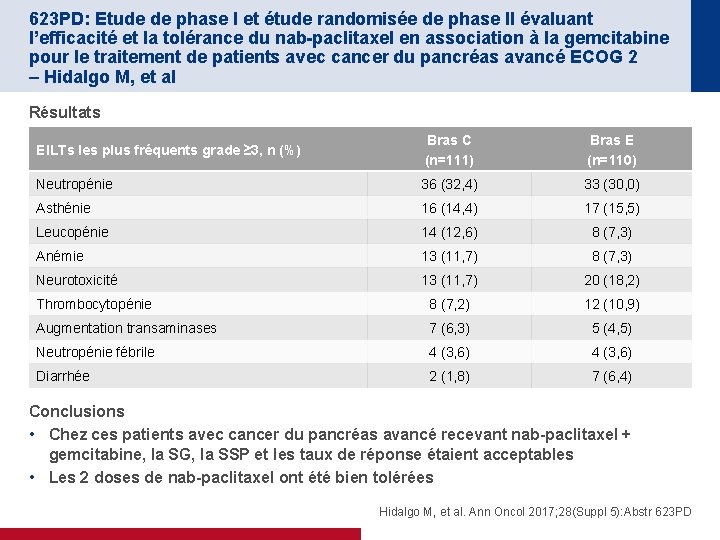
623 PD: Etude de phase I et étude randomisée de phase II évaluant l’efficacité et la tolérance du nab-paclitaxel en association à la gemcitabine pour le traitement de patients avec cancer du pancréas avancé ECOG 2 – Hidalgo M, et al Résultats EILTs les plus fréquents grade ≥ 3, n (%) Bras C (n=111) Bras E (n=110) Neutropénie 36 (32, 4) 33 (30, 0) Asthénie 16 (14, 4) 17 (15, 5) Leucopénie 14 (12, 6) 8 (7, 3) Anémie 13 (11, 7) 8 (7, 3) Neurotoxicité 13 (11, 7) 20 (18, 2) Thrombocytopénie 8 (7, 2) 12 (10, 9) Augmentation transaminases 7 (6, 3) 5 (4, 5) Neutropénie fébrile 4 (3, 6) Diarrhée 2 (1, 8) 7 (6, 4) Conclusions • Chez ces patients avec cancer du pancréas avancé recevant nab-paclitaxel + gemcitabine, la SG, la SSP et les taux de réponse étaient acceptables • Les 2 doses de nab-paclitaxel ont été bien tolérées Hidalgo M, et al. Ann Oncol 2017; 28(Suppl 5): Abstr 623 PD

1733 PD: Nouvelle association prometteuse d’un inhibiteur du métabolisme mitochondrial et de m. FOLFIRINOX dans le cancer du pancréas – Alistar AT, et al Objectif • Déterminer l’efficacité, la tolérance et la dose maximale tolérée de CPI-613* utilisé en association avec m. FOLFIRINOX chez des patients avec cancer du pancréas Critères d'inclusion • Cancer du pancréas • Stade IV *dérivé lipoate actif non redox 1 e de sa classe CPI-613 500 mg/m 2 ou 1000 mg/m 2 J 1, 3 /2 S + m. FOLFIRINOX J 1, 2, 3 /2 S Prog Alistar AT, et al. Ann Oncol 2017; 28(Suppl 5): Abstr 1733 PD

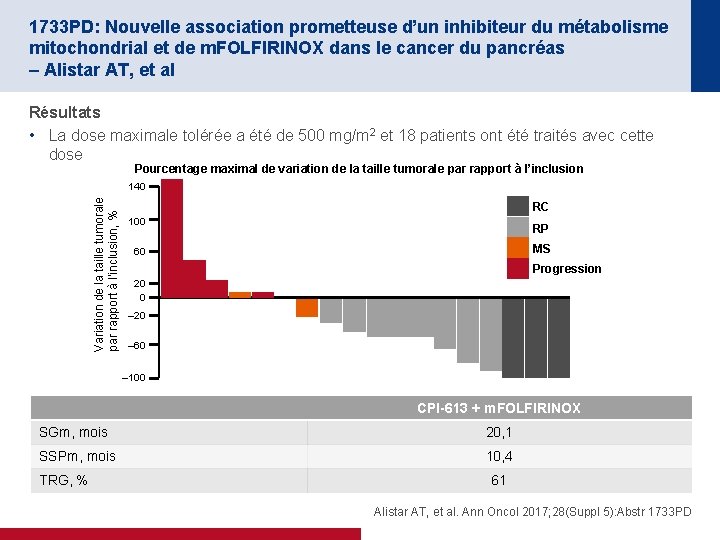
1733 PD: Nouvelle association prometteuse d’un inhibiteur du métabolisme mitochondrial et de m. FOLFIRINOX dans le cancer du pancréas – Alistar AT, et al Résultats • La dose maximale tolérée a été de 500 mg/m 2 et 18 patients ont été traités avec cette dose Pourcentage maximal de variation de la taille tumorale par rapport à l’inclusion Variation de la taille tumorale par rapport à l’inclusion, % 140 RC 100 RP MS 60 Progression 20 0 – 20 – 60 – 100 CPI-613 + m. FOLFIRINOX SGm, mois 20, 1 SSPm, mois 10, 4 TRG, % 61 Alistar AT, et al. Ann Oncol 2017; 28(Suppl 5): Abstr 1733 PD

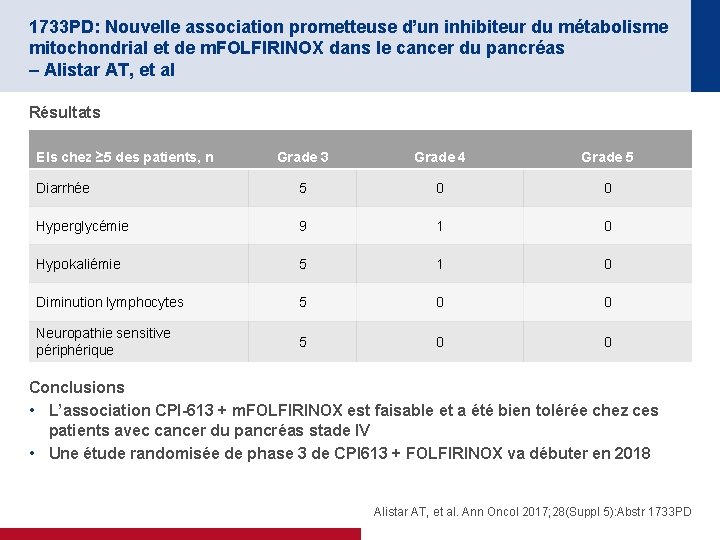
1733 PD: Nouvelle association prometteuse d’un inhibiteur du métabolisme mitochondrial et de m. FOLFIRINOX dans le cancer du pancréas – Alistar AT, et al Résultats EIs chez ≥ 5 des patients, n Grade 3 Grade 4 Grade 5 Diarrhée 5 0 0 Hyperglycémie 9 1 0 Hypokaliémie 5 1 0 Diminution lymphocytes 5 0 0 Neuropathie sensitive périphérique 5 0 0 Conclusions • L’association CPI-613 + m. FOLFIRINOX est faisable et a été bien tolérée chez ces patients avec cancer du pancréas stade IV • Une étude randomisée de phase 3 de CPI 613 + FOLFIRINOX va débuter en 2018 Alistar AT, et al. Ann Oncol 2017; 28(Suppl 5): Abstr 1733 PD

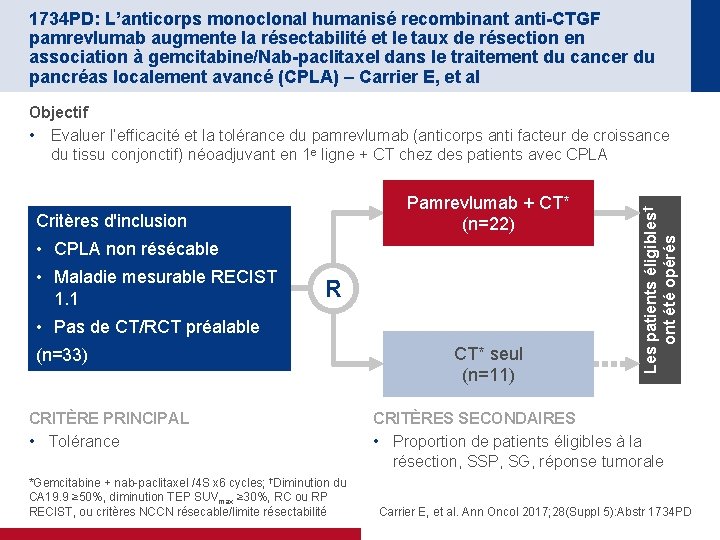
1734 PD: L’anticorps monoclonal humanisé recombinant anti-CTGF pamrevlumab augmente la résectabilité et le taux de résection en association à gemcitabine/Nab-paclitaxel dans le traitement du cancer du pancréas localement avancé (CPLA) – Carrier E, et al Pamrevlumab + CT* (n=22) Critères d'inclusion • CPLA non résécable • Maladie mesurable RECIST 1. 1 R • Pas de CT/RCT préalable (n=33) CRITÈRE PRINCIPAL • Tolérance *Gemcitabine + nab-paclitaxel /4 S x 6 cycles; †Diminution du CA 19. 9 ≥ 50%, diminution TEP SUVmax ≥ 30%, RC ou RP RECIST, ou critères NCCN résecable/limite résectabilité CT* seul (n=11) Les patients éligibles† ont été opérés Objectif • Evaluer l’efficacité et la tolérance du pamrevlumab (anticorps anti facteur de croissance du tissu conjonctif) néoadjuvant en 1 e ligne + CT chez des patients avec CPLA CRITÈRES SECONDAIRES • Proportion de patients éligibles à la résection, SSP, SG, réponse tumorale Carrier E, et al. Ann Oncol 2017; 28(Suppl 5): Abstr 1734 PD

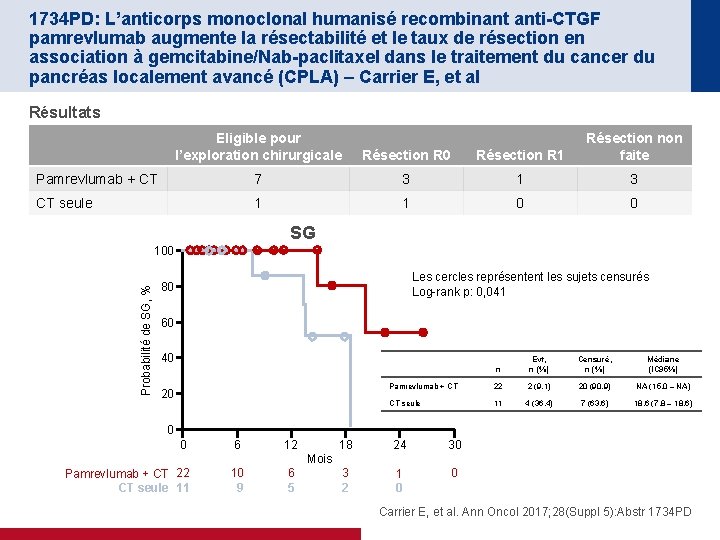
1734 PD: L’anticorps monoclonal humanisé recombinant anti-CTGF pamrevlumab augmente la résectabilité et le taux de résection en association à gemcitabine/Nab-paclitaxel dans le traitement du cancer du pancréas localement avancé (CPLA) – Carrier E, et al Résultats Eligible pour l’exploration chirurgicale Résection R 0 Résection R 1 Résection non faite Pamrevlumab + CT 7 3 1 3 CT seule 1 1 0 0 SG Probabilité de SG, % 100 Les cercles représentent les sujets censurés Log-rank p: 0, 041 80 60 40 20 n Evt, n (%) Censuré, n (%) Médiane (IC 95%) Pamrevlumab + CT 22 2 (9, 1) 20 (90, 9) NA (15, 0 – NA) CT seule 11 4 (36, 4) 7 (63, 6) 18, 6 (7, 8 – 18, 6) 0 0 6 12 18 24 30 3 2 1 0 0 Mois Pamrevlumab + CT 22 CT seule 11 10 9 6 5 Carrier E, et al. Ann Oncol 2017; 28(Suppl 5): Abstr 1734 PD

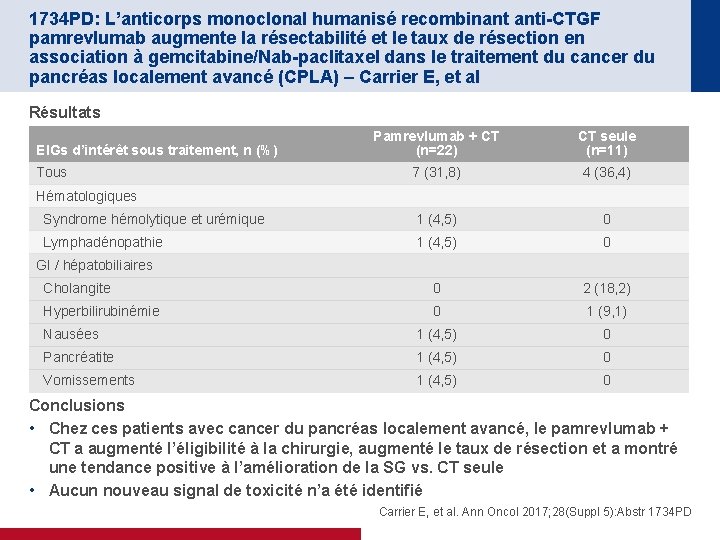
1734 PD: L’anticorps monoclonal humanisé recombinant anti-CTGF pamrevlumab augmente la résectabilité et le taux de résection en association à gemcitabine/Nab-paclitaxel dans le traitement du cancer du pancréas localement avancé (CPLA) – Carrier E, et al Résultats Pamrevlumab + CT (n=22) CT seule (n=11) 7 (31, 8) 4 (36, 4) Syndrome hémolytique et urémique 1 (4, 5) 0 Lymphadénopathie 1 (4, 5) 0 Cholangite 0 2 (18, 2) Hyperbilirubinémie 0 1 (9, 1) Nausées 1 (4, 5) 0 Pancréatite 1 (4, 5) 0 Vomissements 1 (4, 5) 0 EIGs d’intérêt sous traitement, n (%) Tous Hématologiques GI / hépatobiliaires Conclusions • Chez ces patients avec cancer du pancréas localement avancé, le pamrevlumab + CT a augmenté l’éligibilité à la chirurgie, augmenté le taux de résection et a montré une tendance positive à l’amélioration de la SG vs. CT seule • Aucun nouveau signal de toxicité n’a été identifié Carrier E, et al. Ann Oncol 2017; 28(Suppl 5): Abstr 1734 PD

Cancers du pancréas, de l’intestin grêle et des voies biliaires CARCINOME HEPATOCELLULAIRE

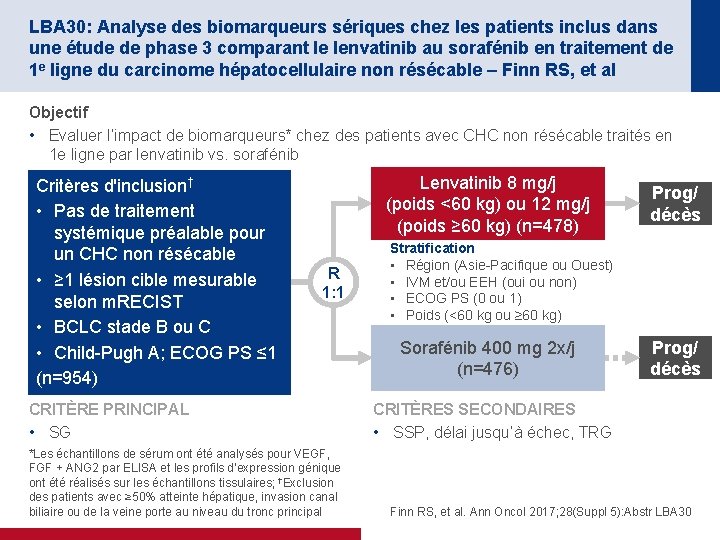
LBA 30: Analyse des biomarqueurs sériques chez les patients inclus dans une étude de phase 3 comparant le lenvatinib au sorafénib en traitement de 1 e ligne du carcinome hépatocellulaire non résécable – Finn RS, et al Objectif • Evaluer l’impact de biomarqueurs* chez des patients avec CHC non résécable traités en 1 e ligne par lenvatinib vs. sorafénib Critères d'inclusion† • Pas de traitement systémique préalable pour un CHC non résécable • ≥ 1 lésion cible mesurable selon m. RECIST • BCLC stade B ou C • Child-Pugh A; ECOG PS ≤ 1 (n=954) Lenvatinib 8 mg/j (poids <60 kg) ou 12 mg/j (poids ≥ 60 kg) (n=478) R 1: 1 CRITÈRE PRINCIPAL • SG *Les échantillons de sérum ont été analysés pour VEGF, FGF + ANG 2 par ELISA et les profils d’expression génique ont été réalisés sur les échantillons tissulaires; †Exclusion des patients avec ≥ 50% atteinte hépatique, invasion canal biliaire ou de la veine porte au niveau du tronc principal Prog/ décès Stratification • Région (Asie-Pacifique ou Ouest) • IVM et/ou EEH (oui ou non) • ECOG PS (0 ou 1) • Poids (<60 kg ou ≥ 60 kg) Sorafénib 400 mg 2 x/j (n=476) Prog/ décès CRITÈRES SECONDAIRES • SSP, délai jusqu’à échec, TRG Finn RS, et al. Ann Oncol 2017; 28(Suppl 5): Abstr LBA 30

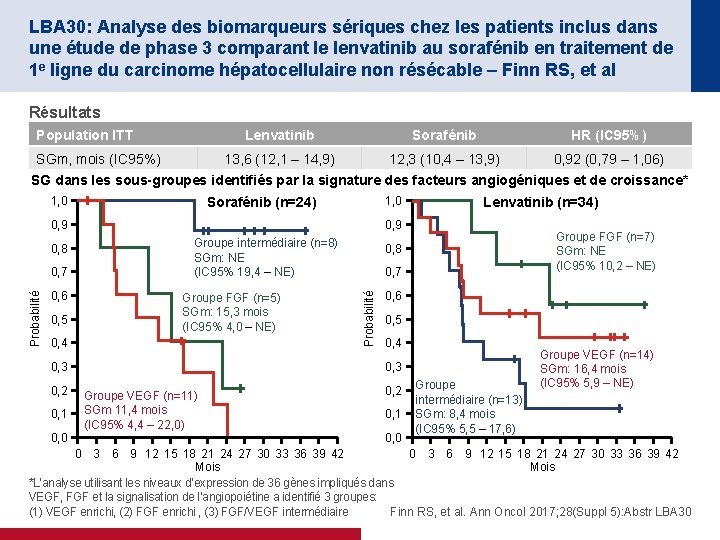
LBA 30: Analyse des biomarqueurs sériques chez les patients inclus dans une étude de phase 3 comparant le lenvatinib au sorafénib en traitement de 1 e ligne du carcinome hépatocellulaire non résécable – Finn RS, et al Résultats Population ITT SGm, mois (IC 95%) Lenvatinib Sorafénib HR (IC 95%) 13, 6 (12, 1 – 14, 9) 12, 3 (10, 4 – 13, 9) 0, 92 (0, 79 – 1, 06) SG dans les sous-groupes identifiés par la signature des facteurs angiogéniques et de croissance* 1, 0 Sorafénib (n=24) 0, 9 Probabilité 0, 7 0, 6 0, 5 0, 9 Groupe intermédiaire (n=8) SGm: NE (IC 95% 19, 4 – NE) Groupe FGF (n=5) SGm: 15, 3 mois (IC 95% 4, 0 – NE) 0, 4 0, 3 0, 2 0, 1 0, 0 Groupe FGF (n=7) SGm: NE (IC 95% 10, 2 – NE) 0, 8 0, 7 Probabilité 0, 8 Lenvatinib (n=34) 0, 6 0, 5 0, 4 0, 3 Groupe VEGF (n=11) SGm 11, 4 mois (IC 95% 4, 4 – 22, 0) 0, 2 0, 1 0, 0 Groupe intermédiaire (n=13) SGm: 8, 4 mois (IC 95% 5, 5 – 17, 6) Groupe VEGF (n=14) SGm: 16, 4 mois (IC 95% 5, 9 – NE) 0 3 6 9 12 15 18 21 24 27 30 33 36 39 42 Mois *L’analyse utilisant les niveaux d’expression de 36 gènes impliqués dans VEGF, FGF et la signalisation de l’angiopoiétine a identifié 3 groupes: (1) VEGF enrichi, (2) FGF enrichi , (3) FGF/VEGF intermédiaire Finn RS, et al. Ann Oncol 2017; 28(Suppl 5): Abstr LBA 30

LBA 30: Analyse des biomarqueurs sériques chez les patients inclus dans une étude de phase 3 comparant le lenvatinib au sorafénib en traitement de 1 e ligne du carcinome hépatocellulaire non résécable – Finn RS, et al Conclusions • Il s’agit de la première étude de phase 3 qui a été positive pour son critère principal en traitement de 1 e ligne du CHC non résécable au cours des 10 dernières années • Il y avait des différences entre lenvatinib et sorafénib pour les analyses de biomarqueurs sériques • Pour le sorafénib et le lenvatinib, VEGF, ANG 2* et FGF 21 pourraient être des facteurs pronostiques potentiels • Dans le bras lenvatinib, l’amélioration de la SG a été observée dans le groupe avec expression élevée des gènes VEGF et FGF • La comparaison entre les groupes lenvatinib et sorafénib n’est pas possible en raison du faible nombre de patients qui ont fourni des échantillons pour les analyses et les résultats doivent seulement être considérés comme permettant de générer des hypothèses *Données non présentées Finn RS, et al. Ann Oncol 2017; 28(Suppl 5): Abstr LBA 30

618 O: Qualité de vie (HRQOL) et symptômes de la maladie chez les patients avec carcinome hépatocellulaire (CHC) non résécable traités par lenvatinib ou sorafénib – Vogel A, et al Objectif • Comparer la HRQo. L avec lenvatinib vs. sorafénib chez les patients avec CHC non résécable Critères d'inclusion Lenvatinib* (n=478) • CHC non résécable • Pas de traitement systémique • ≥ 1 lésion cible mesurable • Stade BCLC B ou C R • Child-Pugh classe A • ECOG PS≤ 1 (n=954) CRITÈRE PRINCIPAL • SG *8 mg/j (poids <60 kg) ou 12 mg/j (poids ≥ 60 kg); † 400 mg 2 x/j Prog/ décès Stratification • Région (Asie-Pacifique ou Ouest) • IVM et/ou EEH (oui ou non) • ECOG PS (0 ou 1) • Poids (<60 kg ou ≥ 60 kg) sorafénib† (n=476) Prog/ décès CRITÈRES SECONDAIRES • SSP, délai jusqu’à progression, TRG, HRQo. L, PK Vogel A, et al. Ann Oncol 2017; 28(Suppl 5): Abstr 6180

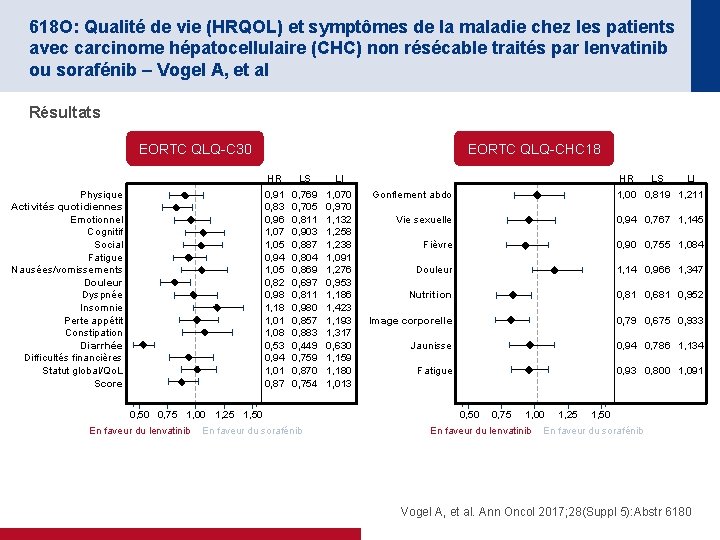
618 O: Qualité de vie (HRQOL) et symptômes de la maladie chez les patients avec carcinome hépatocellulaire (CHC) non résécable traités par lenvatinib ou sorafénib – Vogel A, et al Résultats EORTC QLQ-C 30 Physique Activités quotidiennes Emotionnel Cognitif Social Fatigue Nausées/vomissements Douleur Dyspnée Insomnie Perte appétit Constipation Diarrhée Difficultés financières Statut global/Qo. L Score EORTC QLQ-CHC 18 HR LS LI 0, 91 0, 83 0, 96 1, 07 1, 05 0, 94 1, 05 0, 82 0, 98 1, 18 1, 01 1, 08 0, 53 0, 94 1, 01 0, 87 0, 769 0, 705 0, 811 0, 903 0, 887 0, 804 0, 869 0, 697 0, 811 0, 980 0, 857 0, 883 0, 449 0, 759 0, 870 0, 754 1, 070 0, 970 1, 132 1, 258 1, 238 1, 091 1, 276 0, 953 1, 186 1, 423 1, 193 1, 317 0, 630 1, 159 1, 180 1, 013 0, 50 0, 75 1, 00 1, 25 1, 50 En faveur du lenvatinib En faveur du sorafénib HR LS LI Gonflement abdo 1, 00 0, 819 1, 211 Vie sexuelle 0, 94 0, 767 1, 145 Fièvre 0, 90 0, 755 1, 084 Douleur 1, 14 0, 966 1, 347 Nutrition 0, 81 0, 681 0, 952 Image corporelle 0, 79 0, 675 0, 933 Jaunisse 0, 94 0, 786 1, 134 Fatigue 0, 93 0, 800 1, 091 0, 50 0, 75 1, 00 En faveur du lenvatinib 1, 25 1, 50 En faveur du sorafénib Vogel A, et al. Ann Oncol 2017; 28(Suppl 5): Abstr 6180

618 O: Qualité de vie (HRQOL) et symptômes de la maladie chez les patients avec carcinome hépatocellulaire (CHC) non résécable traités par lenvatinib ou sorafénib – Vogel A, et al Conclusions • Chez ces patients avec CHC non résécable, la HRQo. L a été altérée pendant le traitement aussi bien sous lenvatinib ou sorafénib et a été généralement similaire dans les 2 groupes • Un retard cliniquement significatif de l’altération des activités quotidiennes, de la douleur cancéreuse, de la diarrhée, de la nutrition et de l’image corporelle a été observé chez les patients recevant le lenvatinib comparativement au sorafénib – Il n’y a pas eu d’améliorations significative de HRQo. L avec sorafénib vs. lenvatinib • Les bénéfices d’efficacité du lenvatinib comparativement au sorafénib, n’ont pas été obtenus au prix d’une dégradation plus marquée de la Qo. L Vogel A, et al. Ann Oncol 2017; 28(Suppl 5): Abstr 6180

619 O: JET-CHC: une étude randomisée de phase 3 en double aveugle contrôlée par placebo évaluant le tivantinib en traitement de 2 e ligne des patients avec carcinome hépatocellulaire et expression élevée de c-Met – Kobayashi I, et al Objectif • Evaluer l’efficacité et la tolérance du tivantinib* vs. placebo en traitement de 2 e ligne de patients japonais avec carcinome hépatocellulaire et expression élevée de c-Met Critères d'inclusion Tivantinib 120 mg 2 x/j (n=134) • CHC avec c-Met élevé† • Résistant/intolérant à un traitement systémique, y compris sorafénib • Child Pugh A R 2: 1 • ≥ 1 lésion mesurable • ECOG PS ≤ 1 (n=195) CRITÈRE PRINCIPAL • SSP *Petite molécule inhibant c-Met; †Défini par ≥ 2+ dans ≥ 50% des cellules tumorales en IHC Prog Stratification • Invasion vasculaire (oui/non) • ECOG PS (0/1) Placebo (n=61) Prog CRITÈRES SECONDAIRES • SG, TRG, TCM, tolérance Kobayashi I, et al. Ann Oncol 2017; 28(Suppl 5): Abstr 619 O

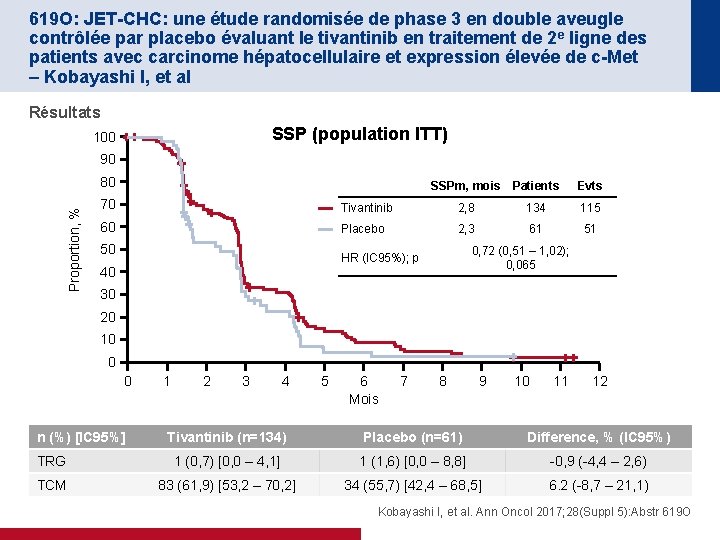
619 O: JET-CHC: une étude randomisée de phase 3 en double aveugle contrôlée par placebo évaluant le tivantinib en traitement de 2 e ligne des patients avec carcinome hépatocellulaire et expression élevée de c-Met – Kobayashi I, et al Résultats SSP (population ITT) 100 90 Proportion, % 80 SSPm, mois Patients Evts 70 Tivantinib 2, 8 134 115 60 Placebo 2, 3 61 51 50 0, 72 (0, 51 – 1, 02); 0, 065 HR (IC 95%); p 40 30 20 10 0 0 n (%) [IC 95%] 1 2 3 4 5 6 Mois 7 8 9 10 11 12 Tivantinib (n=134) Placebo (n=61) Difference, % (IC 95%) TRG 1 (0, 7) [0, 0 – 4, 1] 1 (1, 6) [0, 0 – 8, 8] -0, 9 (-4, 4 – 2, 6) TCM 83 (61, 9) [53, 2 – 70, 2] 34 (55, 7) [42, 4 – 68, 5] 6. 2 (-8, 7 – 21, 1) Kobayashi I, et al. Ann Oncol 2017; 28(Suppl 5): Abstr 619 O

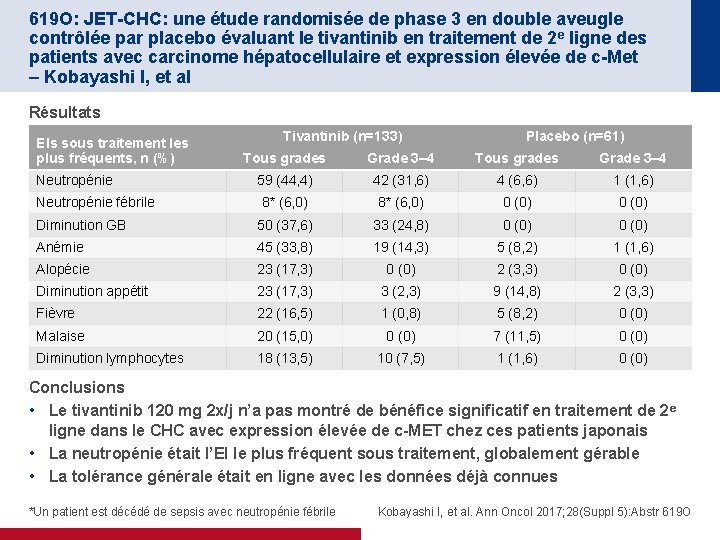
619 O: JET-CHC: une étude randomisée de phase 3 en double aveugle contrôlée par placebo évaluant le tivantinib en traitement de 2 e ligne des patients avec carcinome hépatocellulaire et expression élevée de c-Met – Kobayashi I, et al Résultats EIs sous traitement les plus fréquents, n (%) Tivantinib (n=133) Placebo (n=61) Tous grades Grade 3– 4 59 (44, 4) 42 (31, 6) 4 (6, 6) 1 (1, 6) 8* (6, 0) 0 (0) Diminution GB 50 (37, 6) 33 (24, 8) 0 (0) Anémie 45 (33, 8) 19 (14, 3) 5 (8, 2) 1 (1, 6) Alopécie 23 (17, 3) 0 (0) 2 (3, 3) 0 (0) Diminution appétit 23 (17, 3) 3 (2, 3) 9 (14, 8) 2 (3, 3) Fièvre 22 (16, 5) 1 (0, 8) 5 (8, 2) 0 (0) Malaise 20 (15, 0) 0 (0) 7 (11, 5) 0 (0) Diminution lymphocytes 18 (13, 5) 10 (7, 5) 1 (1, 6) 0 (0) Neutropénie fébrile Conclusions • Le tivantinib 120 mg 2 x/j n’a pas montré de bénéfice significatif en traitement de 2 e ligne dans le CHC avec expression élevée de c-MET chez ces patients japonais • La neutropénie était l’EI le plus fréquent sous traitement, globalement gérable • La tolérance générale était en ligne avec les données déjà connues *Un patient est décédé de sepsis avec neutropénie fébrile Kobayashi I, et al. Ann Oncol 2017; 28(Suppl 5): Abstr 619 O

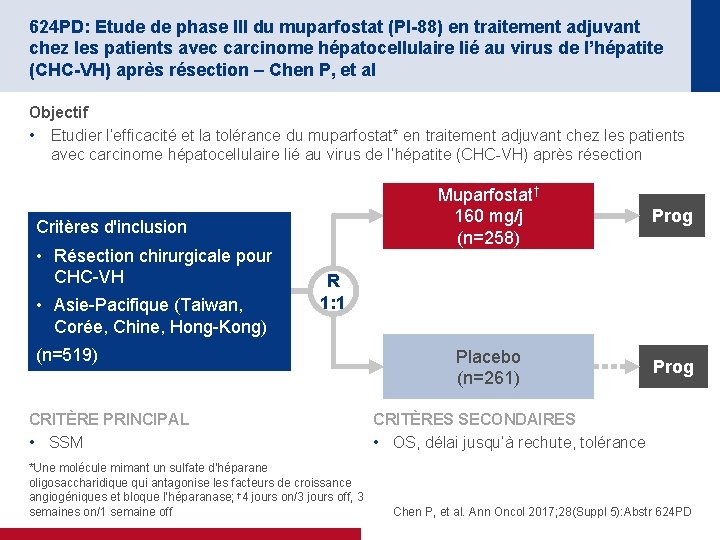
624 PD: Etude de phase III du muparfostat (PI-88) en traitement adjuvant chez les patients avec carcinome hépatocellulaire lié au virus de l’hépatite (CHC-VH) après résection – Chen P, et al Objectif • Etudier l’efficacité et la tolérance du muparfostat* en traitement adjuvant chez les patients avec carcinome hépatocellulaire lié au virus de l’hépatite (CHC-VH) après résection Critères d'inclusion • Résection chirurgicale pour CHC-VH • Asie-Pacifique (Taiwan, Corée, Chine, Hong-Kong) Muparfostat† 160 mg/j (n=258) Prog Placebo (n=261) Prog R 1: 1 (n=519) CRITÈRE PRINCIPAL • SSM *Une molécule mimant un sulfate d’héparane oligosaccharidique qui antagonise les facteurs de croissance angiogéniques et bloque l’héparanase; † 4 jours on/3 jours off, 3 semaines on/1 semaine off CRITÈRES SECONDAIRES • OS, délai jusqu’à rechute, tolérance Chen P, et al. Ann Oncol 2017; 28(Suppl 5): Abstr 624 PD

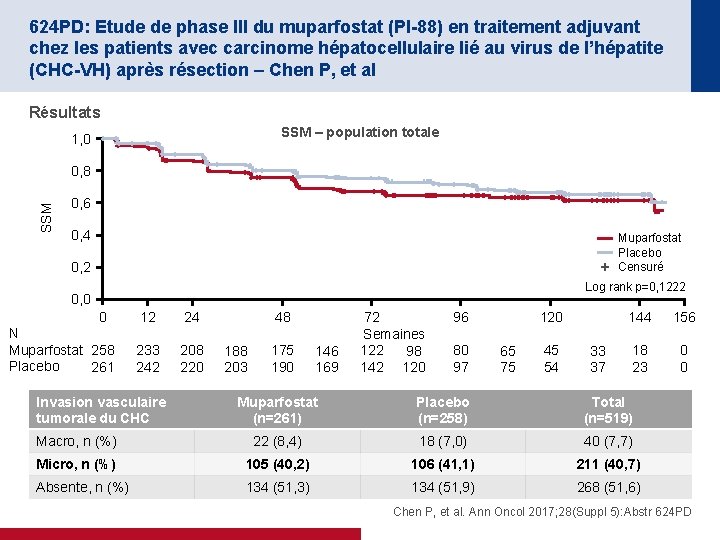
624 PD: Etude de phase III du muparfostat (PI-88) en traitement adjuvant chez les patients avec carcinome hépatocellulaire lié au virus de l’hépatite (CHC-VH) après résection – Chen P, et al Résultats SSM – population totale 1, 0 SSM 0, 8 0, 6 0, 4 Muparfostat Placebo Censuré 0, 2 Log rank p=0, 1222 0, 0 0 N Muparfostat 258 Placebo 261 12 24 233 242 208 220 Invasion vasculaire tumorale du CHC 48 188 203 175 190 146 169 72 Semaines 122 98 142 120 96 80 97 120 65 75 45 54 33 37 144 156 18 23 0 0 Muparfostat (n=261) Placebo (n=258) Total (n=519) Macro, n (%) 22 (8, 4) 18 (7, 0) 40 (7, 7) Micro, n (%) 105 (40, 2) 106 (41, 1) 211 (40, 7) Absente, n (%) 134 (51, 3) 134 (51, 9) 268 (51, 6) Chen P, et al. Ann Oncol 2017; 28(Suppl 5): Abstr 624 PD

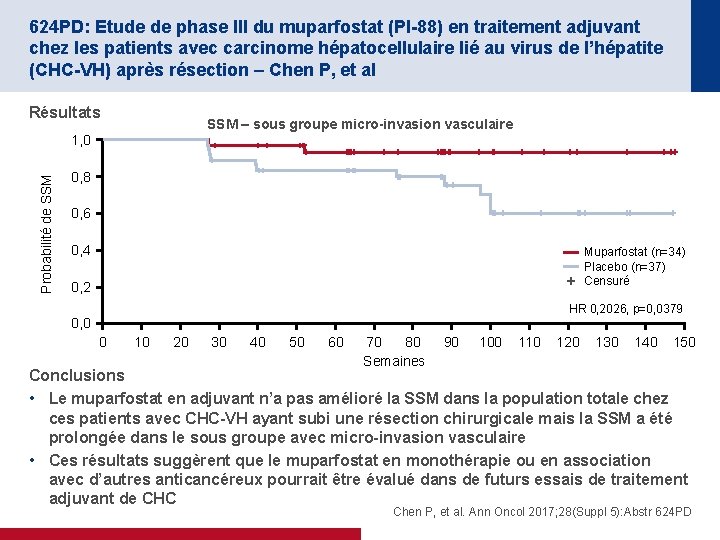
624 PD: Etude de phase III du muparfostat (PI-88) en traitement adjuvant chez les patients avec carcinome hépatocellulaire lié au virus de l’hépatite (CHC-VH) après résection – Chen P, et al Résultats SSM – sous groupe micro-invasion vasculaire Probabilité de SSM 1, 0 0, 8 0, 6 0, 4 Muparfostat (n=34) Placebo (n=37) Censuré 0, 2 HR 0, 2026, p=0, 0379 0, 0 0 10 20 30 40 50 60 70 80 Semaines 90 100 110 120 130 140 150 Conclusions • Le muparfostat en adjuvant n’a pas amélioré la SSM dans la population totale chez ces patients avec CHC-VH ayant subi une résection chirurgicale mais la SSM a été prolongée dans le sous groupe avec micro-invasion vasculaire • Ces résultats suggèrent que le muparfostat en monothérapie ou en association avec d’autres anticancéreux pourrait être évalué dans de futurs essais de traitement adjuvant de CHC Chen P, et al. Ann Oncol 2017; 28(Suppl 5): Abstr 624 PD

Cancers du pancréas, de l’intestin grêle et des voies biliaires CANCER DES VOIES BILIAIRES

LBA 29: GEMOX en adjuvant dans le cancer des voies biliaires: résultats actualisés de survie sans récidive et premiers résultats de survie globale de l’étude randomisée phase III PRODIGE 12 -ACCORD 18 (UNICANCER GI) – Edeline J, et al Objectif • Evaluer l’efficacité et la tolérance de GEMOX en adjuvant chez les patients avec cancer des voies biliaires Critères d'inclusion GEMOX* 85 /2 S 12 cycles (n=95) • Cancer des voies biliaires (ICC/ECC/GBC) • Chirurgie R 0 ou R 1 • ECOG PS 0– 2 • Fonction hépatique adéquate R 1: 1 • Randomisation dans les 3 mois suivant la chirurgie (n=194) CRITÈRE PRINCIPAUX • SSR, Qo. L *Gemcitabine 1000 mg/m 2 J 1; oxaliplatine 85 mg/m 2 J 2; †Tous les 3 mois pendant 2 ans puis tous les 6 mois pendant 3 ans Prog Stratification • Site tumoral • R 0 vs. R 1 • N 0 vs. N+ vs. NX • Centres Surveillance† seule: ACE, CA 19. 9 + scanners (n=99) Prog CRITÈRES SECONDAIRES • SG, SSM, toxicité, recherche translationnelle Edeline J, et al. Ann Oncol 2017; 28(Suppl 5): Abstr LBA 29

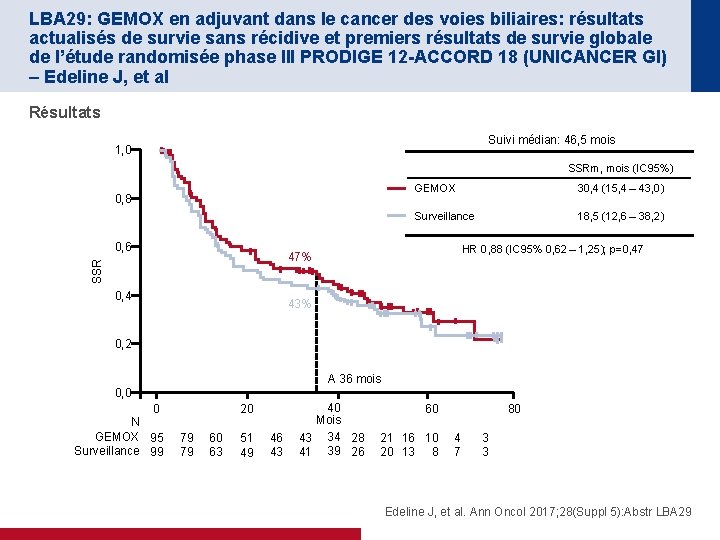
LBA 29: GEMOX en adjuvant dans le cancer des voies biliaires: résultats actualisés de survie sans récidive et premiers résultats de survie globale de l’étude randomisée phase III PRODIGE 12 -ACCORD 18 (UNICANCER GI) – Edeline J, et al Résultats Suivi médian: 46, 5 mois 1, 0 SSRm, mois (IC 95%) 0, 8 0, 6 GEMOX 30, 4 (15, 4 – 43, 0) Surveillance 18, 5 (12, 6 – 38, 2) HR 0, 88 (IC 95% 0, 62 – 1, 25); p=0, 47 SSR 47% 0, 4 43% 0, 2 A 36 mois 0, 0 0 N GEMOX 95 Surveillance 99 20 79 79 60 63 51 49 46 43 40 Mois 43 34 28 41 39 26 60 21 16 10 20 13 8 80 4 7 3 3 Edeline J, et al. Ann Oncol 2017; 28(Suppl 5): Abstr LBA 29

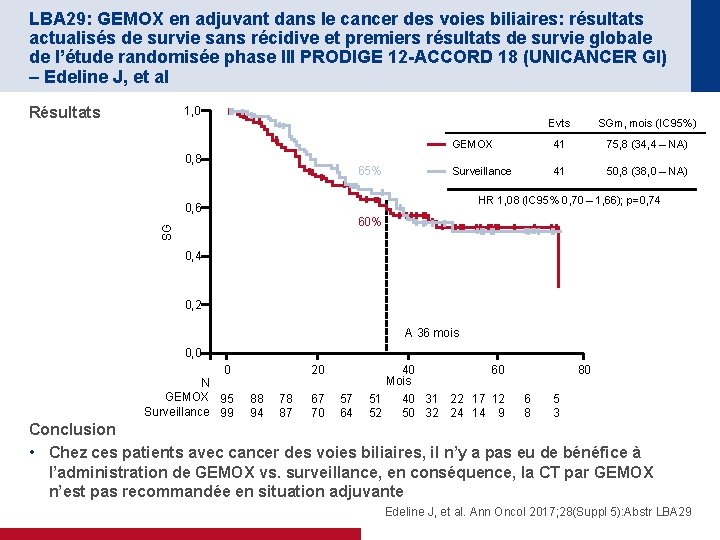
LBA 29: GEMOX en adjuvant dans le cancer des voies biliaires: résultats actualisés de survie sans récidive et premiers résultats de survie globale de l’étude randomisée phase III PRODIGE 12 -ACCORD 18 (UNICANCER GI) – Edeline J, et al Résultats 1, 0 0, 8 65% Evts SGm, mois (IC 95%) GEMOX 41 75, 8 (34, 4 – NA) Surveillance 41 50, 8 (38, 0 – NA) HR 1, 08 (IC 95% 0, 70 – 1, 66); p=0, 74 0, 6 SG 60% 0, 4 0, 2 A 36 mois 0, 0 0 N GEMOX 95 Surveillance 99 20 88 94 78 87 67 70 57 64 40 60 Mois 40 31 22 17 12 51 50 32 24 14 9 52 80 6 8 5 3 Conclusion • Chez ces patients avec cancer des voies biliaires, il n’y a pas eu de bénéfice à l’administration de GEMOX vs. surveillance, en conséquence, la CT par GEMOX n’est pas recommandée en situation adjuvante Edeline J, et al. Ann Oncol 2017; 28(Suppl 5): Abstr LBA 29
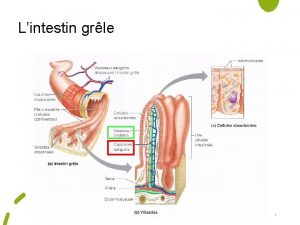
 Le grle
Le grle Consigne londres
Consigne londres A voir a londres
A voir a londres Female reproductive system
Female reproductive system Her2 positive cancers
Her2 positive cancers Des des des
Des des des Diversification des espaces et des acteurs de la production
Diversification des espaces et des acteurs de la production Robin des bois des alpes
Robin des bois des alpes Je t'offrirai des fleurs et des nappes en couleurs
Je t'offrirai des fleurs et des nappes en couleurs Il existe des personnes qui sont des lumières pour tous
Il existe des personnes qui sont des lumières pour tous Mesure de volume des liquides et des corps solides
Mesure de volume des liquides et des corps solides Triple des attack
Triple des attack Valeur des temps verbaux
Valeur des temps verbaux Mesure de niveaux pour liquides et solides
Mesure de niveaux pour liquides et solides Budget des ventes méthode des moindres carrés
Budget des ventes méthode des moindres carrés Affiche de propagande plan marshall
Affiche de propagande plan marshall Cartographie des risques gestion des stocks
Cartographie des risques gestion des stocks La diffusion des idées des lumières
La diffusion des idées des lumières Classiques des sciences sociales
Classiques des sciences sociales Kurzfristig wirkende dopingmittel
Kurzfristig wirkende dopingmittel Grammatische kategorien des verbs
Grammatische kategorien des verbs Ligue lorraine handball
Ligue lorraine handball Die leiden des jungen werther gutenberg
Die leiden des jungen werther gutenberg Aufbau des pilzes
Aufbau des pilzes Algoritmul des
Algoritmul des Gestion des connaissances
Gestion des connaissances Procidence des artères carotides internes
Procidence des artères carotides internes Contraste de quantité couleur
Contraste de quantité couleur Loi de vitesse d'ordre 1
Loi de vitesse d'ordre 1 Pmmp - portail marocain des marches publics
Pmmp - portail marocain des marches publics Loi composition des vitesses
Loi composition des vitesses Registre des déchets excel
Registre des déchets excel Volume maille orthorhombique
Volume maille orthorhombique Salvador dali 1941
Salvador dali 1941 10 stufen des alkoholismus
10 stufen des alkoholismus Cartographie des controverses
Cartographie des controverses Le vin est le lait des vieillards
Le vin est le lait des vieillards Liste des produits soumis au contrôle technique
Liste des produits soumis au contrôle technique