Az tlagos kmiai ill molekvivalens atom ill kplettmegek










- Slides: 11

Az átlagos kémiai (ill. , mol-ekvivalens) atom-, ill. képlettömegek definiciói • Szubmikroszkópos (atomi) szinten: (az átlagos izotóp eloszlást képviselő) Átlagos atomi tömeg (ate): = • (A számértéke a periodusos rendszer táblázatából kiolvasható!) Makroszkópikus (moláris) szinten: NA = 6 • 1023 db (1 molnyi) atom mérhető és tekintendő egységnek, amely a mol definiciója miatt számértékileg az előzővel azonos, de a mértékegysége g/mol: Átlagos moláris atomtömeg (A, g/mol) ---- átlagos atomi tömeg (ate). • Átlagos moláris molekulatömeg (M, g/mol): = vagy Átlagos moláris képlet(formula)egység-tömeg (M, g/mol): = • Általánosítás: Tehát bármely tiszta anyag grammokban kifejezett „moltömege, M” azaz 1 mol-nyi mennyisége ugyanannyi (éppen 6 • 1023 db) egyazon részecskét (atomot, molekulát, képletegységet, gyököt, sít) tartalmaz, mint amennyi szénatomot egy 12 g tömegű csupáncsak 12 C izotópból felépülő szénminta.

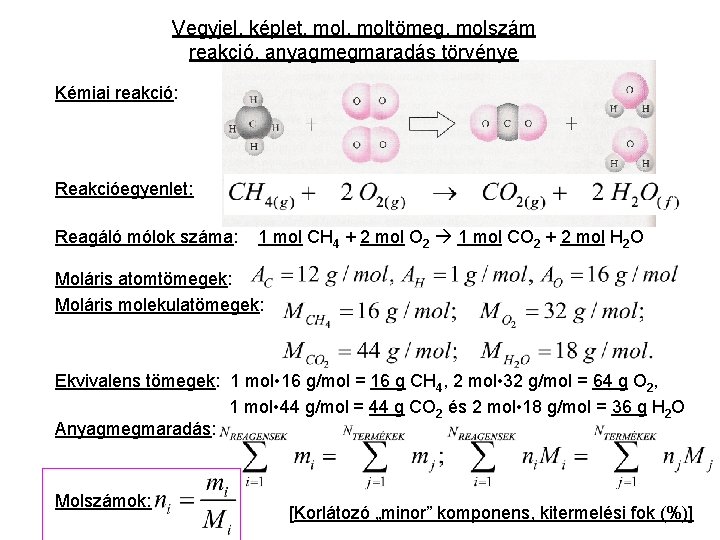
Vegyjel, képlet, moltömeg, molszám reakció, anyagmegmaradás törvénye Kémiai reakció: Reakcióegyenlet: Reagáló mólok száma: 1 mol CH 4 + 2 mol O 2 1 mol CO 2 + 2 mol H 2 O Moláris atomtömegek: Moláris molekulatömegek: Ekvivalens tömegek: 1 mol • 16 g/mol = 16 g CH 4, 2 mol • 32 g/mol = 64 g O 2, 1 mol • 44 g/mol = 44 g CO 2 és 2 mol • 18 g/mol = 36 g H 2 O Anyagmegmaradás: Molszámok: [Korlátozó „minor” komponens, kitermelési fok (%)]

Molfogalom a gázok körében, gáztörvények • A gázhalmazállapotú anyagok jellemzői (SI szerint) – A rendelkezésére álló térfogat: V (m 3, dm 3=l(liter), cm 3), melyet egyenletesen kitölt (pl. léggömb). – Az edényfalára kifejtett nyomása: p (Pa) normál, ill. standard légköri nyomás: 101325 Pa = 101, 325 k. Pa = 1013, 25 h. Pa = 1 atm =1 bar = 760 Hgmm = 760 Torr Túlnyomás (p>1 atm), Vákuum (p<1 atm) – Hőmérséklete (hőmérővel mérve): T (°C, °F) „normál” hőmérséklet T=0°C; „standard” hőmérséklet T=25°C – Anyagmennyisége: n (mol) – [sűrűsége, r (kg/m 3) ]

A kinetikus gázelmélet (fizikai) modelljének alapfeltételezései • A gázrészecskék (atomok vagy molekulák) tömeggel bíró, de pontszerű testeknek tekinthetők, azaz kiterjedésük, részecsketérfogatuk, sőt együttes tényleges térfogatuk az edényük térfogatához képest elhanyagolható. • A gázrészecskék egyenes vonalú egyenletes mozgást végeznek nagy sebességgel. • Köztük vonzó vagy taszító erők nem lépnek fel. • Csupán tökéletesen rugalmas (tehát összes mozgási energiájuk megmaradásával járó) ütközések során lépnek egymással, (ill. az edényfalával) kölcsönhatásba, amikor is impulzusmegmaradás törvénye szerint változik meg a mozgásuk iránya és sebessége, aminek három következménye van: • Észlelhető gáznyomásuk egyenlő az edényfalának ütköző részecskék által időegység alatt átadott impulzus nagyságával. • Sebességük egyenként különböző, de összeségében meghatározott paraméterű Boltzmann-Maxwell-féle változatlan eloszlást mutat. • A részecskék összesített kinetikus, azaz mozgási energiája adott hőmérsékleten állandó értékű, de egyenesen arányos az ún. gázkinetikai, vagy más néven abszolút hőmérséklettel (T, K):

Gáztörvények. --- Avogadro törvénye: • Azonos nyomás és hőmérséklet esetén függetlenül a gázok anyagi (kémiai) minőségétől a gázok térfogata a bennük található gázrészecskék (mol)számával egyenesen arányos: V(p=áll, T=áll) ~ n, az arányossági tényező (moláris térfogat, moltérfogat) a közös nyomás és hőmérséklet függvénye. • Standard körülmények definiciója: – n=1 mol anyag, p=1 atm nyomás, T=25°C hőmérséklet. • Normál körülmények definiciója: – n=1 mol anyag, p=1 atm nyomás, T= 0°C hőmérséklet. • Moláris térfogat (azaz 1 mol tetszőleges gáz térfogata): – Standard körülmények között ( p=1 atm, T=25°C) éppen V°m = 24, 5 dm 3/mol, – Normál körülmények között ( p=1, T=0°C) éppen V’m = 22, 41 dm 3/mol • 1 mol gáz éppen Avogadro számnyi, azaz NA=6 • 1023 db részecskét tartalmaz.

A gázok fizikai törvényei: Gay-Lussac I. törvénye I. ) A gázok térfogati hőtágulása állandó nyomáson (p = áll. ) lineáris függvénye a T(°C) hőmérsékletnek: ahol V, a térfogat az adott T(°C) hőmérsékleten, míg V 0 a T=0°C-on mérhető térfogat, V 0 = V(T=0°C). Extrapolálva T = -273. 15°C-ra V = 0 m 3 adódna, de éppen odahelyezve egy új hőmérsékleti skála [T(K)=273, 15+T(°C)] kezdőpontját az összefüggés egyenes arányosságként írható fel az új ún. abszolút hőmérséklet függvényében, V ~ T(K):

A gázok fizikai törvényei: Gay-Lussac II. törvénye II. ) A gázok nyomásemelkedése állandó térfogaton (V = áll. ) lineáris függvénye a T(°C) hőmérsékletnek: ahol p az adott T(°C) hőmérsékleten, míg p 0 a T=0°C-on mérhető nyomás V 0 = p(T=0°C). Extrapolálva T = -273. 15°C-ra éppen p = 0 Pa adódna, de éppen odahelyezve egy új hőmérsékleti skála [T(K)=273, 15+T(°C)] kezdőpontját az összefüggés egyenes arányosságként írható fel az új ún. abszolút hőmérséklet függvényében, p ~ T(K):

Az abszolút hőmérsékleti skála: kezdőpontja: 0 K = -273, 15°C, és T(K) ≥ 0(!); egysége: 1 K = 1°C, normál hőmérséklet: 0°C = 273, 15 K; standard hőmérséklet: 25°C = 298, 15 K; Boyle-Mariotte törvénye: • Állandó hőmérsékleten (T=áll) a gázok nyomása és térfogata között fordított arányosság áll fenn: p ~ 1/V vagy V ~ 1/p. • Azaz az összetartozó értékpárok szorzata állandó: p 1 V 1 = p 2 V 2 = pi. Vi =áll. • (a p. V szorzat a gázok térfogati munkavégző képessége)

Egyesített (egyetemes) gáztörvény tökéletes (ideális) gázokra (SI) • • p, a gáz nyomása (Pa) V, a gáz térfogata (m 3) n, a gáz anyagmennyisége, molszáma (mol) R = 8, 314 J/K/mol, egyetemes gázállandó, nem függ a gáz anyagi minőségétől • T, abszolút hőmérséklet (K)

Egyesített (egyetemes) gáztörvény tökéletes (ideális) gázokra (SI) • Alkalmas adott mennyiségű (n = m/M = p. V/RT) gáz legkülönbözőbb állapotváltozásáinak számítására: p. V/T = áll. • Gázok keverésével előálló gázelegyekre is igaz: pö Vö = nö R T, ahol pö, ill. Vö a közös nyomást, ill. térfogatot, míg nö az összmolszámot jelenti: • Az egyes gázkomponensek (mol)szám-arányuknak megfelelően járulnak az össznyomáshoz (Vö közös), ill. az össztérfogathoz (pö közös) : • pi , parciális nyomás az a nyomás érték, melyet akkor mérhetnénk, ha az adott gázkomponens a rendelkezésre álló Vö térfogatot egyedül töltené ki: , ill. Vi, parciális térfogat az a térfogat, melyet az adott gázkomponens egyedül elfoglalna a közös pö nyomáson:

Reális gázok: Van der Waals-egyenlet • Tökéletes vagy ideális gázok, ha a kinetikus gázelmélet alapfeltételezései érvényesülnek. • Kivétel: különösen nagy nyomások, ill. igen alacsony hőmérsékletek esetén (közel a cseppfolyósodáshoz): ekkor „reális” gázok: – A gázrészecskék valódi össztérfogata nem elhanyagolható, hanem összemérhető az edény térfogatával csökken a tényleges szabad térfogat – Vonzó kölcsönhatások lépnek fel az egymáshoz közel kerülő gázrészecskék között kisebb a mérhető nyomásuk • Ilyenkor a tökéletes vagy ideális gázokhoz képest (nyomás és térfogat) korrekciót kíván az egyetemes gázegyenlet (a és b gázfüggő korrekciós paraméterek):