Atomi felleti adalkols technolgija s kmiai hatsainak tanulmnyozsa























- Slides: 28

Atomi felületi adalékolás technológiája és kémiai hatásainak tanulmányozása HREELS, AES és TDS módszerekkel Farkas Arnold Péter*, Solymosi Frigyes Reaction Kinetics Research Laboratory at the University of Szeged Chemical Research Center of the Hungarian Academy of Sciences Szeged, Hungary

Az előadás felépítése • A kísérleteknél használt berendezés bemutatása • Alkáli párologtatás technikája, az adatom felületi viselkedésének irodalma • Kálium kötéserőssége és hatása a felületi struktúrára Mo 2 C/Mo(100) és Au(111) egykristály felületeken • Alkáli fém adalékolás (K) hatásának bemutatása különböző felületeken és módszerekkel: 1. CO 2+K/Au(111) rendszer 2. Alkoholok (etanol) adszorpciója és reakciói K/Mo 2 C/Mo(100) felületen 3. Szénhidrogén fragmentek reakcióútjainak bemutatása (C 3 H 7 I adszorpció példáján) K/Mo 2 C/Mo(100) felületen, K-I felületi forma kialakulása • Összegzés

Kísérleti berendezés Uralkodó nyomástartomány: ~1, 0*10 -9 Torr § Mérési lehetőség 100 K - 1200 K hőmérséklet tartományban § HREELS - FWHM 2. 5 -5 me. V és 104 -105 cps § STAIB DESA 100 – CMA és elekton ágyú § X-ray forrás az ATOMKI-tól (Tóth József) A minta kezelése Au(111) minta (polírozott –cég: Ma. Teck) - 1000 K felfűtés - többszöri Ar bombázás + felfűtési ciklus (~850 K). - Oxigénes vagy NO 2 kezelés (szén tartalom) - Minden sorozat előtt: ~850 K felfűtés és Ar bombázás ciklusok (~1 óra ~1 μA 2 ke. V Ar+ + felfűtés)

A kálium felvitele a mintára Minta előkezelés (Mo 2 C/Mo(100)): 1265 K-es felfűtés és Ar+ bombázás (2 k. V, 1 -2 óra, kb. 1 μA mintaáram) SAES getter forrás: Általában valamilyen alkálifém-kromátot (Me 2 Cr. O 4) és egy redukáló ágenst tartalmaznak a források, melyek a ráadott fűtőáram hatására fém K-ot (esetünkben) párologtatnak. Az idő növelésével egyenes arányban növelhető a párologtatott fém mennyisége.

Elektropozitív donor hatás • Ipari alkalmazás (Haber-Bosch (ammónia) és Fischer-Tropsch (szénhidrogén), alkohol, víz-gáz reakció stb. ) • Kölcsönhatás jellege: „hosszú távú” kölcsönhatás v. közvetlenül az adszorbeált molekulákkal létrejött kölcsönhatás • Alkáli fémek erősen elektropozitív elemek alacsony ionizációs potenciállal (Na 5. 14, K 4. 34 e. V) • Kis K borítottságnál taszító dipól-dipól jellemző a K adatomok közt, ez a lehető legnagyobb távolságra történő elhelyezkedéshez vezet. Ezek jellemzően a nagy koordináltságú helyek (111 -threefold sites, 100 four fold sites) K/Pt(111) 0. 33 borítottság monorétegnél és (√ 3 x√ 3)R 30° struktúrával. • 100 K-en is elegendően nagy mobilitás, hogy a rendezett struktúrák létrejötte ne legyen kinetikailag gátolt. • A borítottság és a kristálytani orientációs egyezések ellenére a különböző szubsztrátokon különböző diffúziós koefficiens és struktúra figyelhető meg. (pl. : Li on Mo(110) és W(110))

• Befolyásoló tényezők az adszorpciós hőmérséklet, aktuális alkáli borítottság és a felület geometriai és elektronikus szerkezete • Nagy K borítottságoknál a dipól-dipól taszítás csökken a depolarizációs hatás következtében. • A legrövidebb távolság adatom-adatom közt sok esetben kisebb mint a tömbi alkáliban, a direkt alkáli- alkáli kölcsönhatás jelentős. • Alkáli multirétegek tiszta alkáli fémekként viselkednek. • Alkáli indukált felületi rekonstrukció [pl. : (110) felület Ag, Pd, Cu, Ni esetében; (1 x 1) -> (1 x 2)] • Kilépési munka csökkenés………. . M. P. Kiskinova: Poisoning and promotion in catalysis based on surface science concepts and experiments (Studies in Surface Science and Catalysis 1992 Elsevier)

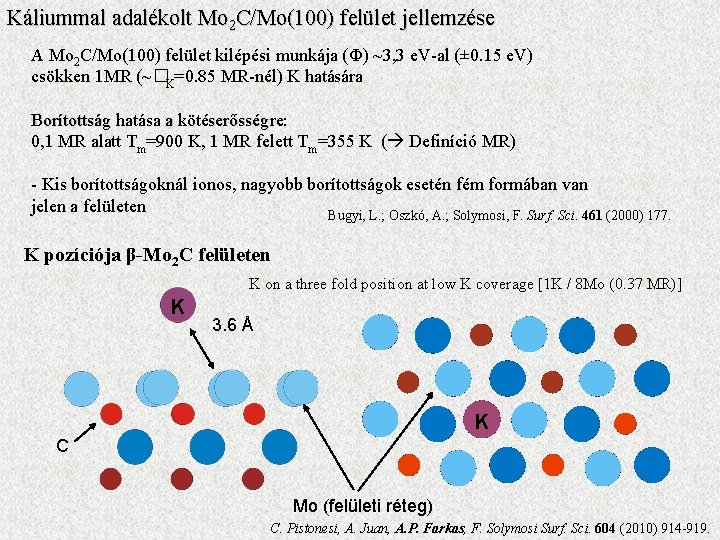
Káliummal adalékolt Mo 2 C/Mo(100) felület jellemzése A Mo 2 C/Mo(100) felület kilépési munkája (Ф) ~3, 3 e. V-al (± 0. 15 e. V) csökken 1 MR (~�K=0. 85 MR-nél) K hatására Borítottság hatása a kötéserősségre: re 0, 1 MR alatt Tm=900 K, 1 MR felett Tm=355 K ( Definíció MR) - Kis borítottságoknál ionos, nagyobb borítottságok esetén fém formában van jelen a felületen Bugyi, L. ; Oszkó, A. ; Solymosi, F. Surf. Sci. 461 (2000) 177. K pozíciója β-Mo 2 C felületen K on a three fold position at low K coverage [1 K / 8 Mo (0. 37 MR)] K 3. 6 Å K C Mo (felületi réteg) C. Pistonesi, A. Juan, A. P. Farkas, F. Solymosi Surf. Sci. 604 (2010) 914 -919.

Káliummal adalékolt Au(111) felület jellemzése K-al adalékolt Au(111) felület 1. Kálium borítottsággal a struktúra periodicitása csökken: -0. 33 MLK borítottságnál ( √ 3* √ 3)R 30◦ - Magasabb borítottságnál K indukált rek. szigetek; ~0. 5 ML K (2*2) LEED pöttyök 2. Au step atom mobilitás nő (gyengült kötés a második réteg felé) 3. K-Au ötvözeti rétegek jöhetnek létre (300 K-en 0. 33 ML-nél nagyobb K borítottságoknál) G. Ertl – Surf. Sci. 348 (1996) 280 -286 8

Káliummal adalékolt Au(111) felület jellemzése Kilépési munka változása egykristály felületeken DF Maximum ΔΦ decrease at ΘK values (e. V) ΔΦ increase at higher ΘK (e. V) Refs. Metals Work function (e. V) Pt(111) 5. 70 -4. 5; ΘK = 0. 15 0. 30 [1]* Rh(111) 5. 30 -3. 6; ΘK = 0. 20 0. 45 [2] Pd(100) 5. 55 -4. 2; ΘK ~ 0. 25 0. 90 [3] Cu(110)* 4. 48 -3. 1; ΘK = 0. 50 0. 70 [4] Ag(111) 4. 74 -2. 7; ΘK = 0. 2 ? [5] Au(111) 5. 31 -3. 1; ΘK = 0. 7 0. 20 [jelen munka] * Irodalomjegyzék felsorolása az előadás végén. - töltés transzfer a káliumból a felületre - A kálium ad-réteg ionos jelleget mutat kis (≤ 0. 3) és fémes jelleget nagyobb borítottságoknál. Kálium deszorpciója tiszta Au(111) felületről - 0, 1 MR alatt Tp>600 K, felette 1 MR-nél Tp=370 K ( a MR definiálása)

Az előadás felépítése • A kísérleteknél használt berendezés bemutatása • Alkáli párologtatás technikája, az adatom felületi viselkedésének irodalma • Kálium kötéserőssége és hatása a felületi struktúrára Mo 2 C/Mo(100) és Au(111) egykristály felületeken • Alkáli fém adalékolás (K) hatásának bemutatása különböző felületeken és módszerekkel: 1. CO 2+K/Au(111) rendszer 2. Alkoholok (etanol) adszorpciója és reakciói K/Mo 2 C/Mo(100) felületen 3. Szén-hidrogén fragmentek reakcióútjainak bemutatása (C 3 H 7 I adszorpció példáján) K/Mo 2 C/Mo(100) felületen, K-I felületi forma kialakulása • Összegzés

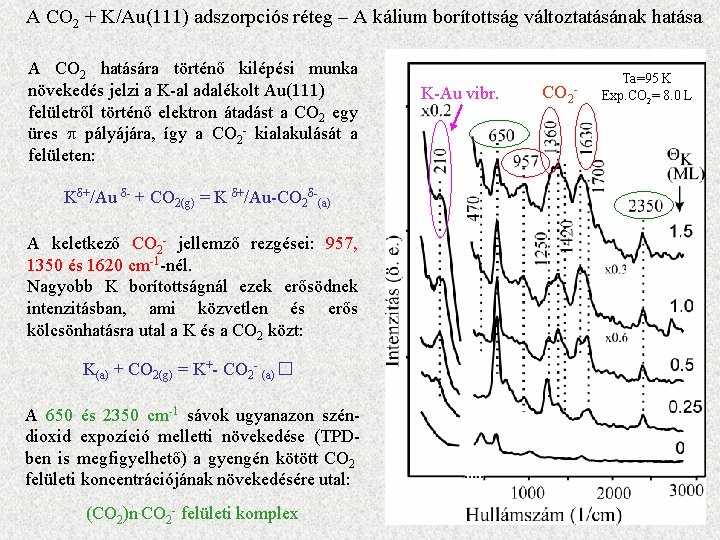
A CO 2 + K/Au(111) adszorpciós réteg Exp. = 8 L o Au(111) kilépési munka csökkenés K hatására ~3. 2 e. V o K + CO 2 hatására kisebb mértékben o A K(252)/Au(69) lépcsőzetes növekedése o lineáris kilépési munka növekedés felfűtés hatására 800 K-ig o A ko-adszorbeált rétegben a kezdeti kis csökkenés után csak 600 K felett történik növekedés o A K(252)/Au(69) AES csökkenése csak 400 K felett arány Exp. = 8 L Q K= 1. 2 ML AES arány

A CO 2 + K/Au(111) adszorpciós réteg – A kálium borítottság változtatásának hatása A CO 2 hatására történő kilépési munka növekedés jelzi a K-al adalékolt Au(111) felületről történő elektron átadást a CO 2 egy üres p pályájára, így a CO 2 - kialakulását a felületen: Kδ+/Au δ- + CO 2(g) = K δ+/Au-CO 2δ-(a) A keletkező CO 2 - jellemző rezgései: 957, 1350 és 1620 cm-1 -nél. Nagyobb K borítottságnál ezek erősödnek intenzitásban, ami közvetlen és erős kölcsönhatásra utal a K és a CO 2 közt: K(a) + CO 2(g) = K+- CO 2 - (a)� A 650 és 2350 cm-1 sávok ugyanazon széndioxid expozíció melletti növekedése (TPDben is megfigyelhető) a gyengén kötött CO 2 felületi koncentrációjának növekedésére utal: (CO 2)n. CO 2 - felületi komplex K-Au vibr. CO 2 - Ta=95 K Exp. CO 2= 8. 0 L

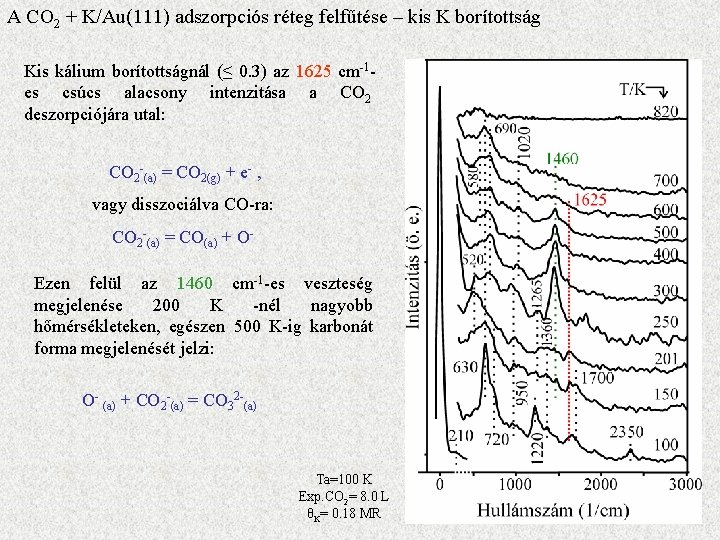
A CO 2 + K/Au(111) adszorpciós réteg felfűtése – kis K borítottság Kis kálium borítottságnál (≤ 0. 3) az 1625 cm-1 es csúcs alacsony intenzitása a CO 2 deszorpciójára utal: CO 2 -(a) = CO 2(g) + e- , vagy disszociálva CO-ra: CO 2 -(a) = CO(a) + OEzen felül az 1460 cm-1 -es veszteség megjelenése 200 K -nél nagyobb hőmérsékleteken, egészen 500 K-ig karbonát forma megjelenését jelzi: O- (a) + CO 2 -(a) = CO 32 -(a) Ta=100 K Exp. CO 2= 8. 0 L θK= 0. 18 MR

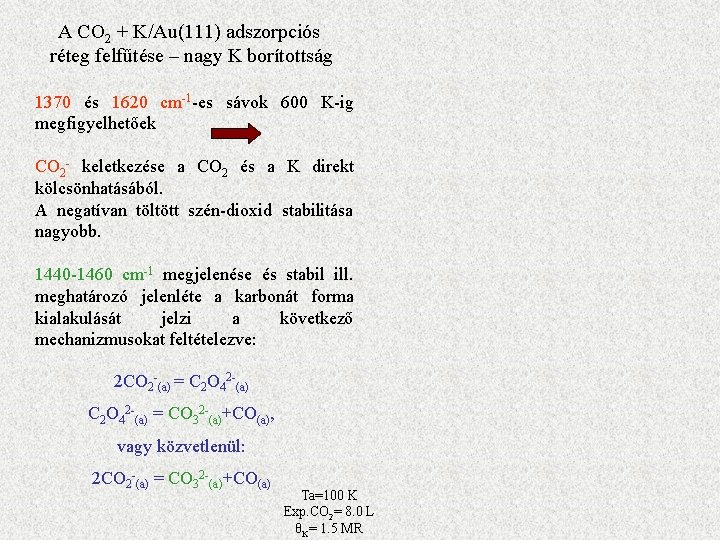
A CO 2 + K/Au(111) adszorpciós réteg felfűtése – nagy K borítottság 1370 és 1620 cm-1 -es sávok 600 K-ig megfigyelhetőek CO 2 - keletkezése a CO 2 és a K direkt kölcsönhatásából. A negatívan töltött szén-dioxid stabilitása nagyobb. 1440 -1460 cm-1 megjelenése és stabil ill. meghatározó jelenléte a karbonát forma kialakulását jelzi a következő mechanizmusokat feltételezve: 2 CO 2 -(a) = C 2 O 42 -(a) = CO 32 -(a)+CO(a), vagy közvetlenül: 2 CO 2 -(a) = CO 32 -(a)+CO(a) Ta=100 K Exp. CO 2= 8. 0 L θK= 1. 5 MR

Az UV bevilágítás hatása az adszorpciós rétegre Ta=110 K Exp. CO 2= 8. 0 L θK= 0. 5 MR

Az előadás felépítése • A kísérleteknél használt berendezés bemutatása • Alkáli párologtatás technikája, az adatom felületi viselkedésének irodalma • Kálium kötéserőssége és hatása a felületi struktúrára Mo 2 C/Mo(100) és Au(111) egykristály felületeken • Alkáli fém adalékolás (K) hatásának bemutatása különböző felületeken és módszerekkel: 1. CO 2+K/Au(111) rendszer 2. Alkoholok (etanol) adszorpciója és reakciói K/Mo 2 C/Mo(100) felületen 3. Szén-hidrogén fragmentek reakcióútjainak bemutatása (C 3 H 7 I adszorpció példáján) K/Mo 2 C/Mo(100) felületen, K-I felületi forma kialakulása • Összegzés

Etanol adszorpciója és reakciói K-Mo 2 C/Mo(100) felületen • • Etanol expozíció hatására kilépési munka csökkenés a Mo 2 C/Mo(100) felületen egészen 8. 0 L-ig. (A ábra). ( ΔΦ is 1. 2 e. V) Az adszorbeált réteg felfűtésének hatására növekedés figyelhető meg (B ábra) ~700 K-nél maximum (0. 25 e. V), ami a C 2 H 5 OH disszociációból származó adszorbeált felületi CO-ra utal. Az etanol és a Mo 2 C/Mo(100) felület között erős kölcsönhatás van (elektron vándorlás az oxigén nem kötő elektronpárja és a felület között). K-Mo 2 C/Mo(100) felületen a C 2 H 5 OH adszorpcióját követően (ΘK = 1. 0 MR) kilépési munka növekedést tapasztalhatunk (1. 2 e. V). (A ábra) A K és az etanol közti erős kölcsönhatás jelenléte csökkenti az elektron átadást a káliumból a Mo 2 C felület irányába. A B

Adszorbeált kálium hatása az etanol adszorpciójára és reakcióira Mo 2 C/Mo(100) felületen a TPD eredmények • Kálium stabilizálta a felületen adszorbeált alkoholokat. • 450– 500 K-en, H 2, CO, acetaldehid, etén és metán (a C 2 H 5 OH-ból) képződött, az etén mennyisége K adalékolásra csökkent. • közel egyező deszorpciós hőmérséklet (H 2, CO és a K) felületi komplex K + C 2 H 5 OH(g) = C 2 H 5 O–K(a) + H(a) Bomlása valószínűleg acetaldehiden keresztül, ami vagy deszorbeálódik, vagy tovább bomlik CO-ra, és metánr: a (és K-ra). CH 3 CHO(a) = CH 4(a) + CO(a) A. P. Farkas. ; F. Solymosi Surf. Sci. 602 (2008) 1475 -1485.

Adszorbeált kálium hatása az etanol adszorpciójára és reakcióira Mo 2 C/Mo(100) felületen a HREELS eredmények K-al promotált felületen • Stabilizál a C 2 H 5 O– K felületi komplex kialakulása közben: C 2 H 5 OH(a) + K = C 2 H 5 O–K + H(a) A 436 (δ(CCO)), 1060 cm-1 -nél (ν(CO), νa(CCO)) tapasztalt elnyelési sávok jelenléte és a 3260 cm-1(ν(OH)) csúcs eltűnése lehet a bizonyíték a spektrumokon. • 100 K-től - 500 K-ig jelen is voltak jelezvén a K-etoxi nagy stabilitását. VAGY C–O kötés szakadásán keresztül: C 2 H 5 OH(a) = C 2 H 5(a) + OH(a). 770 γ(CH 2), 940 τs(CH 2) és 1120 cm-1–nél ω(CH 2), kis C 2 H 5 OH expozícióknál (0, 5– 4. 0 L). etil csoport Kálium borítottság hatása a HREEL spektrumokra 8 L etanol adszorbciót követően Mo 2 C/Mo(100) felületen Ta=100 K.

Az előadás felépítése • A kísérleteknél használt berendezés bemutatása • Alkáli párologtatás technikája, az adatom felületi viselkedésének irodalma • Kálium kötéserőssége és hatása a felületi struktúrára Mo 2 C/Mo(100) és Au(111) egykristály felületeken • Alkáli fém adalékolás (K) hatásának bemutatása különböző felületeken és módszerekkel: 1. CO 2+K/Au(111) rendszer 2. Alkoholok (etanol) adszorpciója és reakciói K/Mo 2 C/Mo(100) felületen 3. Szén-hidrogén fragmentek reakcióútjainak bemutatása (C 3 H 7 I adszorpció példáján) K/Mo 2 C/Mo(100) felületen, K-I felületi forma kialakulása • Összegzés

C 3 H 7 I adszorpció K-al adalékolt Mo 2 C/Mo(100) felületen - Molekuláris adszorpció, K borítottságtól függően a C-I kötés szakadása már 100 K-en. - A C 3 H 7 (K stabilizálja) reakciói: Dehidrogéneződés C 3 H 7(a) = C 3 H 6(a) + H(a) Hidrogéneződés C 3 H 7(a)+ H(a) = C 3 H 8(a) - A kálium elősegíti a kapcsolási reakciókat: hexán és hexén a tiszta felületen tapasztaltakhozképest megnövekedett mennyiségben

C 3 H 7 I adszorpció K-al adalékolt Mo 2 C/Mo(100) felületen - Molekuláris C 3 H 7 I adszorpció 885, 1020, 1195, 1380, 1465 és 2966 cm-1 -nél (8 L propil-jodid –tiszta felületen) 100 K-en kis C 3 H 7 I expozíciónál (0. 4 L) �K=0. 33 -tól új sávok: 1370, 2712 és 2860 cm-1 -nél C-I szakadás, Propil csoport Kálium borítottság hatása a HREEL spektrumokra 0. 4 L propil-jodid adszorbciót követően Mo 2 C/Mo(100) felületen Ta=100 K.

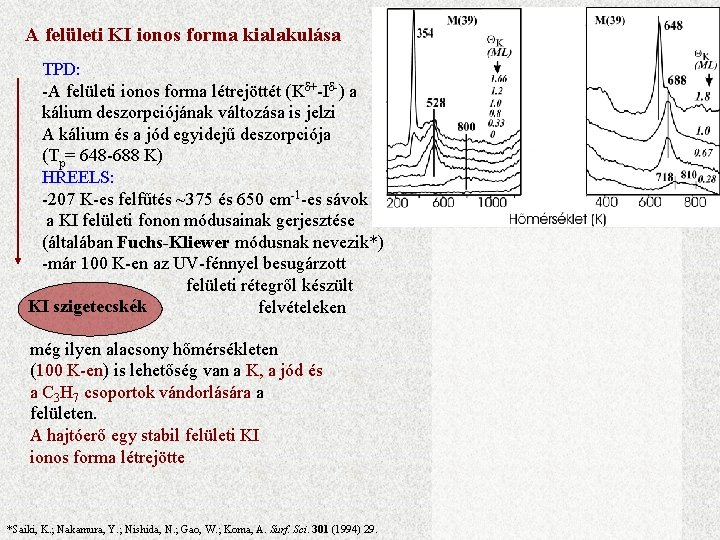
A felületi KI ionos forma kialakulása TPD: -A felületi ionos forma létrejöttét (Kδ+-Iδ-) a kálium deszorpciójának változása is jelzi A kálium és a jód egyidejű deszorpciója (Tp= 648 -688 K) HREELS: -207 K-es felfűtés ~375 és 650 cm-1 -es sávok a KI felületi fonon módusainak gerjesztése (általában Fuchs-Kliewer módusnak nevezik*) -már 100 K-en az UV-fénnyel besugárzott felületi rétegről készült KI szigetecskék felvételeken még ilyen alacsony hőmérsékleten (100 K-en) is lehetőség van a K, a jód és a C 3 H 7 csoportok vándorlására a felületen. A hajtóerő egy stabil felületi KI ionos forma létrejötte *Saiki, K. ; Nakamura, Y. ; Nishida, N. ; Gao, W. ; Koma, A. Surf. Sci. 301 (1994) 29.

A következtetések összefoglalása ü Kálium atomok csökkentik a felület kilépési munkáját, mintegy 3. 2 e. V-al. ü Az Au(111) felületen a struktúra periodicitása csökken, a Au step atom mobilitás nő (gyengült kötés a második réteg felé) ü Borítottság hatása a kötéserősségre (350 K és magasabb hőmérsékletű deszorpció) CO 2 + K/Au(111) adszorpciós réteg ü A CO 2 stabilizálódik a K-al adalékolt Au(111) felületen tiszta felülethez képest és CO 2 képződését tapasztaltuk. ü A CO 2 - reakcióútja függ a kálium borítottságtól; disszociáció kis ill. karbonát képződés nagy kálium borítottságnál. ü A fém kálium és a CO 2 közti direkt kölcsönhatást jelzi a kálium stabilizáló hatása a koadszorpciós rétegre. 2021. 10. 19. 24

Cx. Hy. OH + K/Mo 2 C/Mo(100) adszorpciós réteg ü Az alkoholok adszorpciója kissé növelte a felület kilépési munkáját K jelenlétében (ami önmagában mintegy 3 e. V-al csökkenti azt). ü A kálium stabilizálta az adszorbeált alkoholokat a Mo 2 C/Mo(100) felületen. Így azok magasabb hőmérsékleten bomlottak el, H 2, CO, CH 4, C 2 H 4 és CH 3 CHO képződése mellett (etanol esetében). ü HREELS méréseink az adszorbeált alkoholok C-O és O-H kötéseinek szakadására ill. ennek megfelelően a Cx. Hy. O-K(a) és Cx. Hy. O(a) felületi formák megjelenésére is bizonyítékot szolgáltattak. Cx. Hy. I + K/Mo 2 C/Mo(100) adszorpciós réteg ü a K kissé stabilizálja a Cx. Hy. I molekulákat a borítottságtól függően a felületen üA Cx. Hy. I molekulák átlagosan ~50 K-el alacsonyabb disszociációs hőmérséklete a felület megnővelt reaktivitására (K-Cx. Hy. I reakció), a magasabb desz. hőmérsékletek a Cx. Hy csoport stabilizációjára utalnak. üA K alacsony hőmérsékleten elősegíti a kapcsolási reakciókat melyet a nagyobb mennyiségben keletkező termékek: etén, hexán, hexén jeleznek.

ü A K és jód deszorpciója (Tp=652, 684 K) egyazon hőmérsékleten, egymás kölcsönös stabilizációjára utalnak egy ionos felületi formán keresztül (650 cm 1). ü Kálium jelenlétében a termikusan indukált C-I kötés teljes szakadása (kis és nagy K borítottságnál is) már 100 -150 K-en végbemegy, UV bevilágitás hatására (illetve a borítottságtól függően) pedig már 100 K-en. ü Az adott alkil-jodid disszociációjából származó szén-hidrogén csoportra utaló jeleken túl a képződő termékek prekurzor molekulái is megfigyelhetőek a spektrumokon úgymint di- σ-etilén, π-kötésű etilén és di-σ-propilén. ü A felületi KI képződését a 370 és ~650 cm-1 -es csúcsok megjelenése indikálja. Köszönöm a megtisztelő figyelmet!

Részvételem az előadás témájához kapcsolódó publikációkhoz: ØFarkas A P, Koos A, Bugyi L, Solymosi F Effects of potassium on the reaction pathway of C 3 H 7 species over Mo 2 C/Mo (100). Surf. Sci. 600: pp. 2355 -2363. (2006) ØFarkas AP, Bugyi L, Koós Á, Solymosi F Effects of potassium on the reaction pathways of CH 2 fragment over Mo 2 C/Mo(100). Surf. Sci. 601: (18) pp. 3736 -3739. (2007) ØFarkas AP, Koós Á, Bugyi L, Solymosi F Adsorption and reaction of methyl and ethyl iodide on potassium-promoted Mo 2 C/Mo(100) surface. J. Phys. Chem. C 112: pp. 18502 -18509. (2008) ØFarkas AP, Solymosi F Effects of potassium on the adsorption pathways of methanol and ethanol on Mo 2 C/Mo(100). Surf. Sci. 602: pp. 1475 -1485. (2008) ØFarkas AP, Solymosi F Activation and reactions of CO 2 on a K-promoted Au(111) surface. J. Phys. Chem. C 113: (46) pp. 19930 -19936. (2009) ØFarkas AP, Solymosi F Photolysis of the CO 2 + K/Au(111) system. J. Phys. Chem. C 114: pp. 16979 -16982. Paper 10. 1021/jp 101841 b. (2010) ØPistonesi C, Juan A, Farkas AP, Solymosi F Effects of potassium on the adsorption of methanol on β-Mo 2 C(001) surface. Surf. Sci. 604: pp. 914 -919. (2010)

1. Felhasznált irodalom a kilépési munka változások összehasonlító táblázatában: 2. 3. 4. Liu, Z. M. ; Solymosi, F. ; White, J. M. Surf. Sci. 1991, 245, 289. Solymosi, F. ; Bugyi, L. J. Chem. Soc. Faraday Trans. I. 1987, 83, 2015. Min, B. K. ; Alemozafar, A. R. ; Biener, M. M. ; Biener, J. ; Friend, C. M. Top. Catal. 2005, 36, 77. and references therein. Onsgaard, J. ; Hoffmann, S. V. ; Moller, P. ; Godowski, P. J. , Wagner, J. B. ; Paolucci, G. ; Baraldi, A. ; Comelli, G. ; Groso, A. Chem. Phys. Chem. 2003, 4, 466; Onsgaard, J. ; Godowski, P. J. ; Nerlov, J. ; Quist, S. ; Hoffmann, S. V. Surf. Sci. 1998, 318. Herrera-Fierro, P. ; Wang, K. ; Wagner, F. T. ; Moylan, T. E. ; Chottiner, G. S. ; Scherson, D. A. J. Phys. Chem. 1992, 96, 3788. 5. 6.