As reaes qumicas fazem parte do nosso diaadia


















- Slides: 35


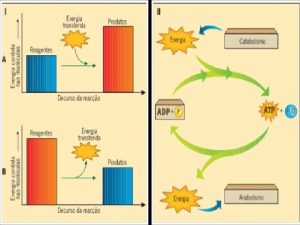
As reações químicas fazem parte do nosso dia-a-dia? Fazer um cafezinho: A água deve entrar em ebulição. . . Parte dela passa para o estado gasoso. Para isso ela precisa absorver energia!!! Reação Endotérmica Para o carro andar devemos colocar gasolina. Mas o que a gasolina tem a ver com o movimento do carro? O octano, C 8 H 18 é um dos componentes da gasolina, que ao reagir com o oxigênio do ar produz (CO 2), (H 2 O) e libera energia que é utilizada para fazer com que o carro entre em movimento. Reação Exotérmica

As reações químicas costumam ocorrer acompanhadas de alguns efeitos que podem dar uma dica de que elas estão acontecendo. Quais são estes efeitos? SAÍDA DE GASES FORMAÇÃO DE PRECIPITADO MUDANÇA DE COR ALTERAÇÕES DE CALOR

Estas reações são também conhecidas como reações de composição ou de adição. Neste tipo de reação um único composto é obtido a partir de dois compostos. Vamos ver uma ilustração deste tipo de reação!

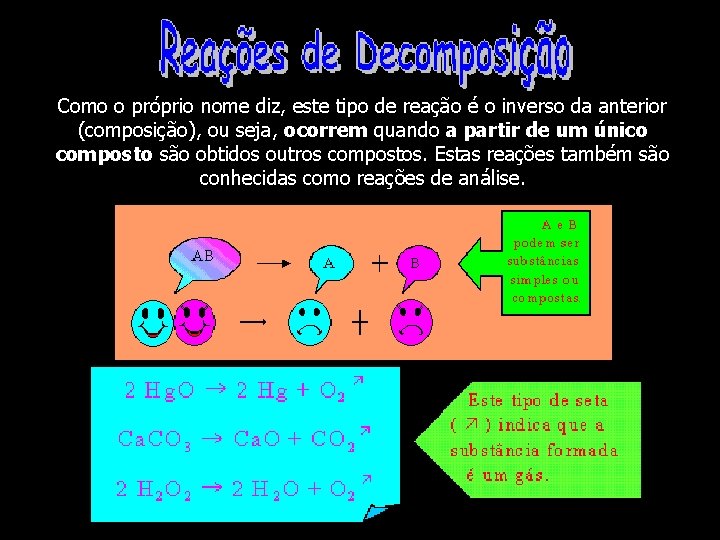
Como o próprio nome diz, este tipo de reação é o inverso da anterior (composição), ou seja, ocorrem quando a partir de um único composto são obtidos outros compostos. Estas reações também são conhecidas como reações de análise.


DECOMPOSIÇÃO PELO CALOR NH 4 HCO 3 NH 3(g) + H 2 O(g) + CO 2(g) FERMENTO QUÍMICO – Um exemplo de pirólise

DECOMPOSIÇÃO PELA LUZ H 2 O 2 H 2 O + ½ O 2 DECOMPOSIÇÃO DO PERÓXIDO DE HIDROGÊNIO PELA LUZ

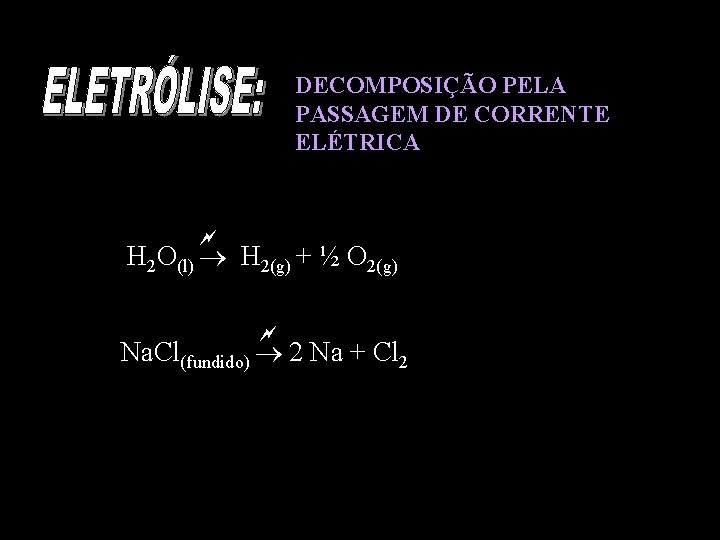
DECOMPOSIÇÃO PELA PASSAGEM DE CORRENTE ELÉTRICA H 2 O(l) H 2(g) + ½ O 2(g) Na. Cl(fundido) 2 Na + Cl 2

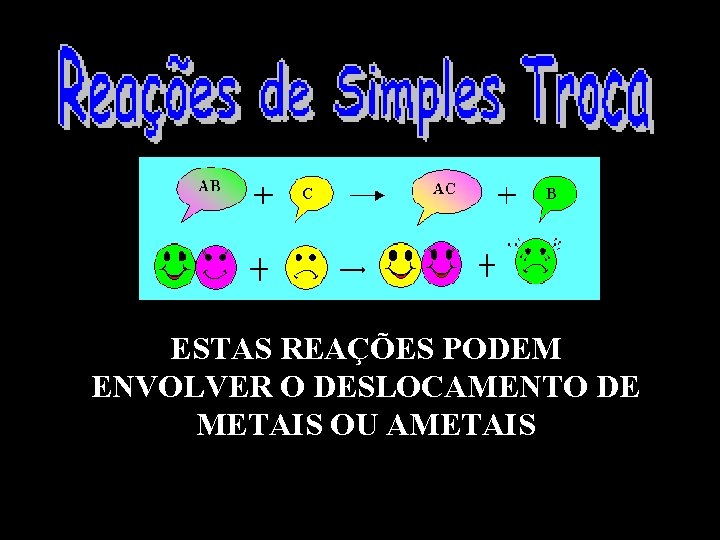
Estas reações ocorrem quando uma substância simples reage com uma substância composta para formar outra substância simples e outra composta. Estas reações são também conhecidas como reações de deslocamento ou reações de substituição.

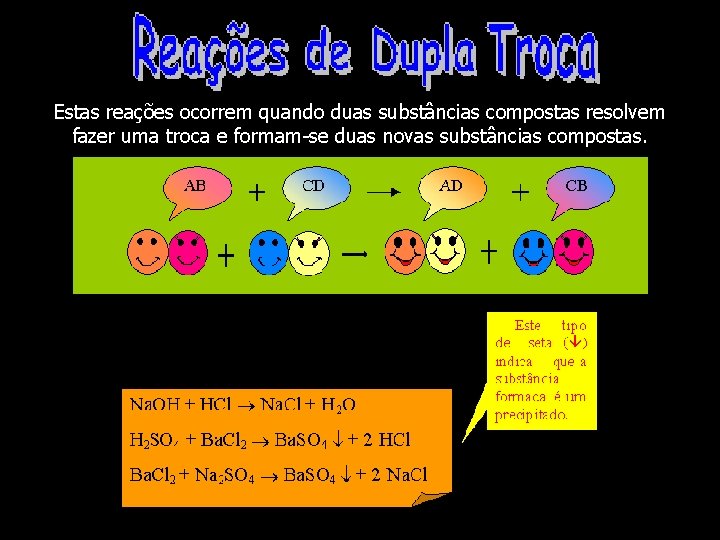
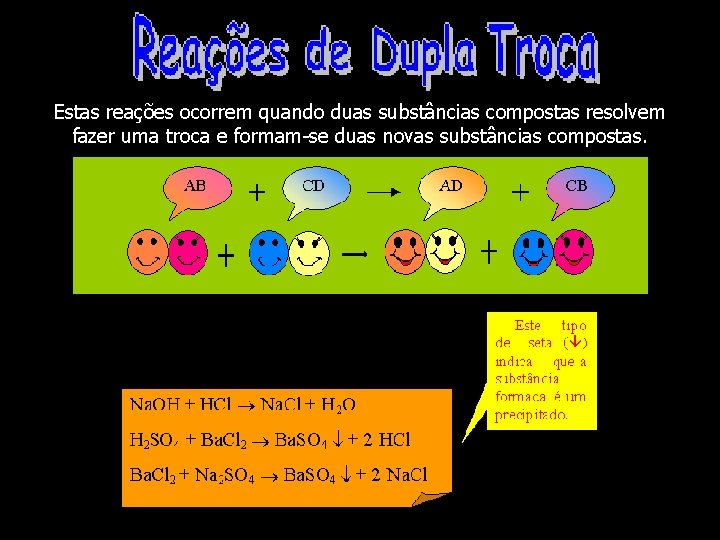
Estas reações ocorrem quando duas substâncias compostas resolvem fazer uma troca e formam-se duas novas substâncias compostas.

ESTAS REAÇÕES PODEM ENVOLVER O DESLOCAMENTO DE METAIS OU AMETAIS

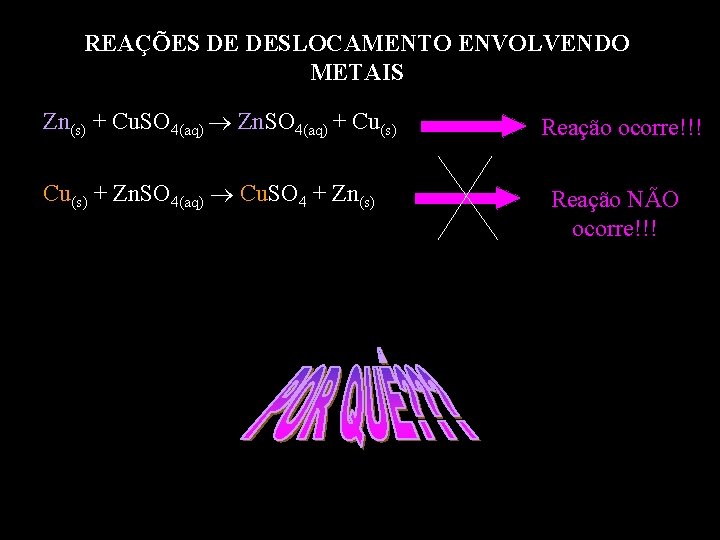
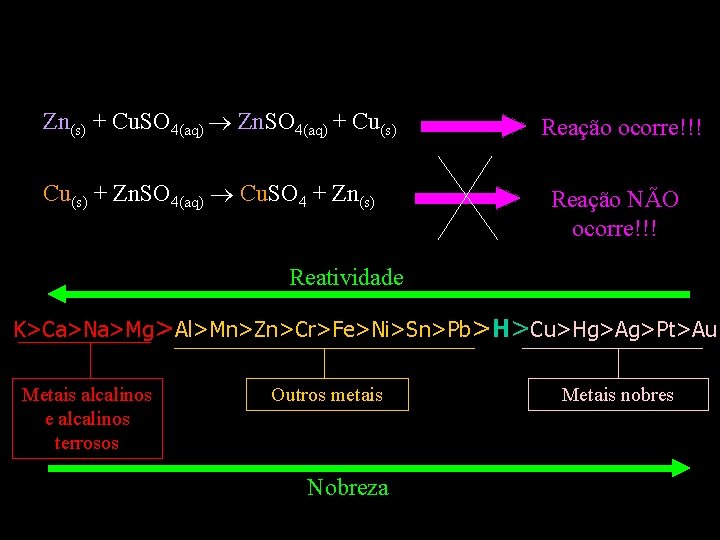
REAÇÕES DE DESLOCAMENTO ENVOLVENDO METAIS Zn(s) + Cu. SO 4(aq) Zn. SO 4(aq) + Cu(s) + Zn. SO 4(aq) Cu. SO 4 + Zn(s) Reação ocorre!!! Reação NÃO ocorre!!!

Zn(s) + Cu. SO 4(aq) Zn. SO 4(aq) + Cu(s) + Zn. SO 4(aq) Cu. SO 4 + Zn(s) Reação ocorre!!! Reação NÃO ocorre!!! Reatividade K>Ca>Na>Mg>Al>Mn>Zn>Cr>Fe>Ni>Sn>Pb>H>Cu>Hg>Ag>Pt>Au Metais alcalinos e alcalinos terrosos Outros metais Nobreza Metais nobres

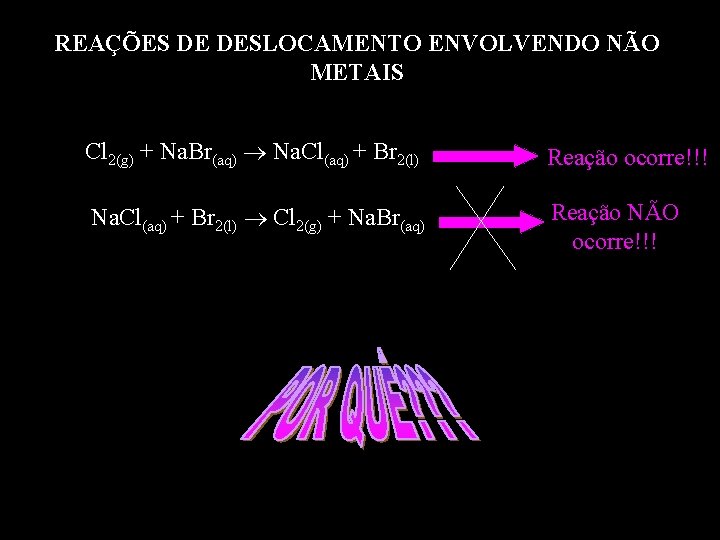
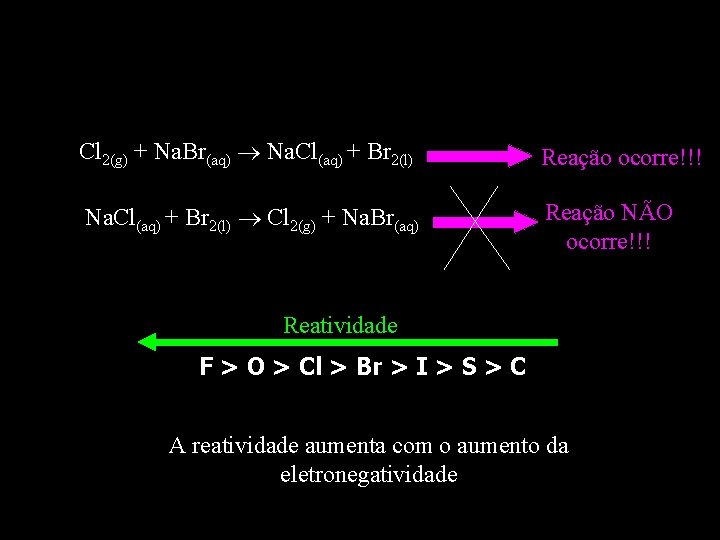
REAÇÕES DE DESLOCAMENTO ENVOLVENDO NÃO METAIS Cl 2(g) + Na. Br(aq) Na. Cl(aq) + Br 2(l) Reação ocorre!!! Na. Cl(aq) + Br 2(l) Cl 2(g) + Na. Br(aq) Reação NÃO ocorre!!!

Cl 2(g) + Na. Br(aq) Na. Cl(aq) + Br 2(l) Reação ocorre!!! Na. Cl(aq) + Br 2(l) Cl 2(g) + Na. Br(aq) Reação NÃO ocorre!!! Reatividade F > O > Cl > Br > I > S > C A reatividade aumenta com o aumento da eletronegatividade

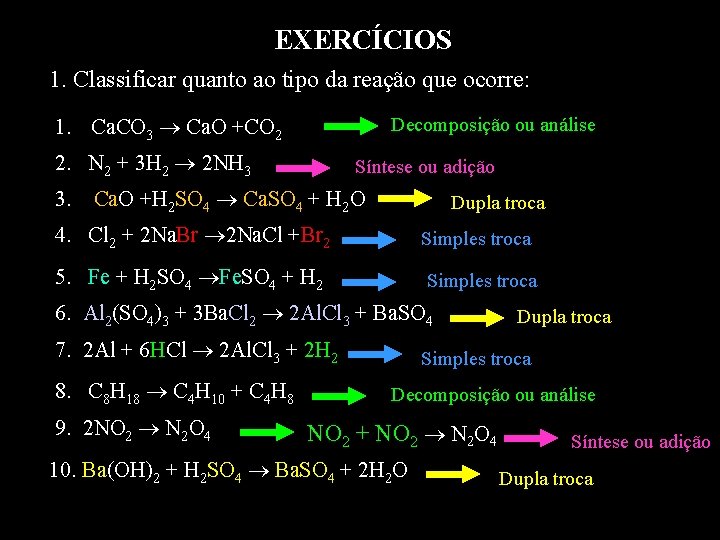
EXERCÍCIOS 1. Classificar quanto ao tipo da reação que ocorre: 1. Ca. CO 3 Ca. O +CO 2 Decomposição ou análise 2. N 2 + 3 H 2 2 NH 3 Síntese ou adição 3. Ca. O +H 2 SO 4 Ca. SO 4 + H 2 O Dupla troca 4. Cl 2 + 2 Na. Br 2 Na. Cl +Br 2 Simples troca 5. Fe + H 2 SO 4 Fe. SO 4 + H 2 Simples troca 6. Al 2(SO 4)3 + 3 Ba. Cl 2 2 Al. Cl 3 + Ba. SO 4 7. 2 Al + 6 HCl 2 Al. Cl 3 + 2 H 2 8. C 8 H 18 C 4 H 10 + C 4 H 8 9. 2 NO 2 N 2 O 4 Dupla troca Simples troca Decomposição ou análise NO 2 + NO 2 N 2 O 4 10. Ba(OH)2 + H 2 SO 4 Ba. SO 4 + 2 H 2 O Síntese ou adição Dupla troca

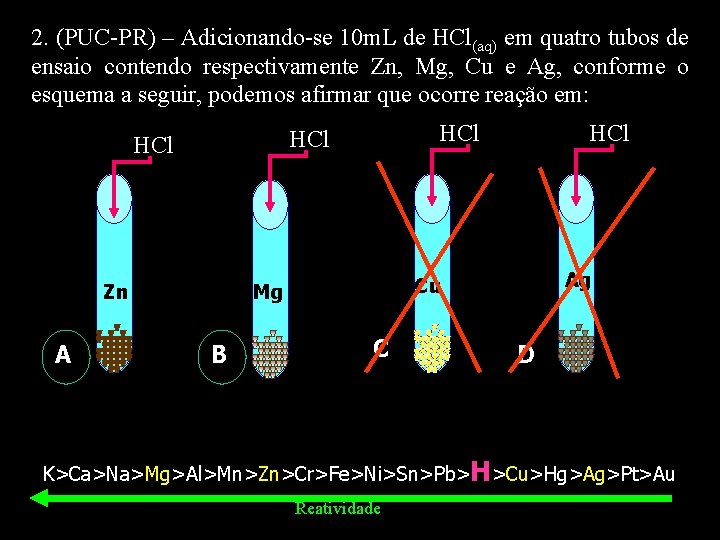
2. (PUC-PR) – Adicionando-se 10 m. L de HCl(aq) em quatro tubos de ensaio contendo respectivamente Zn, Mg, Cu e Ag, conforme o esquema a seguir, podemos afirmar que ocorre reação em: Zn A HCl HCl Ag Cu Mg B HCl C D K>Ca>Na>Mg>Al>Mn>Zn>Cr>Fe>Ni>Sn>Pb>H>Cu>Hg>Ag>Pt>Au Reatividade


Estas reações ocorrem quando duas substâncias compostas resolvem fazer uma troca e formam-se duas novas substâncias compostas.

QUAIS SÃO OS OBJETIVOS DE EFETUAR-SE UMA REAÇÃO DE DUPLA TROCA? ? ? GERALMENTE É A FORMAÇÃO DE UM NOVO PRODUTO, QUE POSSA SER FACILMENTE SEPARADO DOS OUTROS PRODUTOS QUE EVENTUALMENTE SE FORMEM. DESTA FORMA, PARA QUE REAÇÕES DE DUPLA TROCA OCORRAM NA PRÁTICA, ALGUMAS SITUAÇÕES SÃO NECESSÁRIAS!!!

OBSERVEM: I) Na 2 S + 2 Ag. NO 3 Ag 2 S + 2 Na. NO 3 II) Na 2 CO 3 + 2 HCl H 2 O + CO 2 + 2 Na. Cl III) KCl + Na. NO 3 Na. Cl + KNO 3 NA PRÁTICA, QUAIS DESSAS REAÇÕES SERIAM VIÁVEIS? ? ? POR QUÊ? ? ?

PARA QUE A REAÇÃO DE DUPLA TROCA OCORRA NA PRÁTICA É NECESSÁRIO: QUE UM DOS PRODUTOS FORMADOS SEJA INSOLÚVEL OU QUE UM DOS PRODUTOS FORMADOS SEJA VOLÁTIL (GASOSO)

QUANDO UM DOS PRODUTOS É GASOSO QUAIS PRODUTOS PODEM SE APRESENTAR NO ESTADO GASOSO? ? ? - OS HIDRÁCIDOS: (HCl, HBr, HCN, H 2 S) - SUBST NCIAS COMO: NH 4 OH NH 3 + H 2 O H 2 CO 3 CO 2 + H 2 O H 2 SO 3 SO 2 + H 2 O

EXEMPLOS: Na 2 S + HNO 3 H 2 S + Na. NO 3 K 2 SO 4 + 2 HCl 2 KCl + H 2 CO 3 CO 2 + H 2 O ☺OBS: Se um dos produtos é volátil, obtemos uma solução aquosa do outro produto.

QUANDO UM DOS PRODUTOS É INSOLÚVEL REGRAS GERAIS DE SOLUBILIDADE: - Todos os ácidos inorgânicos comuns são solúveis; -Somente as bases com cátion da família 1 A, NH 4+, Ca 2+, Sr 2+ e Ba 2+ são solúveis, as demais são insolúveis; - Todos os sais com cátion da família 1 A e NH 4+ e que tenham os ânions nitrato (NO 3 -) ou clorato (Cl. O 3 -) são solúveis sem exceções.

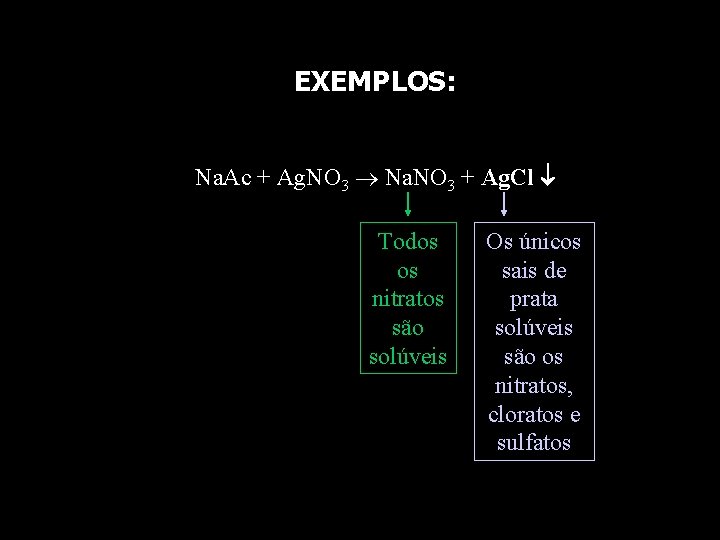
EXEMPLOS: Na. Ac + Ag. NO 3 Na. NO 3 + Ag. Cl Todos os nitratos são solúveis Os únicos sais de prata solúveis são os nitratos, cloratos e sulfatos

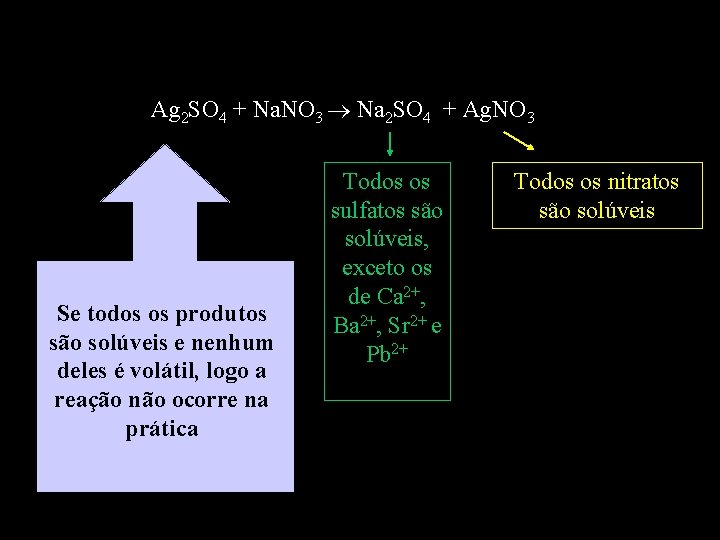
Ag 2 SO 4 + Na. NO 3 Na 2 SO 4 + Ag. NO 3 Se todos os produtos são solúveis e nenhum deles é volátil, logo a reação não ocorre na prática Todos os sulfatos são solúveis, exceto os de Ca 2+, Ba 2+, Sr 2+ e Pb 2+ Todos os nitratos são solúveis

EXERCÍCIOS 3. Faça uma previsão do que ocorre quando são misturadas as soluções indicadas abaixo: a) KI + Pb. Ac 2 Pb. I 2 + KAc O único acetato insolúvel é o de prata. Haletos e sulfatos de chumbo são insolúveis ♦ Ocorre reação, pois um dos produtos é insolúvel. b) Na 2 CO 3 + 2 HCl 2 Na. Cl + H 2 CO 3 H 2 O + CO 2 ♦ Ocorre reação, pois há liberação de gás. c) KCl + Na. NO 3 Na. Cl + KNO 3 Todos os ácidos inorgânicos comuns são solúveis ♦ Não ocorre reação, pois não há liberação de gás nem a formação de um precipitado.

4. Corresponde à reação na qual ocorre formação de produto insolúvel 01) Na. Ac + Ag. NO 3 Na. NO 3 + Ag. Ac 02) Ba. Cl 2 + Na 2 SO 4 Na. Cl + Ba. SO 4 O único acetato insolúvel é o de prata. Todos os nitratos são solúveis Todos os sulfatos são solúveis, exceto os de Ca 2+, Ba 2+, Sr 2+ e Pb 2+ 04) Na 2 S + HNO 3 Na. NO 3 + H 2 S 08) K 2 CO 3 + 2 HCl 2 KCl + H 2 CO 3 H 2 O + CO 2 16) Cu. SO 4 + Na. OH Na 2 SO 4 + Cu(OH)2 32) Na 2 SO 3 + HNO 3 H 2 SO 3 + Na. NO 3 Bases solúveis são as com cátion da família 1 A, NH 4+

5 a. Juntando-se Ag. NO 3 à solução aquosa de Na. Cl, há formação de um precipitado branco. Escreva a reação: Haletos de prata são insolúveis. Ag. NO 3 + Na. Cl Na. NO 3 + Ag. Cl Os sais de prata, em geral , só são solúveis com cloratos, nitratos e sulfatos. 5 b. Juntando-se solução aquosa de nitrato de prata a clorato de sódio, não há formação de precipitado. Explique porque nesse caso não há reação. Ag. NO 3 + Na. Cl. O 3 Na. NO 3 + Ag. Cl. O 3 Todos os nitratos e cloratos são solúveis, logo não forma -se nenhum produto insolúvel ou mesmo gasoso.

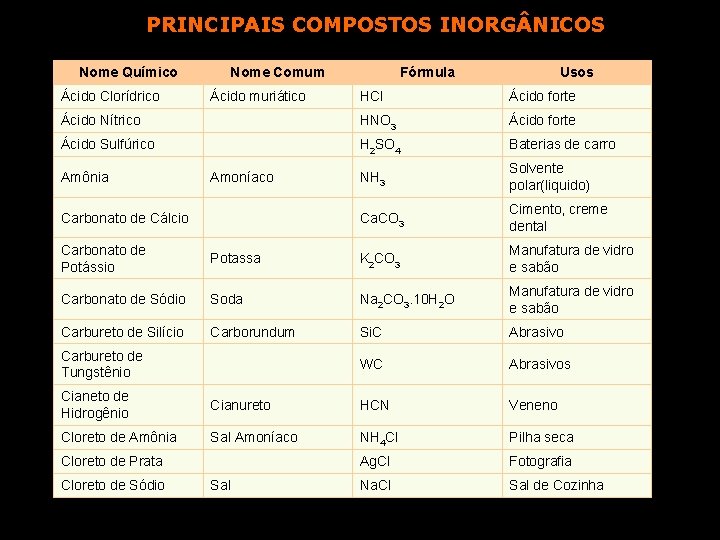
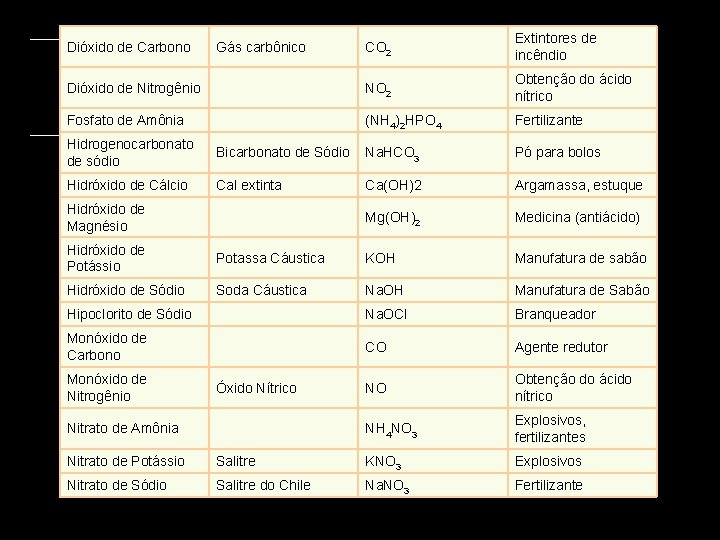
PRINCIPAIS COMPOSTOS INORG NICOS Nome Químico Ácido Clorídrico Nome Comum Usos HCl Ácido forte Ácido Nítrico HNO 3 Ácido forte Ácido Sulfúrico H 2 SO 4 Baterias de carro NH 3 Solvente polar(liquido) Ca. CO 3 Cimento, creme dental Amônia Ácido muriático Fórmula Amoníaco Carbonato de Cálcio Carbonato de Potássio Potassa K 2 CO 3 Manufatura de vidro e sabão Carbonato de Sódio Soda Na 2 CO 3. 10 H 2 O Manufatura de vidro e sabão Carbureto de Silício Carborundum Si. C Abrasivo WC Abrasivos Carbureto de Tungstênio Cianeto de Hidrogênio Cianureto HCN Veneno Cloreto de Amônia Sal Amoníaco NH 4 Cl Pilha seca Ag. Cl Fotografia Na. Cl Sal de Cozinha Cloreto de Prata Cloreto de Sódio Sal

CO 2 Extintores de incêndio Dióxido de Nitrogênio NO 2 Obtenção do ácido nítrico Fosfato de Amônia (NH 4)2 HPO 4 Fertilizante Dióxido de Carbono Gás carbônico Hidrogenocarbonato de sódio Bicarbonato de Sódio Na. HCO 3 Pó para bolos Hidróxido de Cálcio Cal extinta Ca(OH)2 Argamassa, estuque Mg(OH)2 Medicina (antiácido) Hidróxido de Magnésio Hidróxido de Potássio Potassa Cáustica KOH Manufatura de sabão Hidróxido de Sódio Soda Cáustica Na. OH Manufatura de Sabão Hipoclorito de Sódio Na. OCl Branqueador Monóxido de Carbono CO Agente redutor NO Obtenção do ácido nítrico NH 4 NO 3 Explosivos, fertilizantes Monóxido de Nitrogênio Óxido Nítrico Nitrato de Amônia Nitrato de Potássio Salitre KNO 3 Explosivos Nitrato de Sódio Salitre do Chile Na. NO 3 Fertilizante

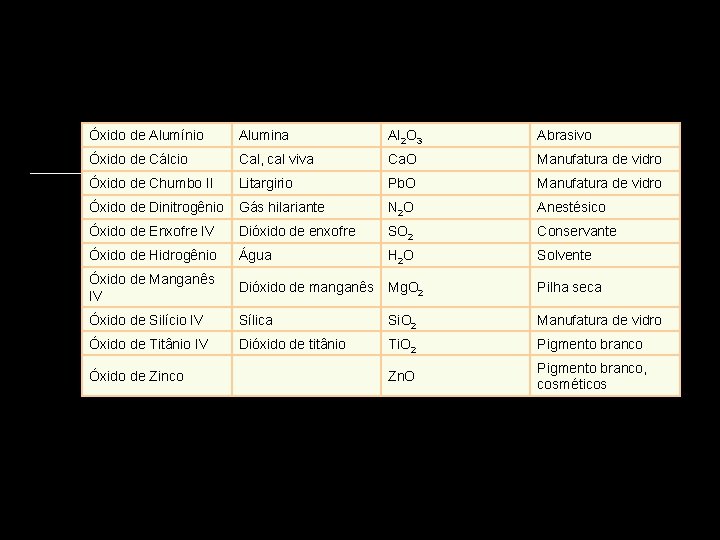
Óxido de Alumínio Alumina Al 2 O 3 Abrasivo Óxido de Cálcio Cal, cal viva Ca. O Manufatura de vidro Óxido de Chumbo II Litargirio Pb. O Manufatura de vidro Óxido de Dinitrogênio Gás hilariante N 2 O Anestésico Óxido de Enxofre IV Dióxido de enxofre SO 2 Conservante Óxido de Hidrogênio Água H 2 O Solvente Óxido de Manganês IV Dióxido de manganês Mg. O 2 Pilha seca Óxido de Silício IV Sílica Si. O 2 Manufatura de vidro Óxido de Titânio IV Dióxido de titânio Ti. O 2 Pigmento branco Zn. O Pigmento branco, cosméticos Óxido de Zinco

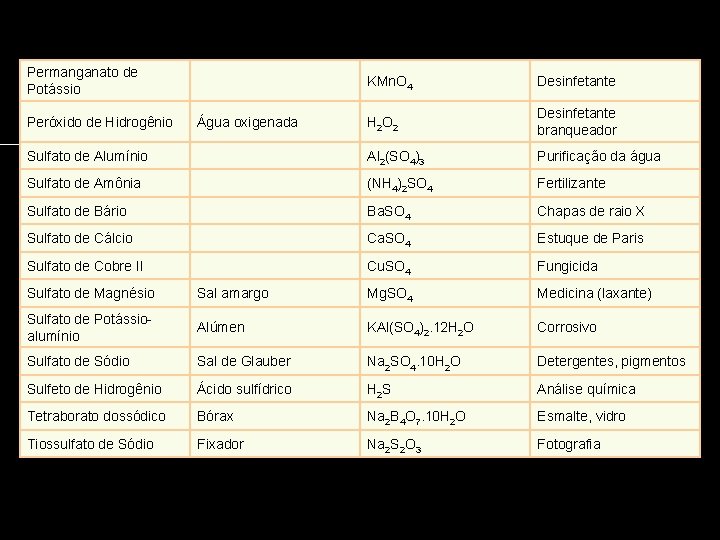
Permanganato de Potássio KMn. O 4 Desinfetante H 2 O 2 Desinfetante branqueador Sulfato de Alumínio Al 2(SO 4)3 Purificação da água Sulfato de Amônia (NH 4)2 SO 4 Fertilizante Sulfato de Bário Ba. SO 4 Chapas de raio X Sulfato de Cálcio Ca. SO 4 Estuque de Paris Sulfato de Cobre II Cu. SO 4 Fungicida Peróxido de Hidrogênio Água oxigenada Sulfato de Magnésio Sal amargo Mg. SO 4 Medicina (laxante) Sulfato de Potássioalumínio Alúmen KAl(SO 4)2. 12 H 2 O Corrosivo Sulfato de Sódio Sal de Glauber Na 2 SO 4. 10 H 2 O Detergentes, pigmentos Sulfeto de Hidrogênio Ácido sulfídrico H 2 S Análise química Tetraborato dossódico Bórax Na 2 B 4 O 7. 10 H 2 O Esmalte, vidro Tiossulfato de Sódio Fixador Na 2 S 2 O 3 Fotografia
 Qumicas
Qumicas Quando a caridade chega toda tristeza logo se vai
Quando a caridade chega toda tristeza logo se vai Pai celeste criador
Pai celeste criador Te invitamos a ser parte o hacer parte
Te invitamos a ser parte o hacer parte Este parte aquele parte
Este parte aquele parte Como se leen las fracciones del 1 al 20
Como se leen las fracciones del 1 al 20 Slides para missa
Slides para missa 5 pedreiros fazem um muro em 10 horas
5 pedreiros fazem um muro em 10 horas Bem aventurado os que promovem a paz
Bem aventurado os que promovem a paz Texto de nelson mandela nosso medo mais profundo
Texto de nelson mandela nosso medo mais profundo Deus nosso pai que tendes poder e bondade
Deus nosso pai que tendes poder e bondade Em belem nasceu jesus nosso grande redentor
Em belem nasceu jesus nosso grande redentor Por nosso senhor jesus cristo vosso filho
Por nosso senhor jesus cristo vosso filho Vinde vede e anunciai as maravilhas de deus nosso pai letra
Vinde vede e anunciai as maravilhas de deus nosso pai letra Ano do resgatador
Ano do resgatador Louvemos ao senhor adoremos no seu santo monte
Louvemos ao senhor adoremos no seu santo monte Parábola do filho pródigo bíblia ave maria
Parábola do filho pródigo bíblia ave maria Corpo glorificado
Corpo glorificado Pai nosso, em ti cremos
Pai nosso, em ti cremos Pai no cu
Pai no cu Determinantes relativos
Determinantes relativos Teu corpo é nosso alimento
Teu corpo é nosso alimento Nosso deus fez um mundo tão perfeito
Nosso deus fez um mundo tão perfeito Regozijate
Regozijate Louvai o nome
Louvai o nome Bendito e louvado seja o pai nosso criador
Bendito e louvado seja o pai nosso criador A frente do nosso tempo
A frente do nosso tempo Pai nosso que estais no céu e nos que amam a verdade
Pai nosso que estais no céu e nos que amam a verdade Vós senhor sois o nosso pai
Vós senhor sois o nosso pai Não posso mais olhar nosso jardim
Não posso mais olhar nosso jardim Nosso pai que seu nome seja mantido santo
Nosso pai que seu nome seja mantido santo Batizai
Batizai Deus nosso criador
Deus nosso criador Canto no presépio pequenino
Canto no presépio pequenino Venha ser nosso parceiro
Venha ser nosso parceiro Ainda que o nosso corpo exterior se corrompa
Ainda que o nosso corpo exterior se corrompa