As foras Intermoleculares H H O H As










- Slides: 40

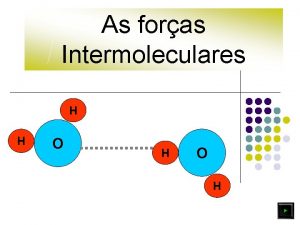
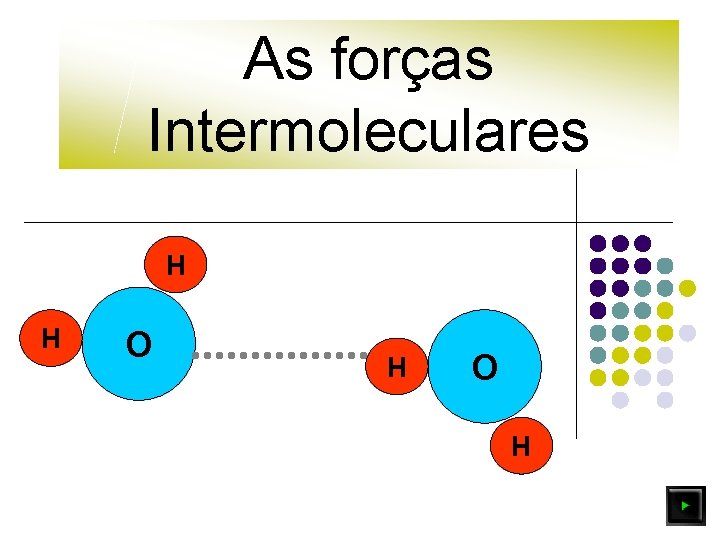
As forças Intermoleculares H H O H

As forças Intermoleculares Johannes Diederik Van der Waals (1837 -1923), físico holandês, recebeu o Prémio Nobel da Física em 1910 pelas suas pesquisas sobre os estados gasoso e líquido.

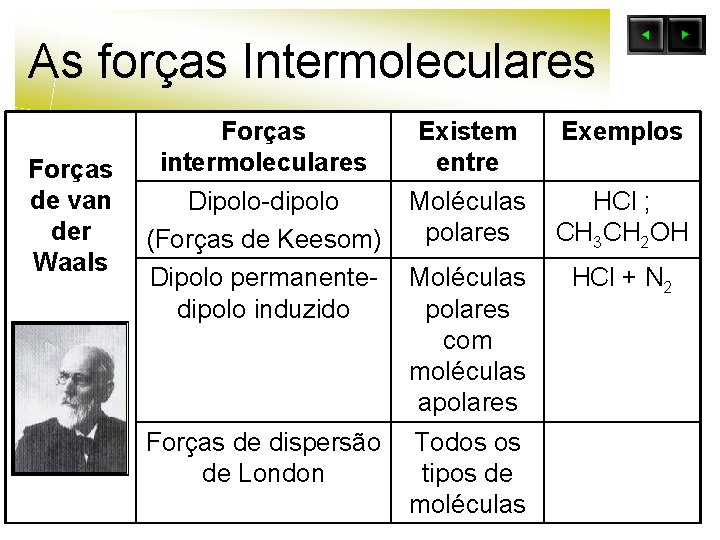
As forças Intermoleculares Forças de Van der Waals Forças intermoleculares Existem entre Dipolo-dipolo (Forças de Keesom) Moléculas polares Dipolo permanentedipolo induzido (Forças de Debye) Moléculas polares com moléculas apolares Forças de dispersão de London Todos os tipos de moléculas Exemplos HCl ; CH 3 CH 2 OH HCl + N 2

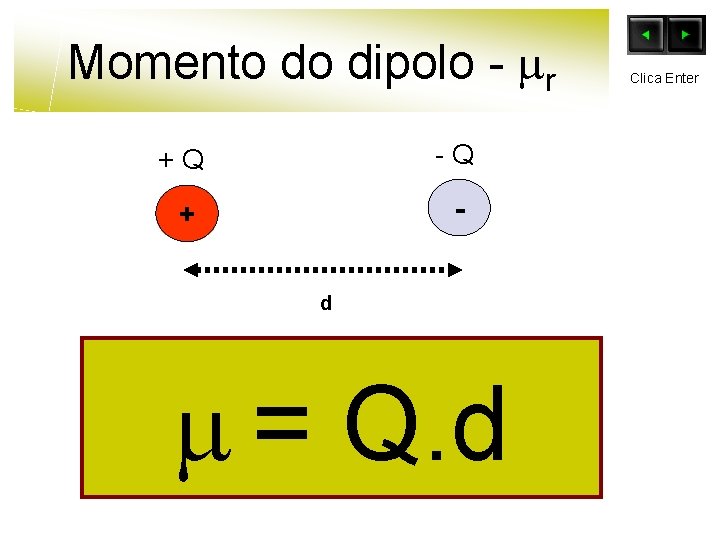
Momento do dipolo - r +Q -Q + d = Q. d Clica Enter

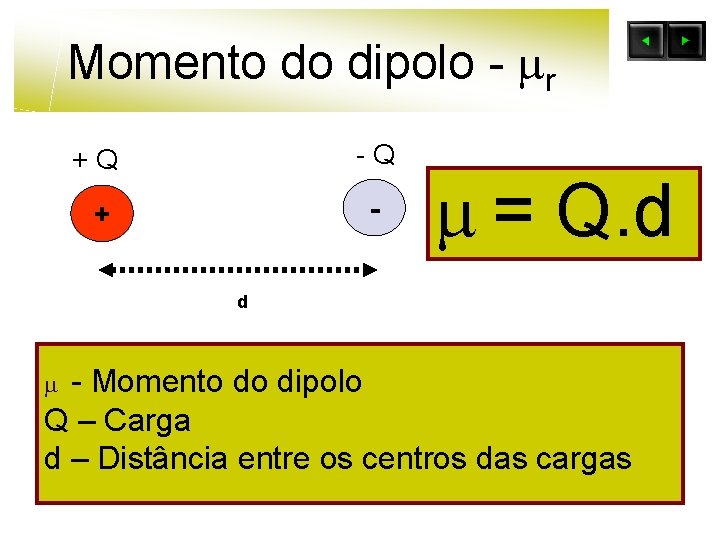
Momento do dipolo - r +Q -Q + - = Q. d d - Momento do dipolo Q – Carga d – Distância entre os centros das cargas

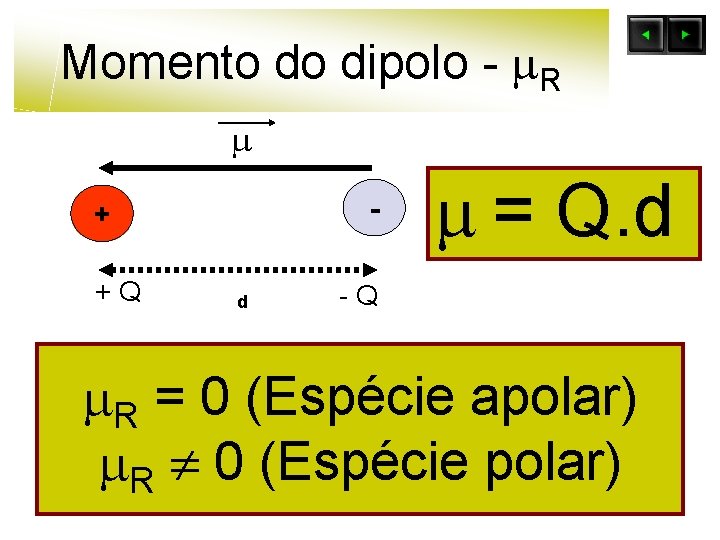
Momento do dipolo - R - + +Q d = Q. d -Q R = 0 (Espécie apolar) R 0 (Espécie polar)

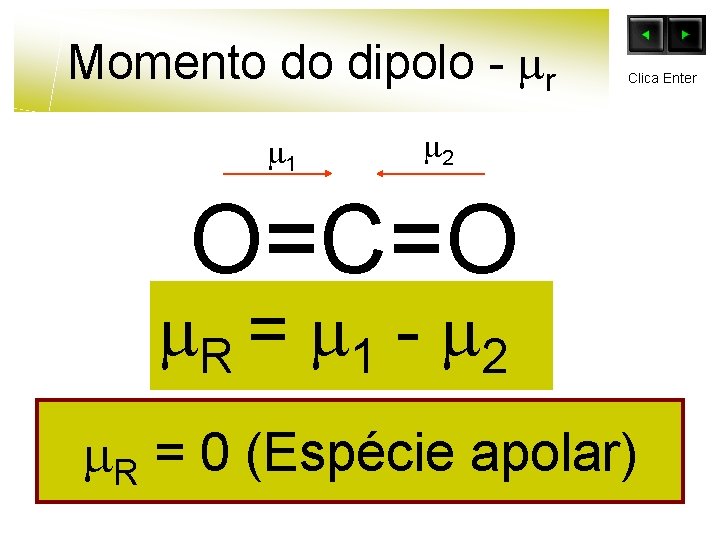
Momento do dipolo - r 1 Clica Enter 2 O=C=O R = 1 - 2 R = 0 (Espécie apolar)

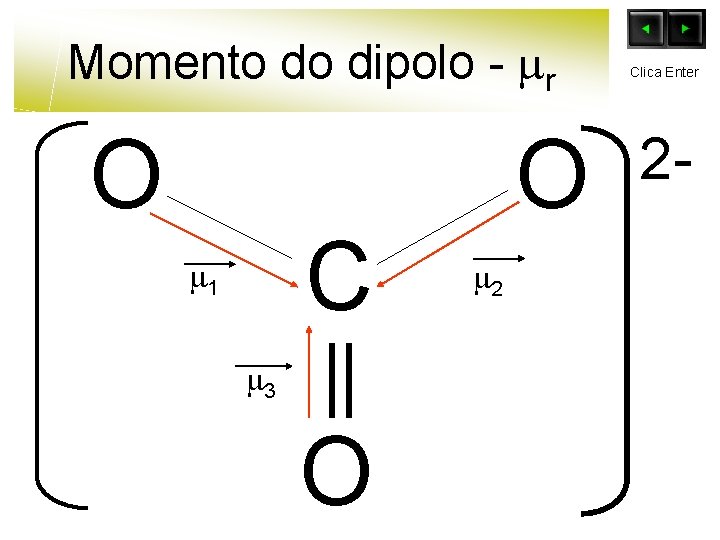
Momento do dipolo - r O C 1 3 O O 2 Clica Enter 2 -

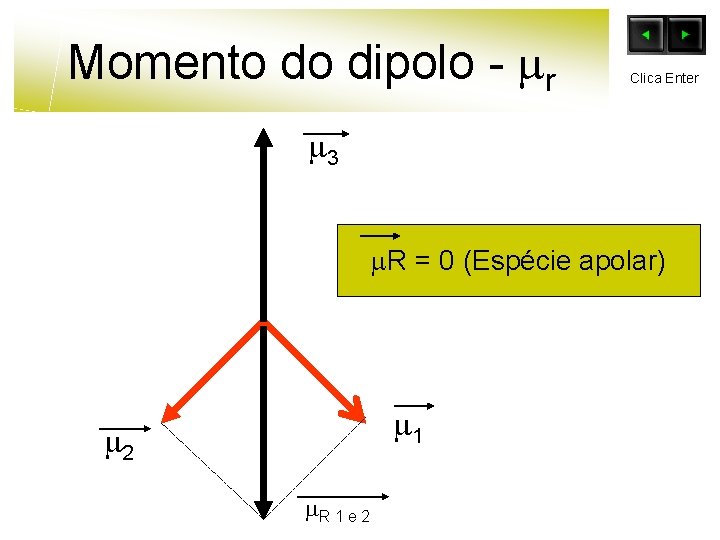
Momento do dipolo - r Clica Enter 3 R = 0 (Espécie apolar) 1 2 R 1 e 2

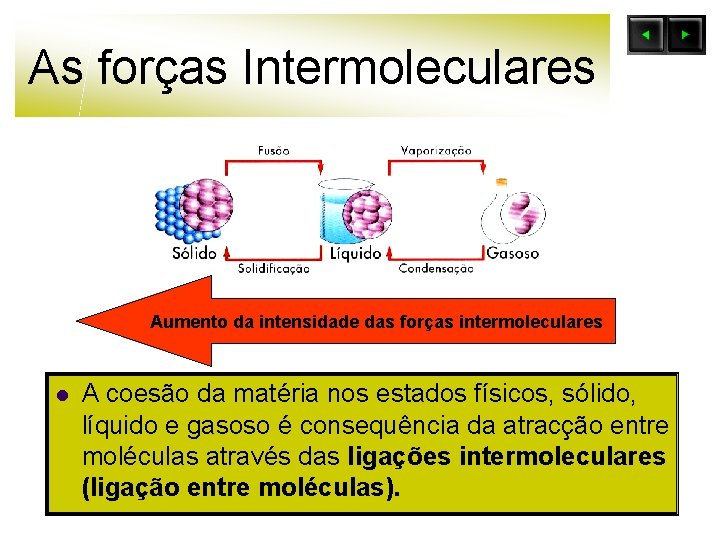
As forças Intermoleculares Aumento da intensidade das forças intermoleculares l A coesão da matéria nos estados físicos, sólido, líquido e gasoso é consequência da atracção entre moléculas através das ligações intermoleculares (ligação entre moléculas).

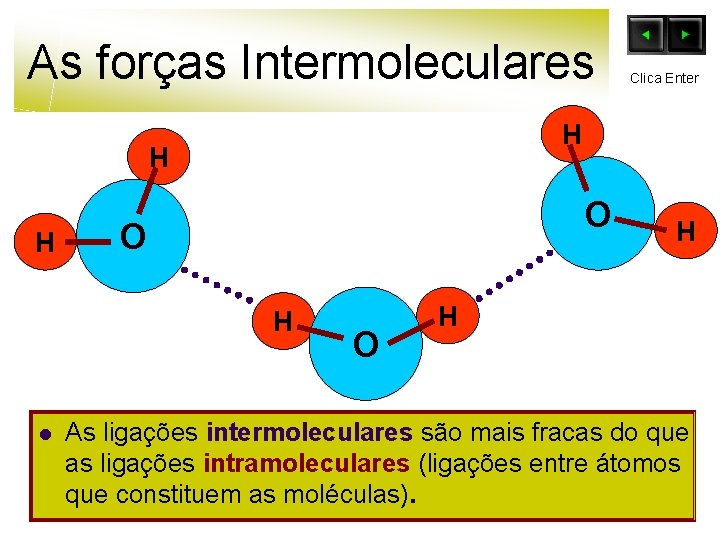
As forças Intermoleculares H H H O O H l Clica Enter O H H As ligações intermoleculares são mais fracas do que as ligações intramoleculares (ligações entre átomos que constituem as moléculas).

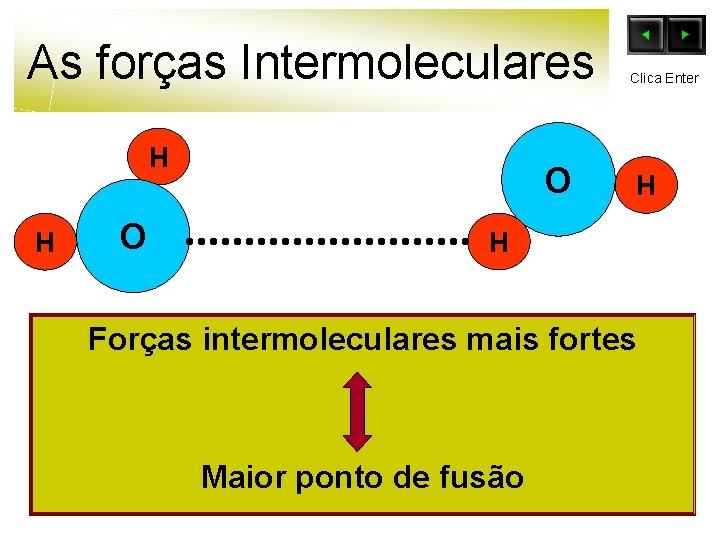
As forças Intermoleculares H H O O Clica Enter H H Forças intermoleculares mais fortes Maior ponto de fusão

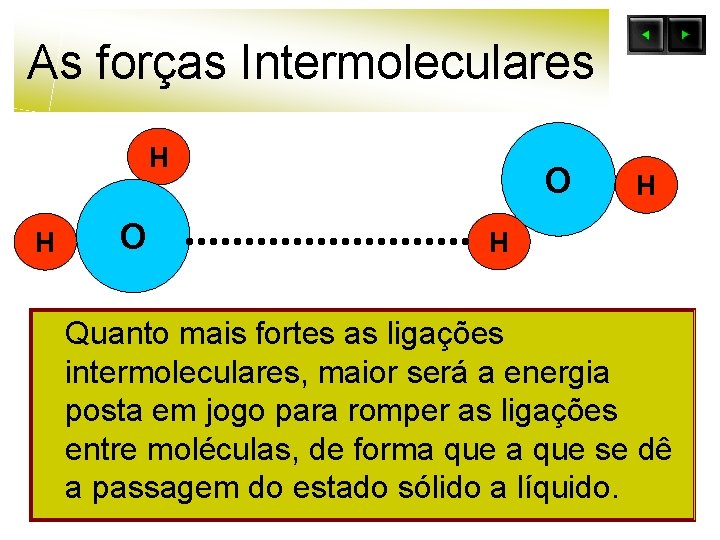
As forças Intermoleculares H H O O H H Quanto mais fortes as ligações intermoleculares, maior será a energia posta em jogo para romper as ligações entre moléculas, de forma que se dê a passagem do estado sólido a líquido.

As forças Intermoleculares l De acordo com a natureza, das ligações intermoleculares, os sólidos classificam-se em: - sólidos iónicos; - sólidos moleculares; - sólidos covalentes; - sólidos metálicos.

Sólidos Iónicos l As unidades constituintes da estrutura são iões positivos e negativos. l As ligações químicas que se estabelecem entre as unidades constituintes da estrutura são iónicas.

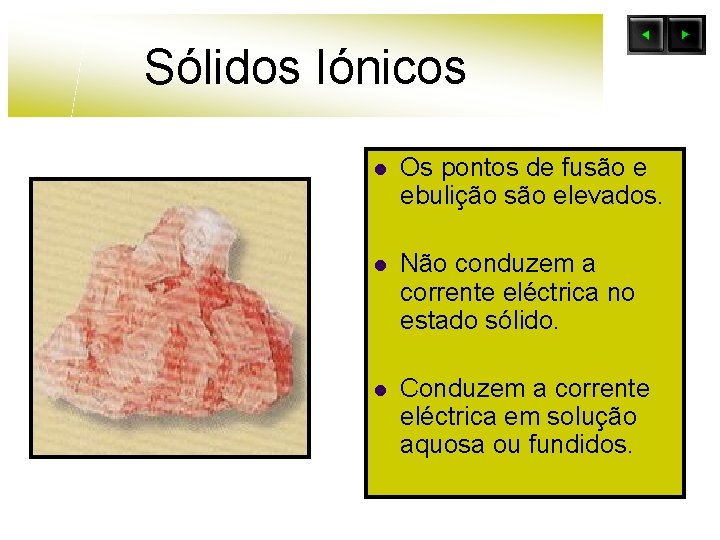
Sólidos Iónicos l Os pontos de fusão e ebulição são elevados. l Não conduzem a corrente eléctrica no estado sólido. l Conduzem a corrente eléctrica em solução aquosa ou fundidos.

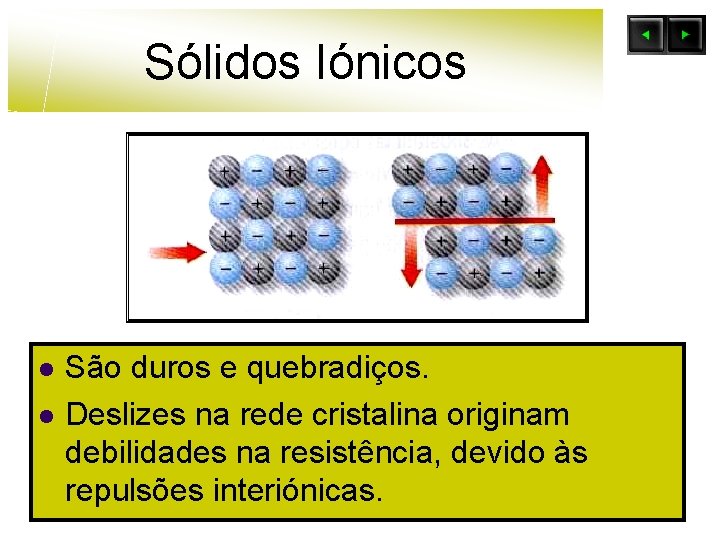
Sólidos Iónicos l l São duros e quebradiços. Deslizes na rede cristalina originam debilidades na resistência, devido às repulsões interiónicas.

Sólidos Moleculares l As unidades constituintes da estrutura são moléculas. l As moléculas podem ser polares ou apolares. l As ligações químicas que se estabelecem entre as unidades constituintes da estrutura são ligações dipolo-dipolo e ligações de London.

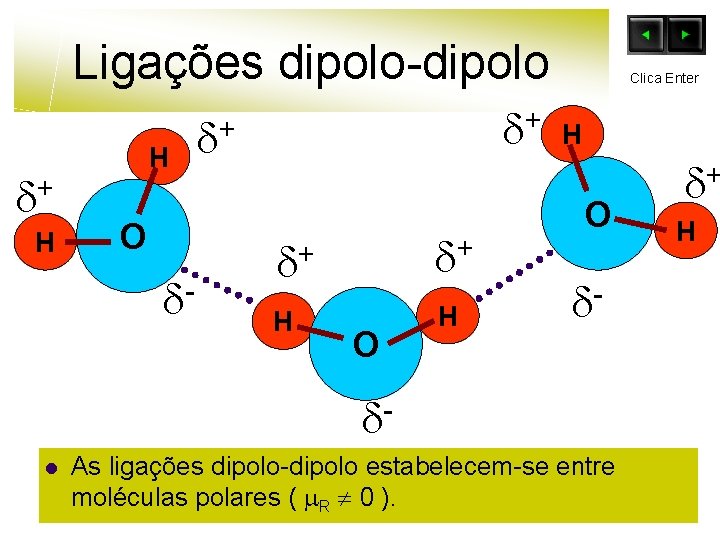
Ligações dipolo-dipolo + H H O - + + + + H H O Clica Enter H O l As ligações dipolo-dipolo estabelecem-se entre moléculas polares ( R 0 ). + H

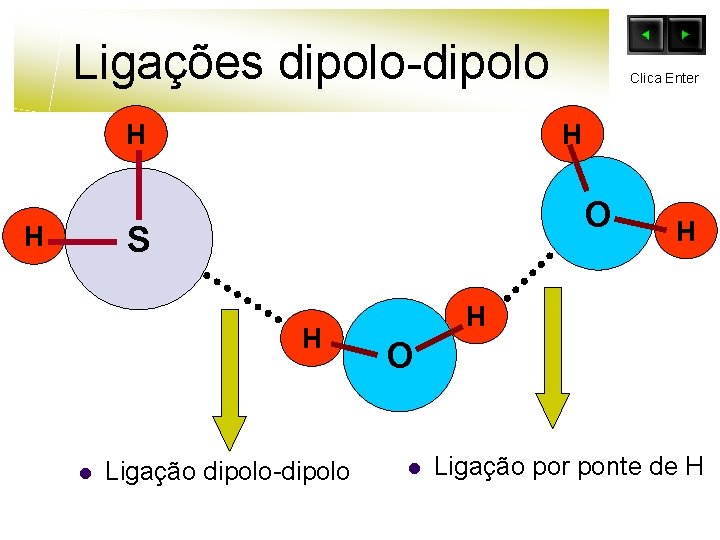
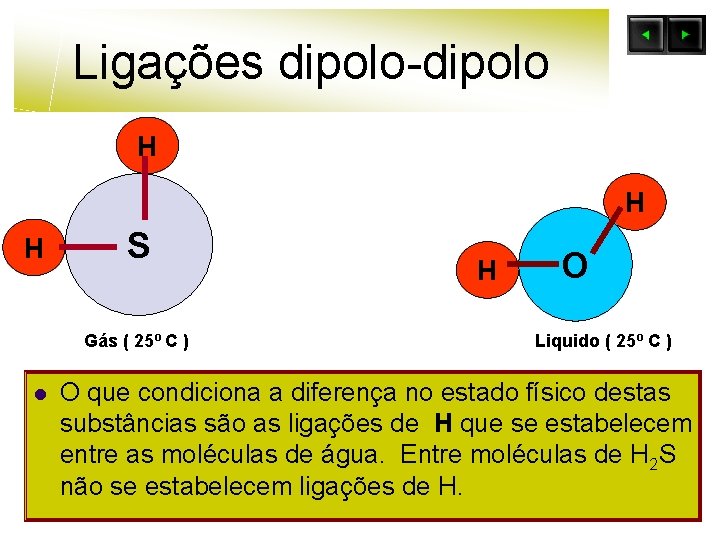
Ligações dipolo-dipolo H H O S H H l Clica Enter Ligação dipolo-dipolo H H O l Ligação por ponte de H

Ligações dipolo-dipolo H H O S H H l Clica Enter H H O A ligação de H ( Hidrogénio ) é um caso particular da ligação diplo-dipolo.

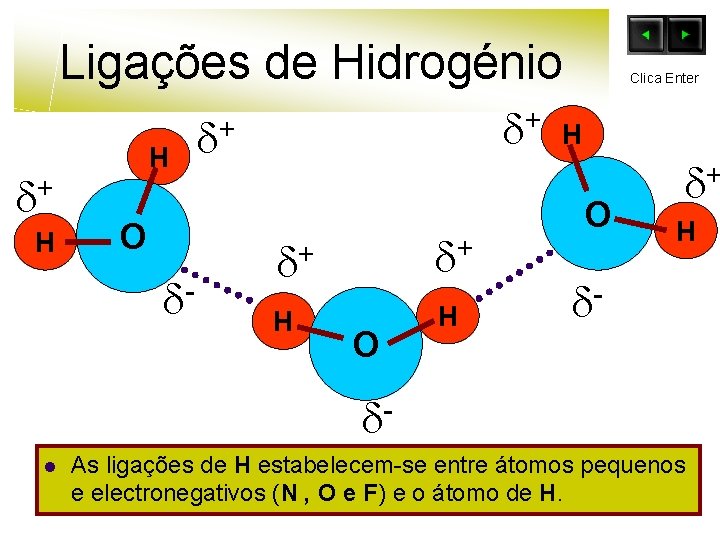
Ligações de Hidrogénio + H H O - + + + + H H O Clica Enter H O + H l As ligações de H estabelecem-se entre átomos pequenos e electronegativos (N , O e F) e o átomo de H.

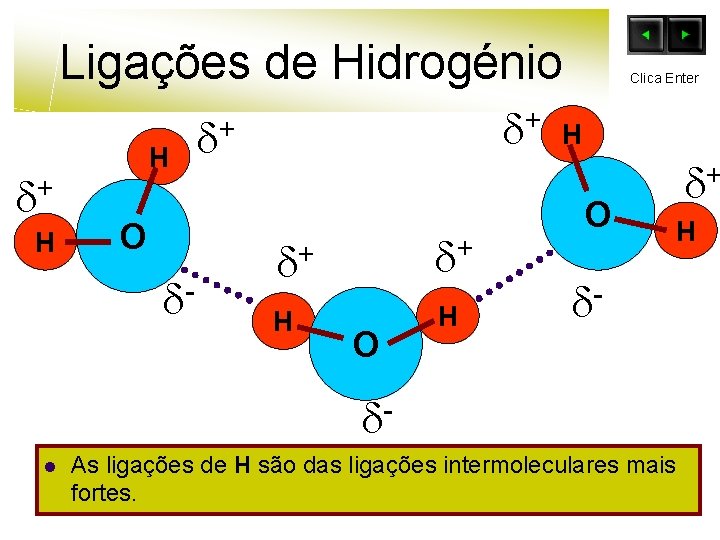
Ligações de Hidrogénio + H H O - + + + + H H O Clica Enter H O + H l As ligações de H são das ligações intermoleculares mais fortes.

Ligações dipolo-dipolo H H H S Gás ( 25º C ) l H O Liquido ( 25º C ) O que condiciona a diferença no estado físico destas substâncias são as ligações de H que se estabelecem entre as moléculas de água. Entre moléculas de H 2 S não se estabelecem ligações de H.

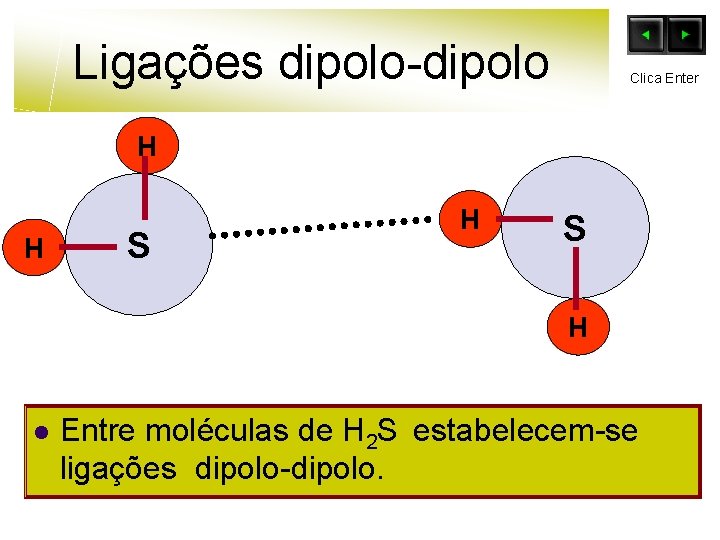
Ligações dipolo-dipolo Clica Enter H H S H l Entre moléculas de H 2 S estabelecem-se ligações dipolo-dipolo.

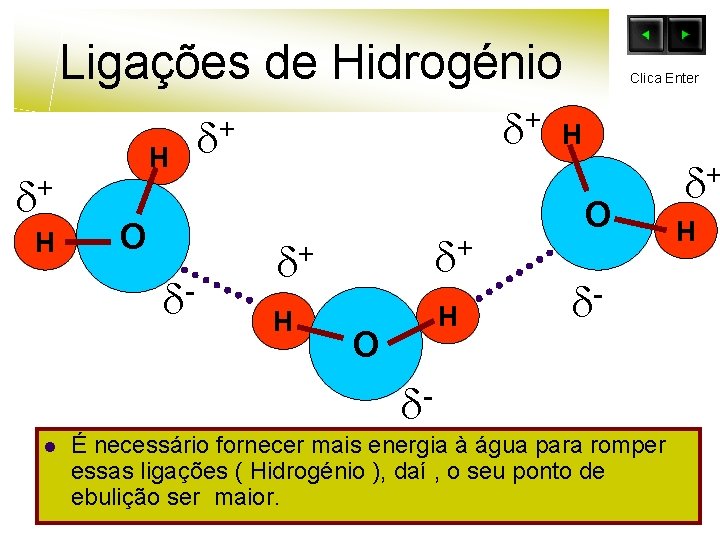
Ligações de Hidrogénio + H H O - + + + + H H O Clica Enter H O l É necessário fornecer mais energia à água para romper essas ligações ( Hidrogénio ), daí , o seu ponto de ebulição ser maior. + H

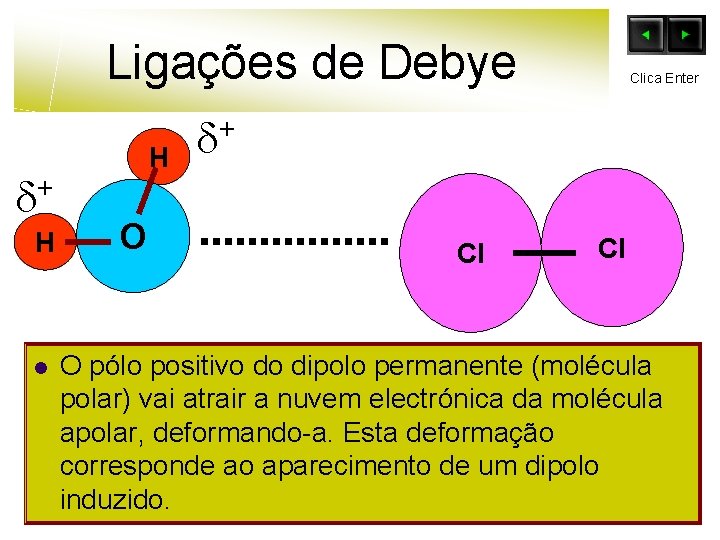
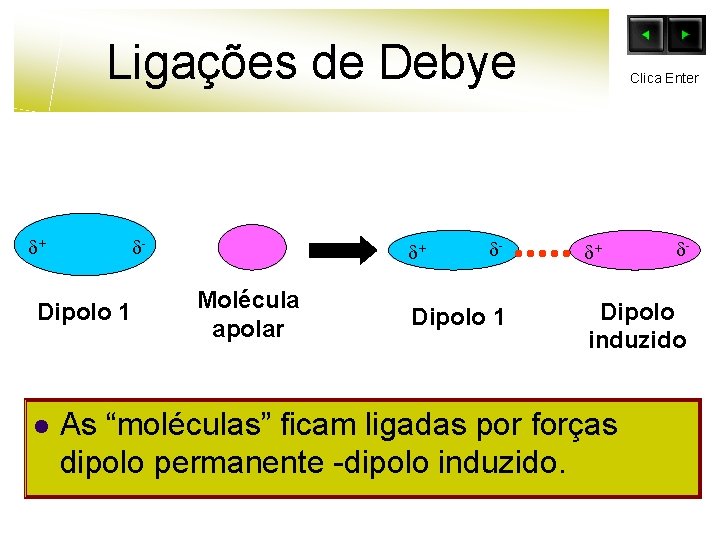
Ligações de Debye + H l H O Clica Enter + Cl Cl O pólo positivo do dipolo permanente (molécula polar) vai atrair a nuvem electrónica da molécula apolar, deformando-a. Esta deformação corresponde ao aparecimento de um dipolo induzido.

Ligações de Debye + - Dipolo 1 l + Molécula apolar - Dipolo 1 Clica Enter + - Dipolo induzido As “moléculas” ficam ligadas por forças dipolo permanente -dipolo induzido.

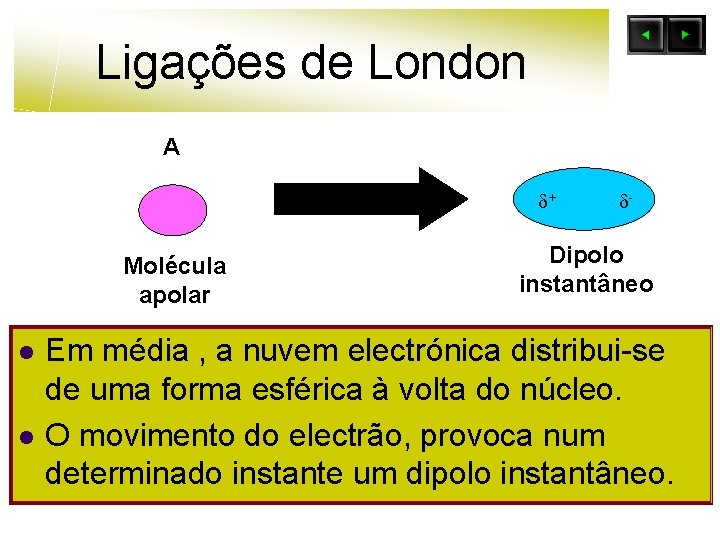
Ligações de London A + Molécula apolar l l - Dipolo instantâneo Em média , a nuvem electrónica distribui-se de uma forma esférica à volta do núcleo. O movimento do electrão, provoca num determinado instante um dipolo instantâneo.

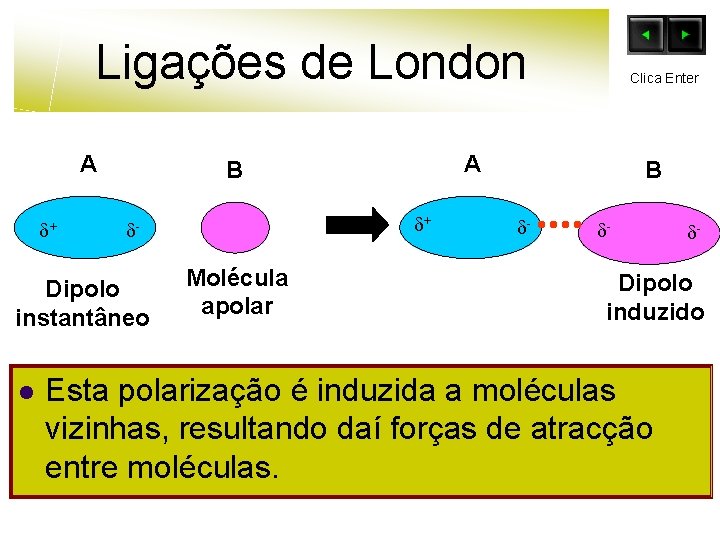
Ligações de London A + Dipolo instantâneo l A B + - Molécula apolar Clica Enter B - - - Dipolo induzido Esta polarização é induzida a moléculas vizinhas, resultando daí forças de atracção entre moléculas.

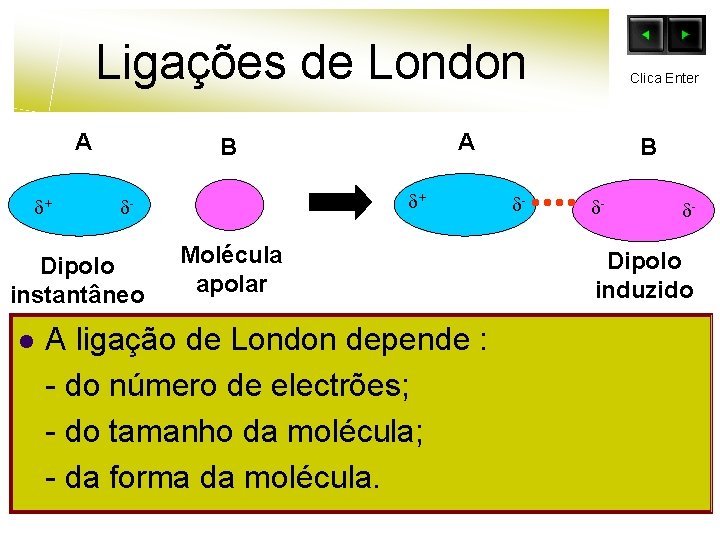
Ligações de London A + Dipolo instantâneo l A B + - Clica Enter Molécula apolar A ligação de London depende : - do número de electrões; - do tamanho da molécula; - da forma da molécula. B - - - Dipolo induzido

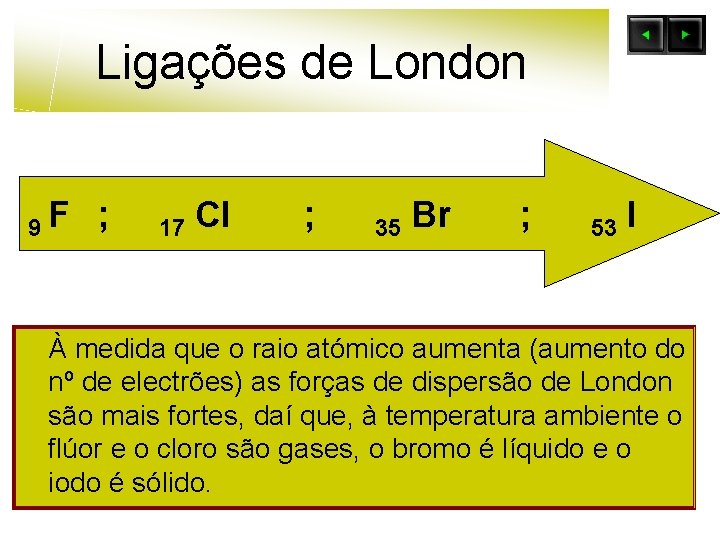
Ligações de London 9 F ; 17 Cl ; 35 Br ; 53 I À medida que o raio atómico aumenta (aumento do nº de electrões) as forças de dispersão de London são mais fortes, daí que, à temperatura ambiente o flúor e o cloro são gases, o bromo é líquido e o iodo é sólido.

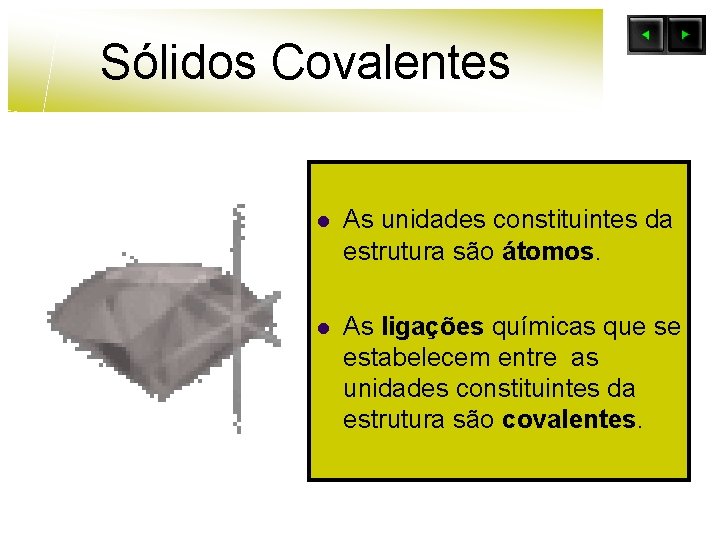
Sólidos Covalentes l As unidades constituintes da estrutura são átomos. l As ligações químicas que se estabelecem entre as unidades constituintes da estrutura são covalentes.

Sólidos Covalentes l Não conduzem a corrente eléctrica , com excepção da grafite. l Pontos de fusão e ebulição elevados. l Duros e quebradiços.

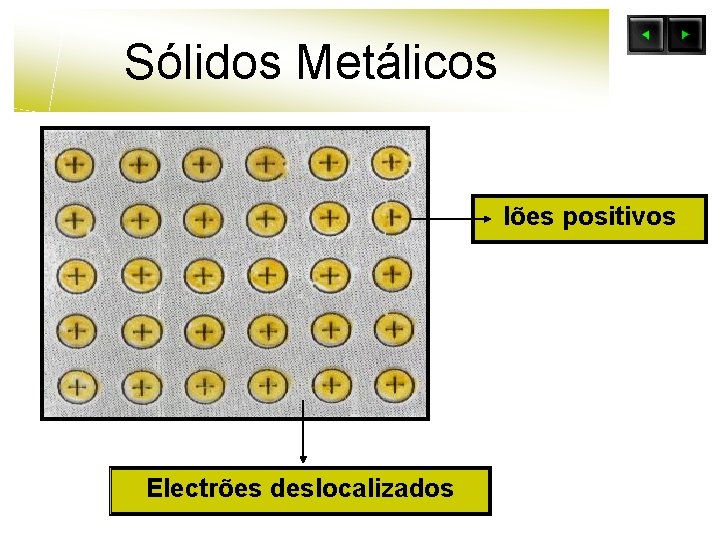
Sólidos Metálicos l As unidades constituintes da estrutura são iões positivos e electrões livres. l As ligações químicas que se estabelecem entre as unidades constituintes da estrutura são metálicas.

Sólidos Metálicos l As unidades que ocupam os pontos reticulares são os iões positivos. l Cada ião perde um mais electrões formando a nuvem electrónica que se espalha por todo o retículo. Este(s) electrão(ões) não estão ligados a qualquer átomo, mas estão deslocalizados sobre o cristal.

Sólidos Metálicos Iões positivos Electrões deslocalizados

As forças Intermoleculares Forças de van der Waals Forças intermoleculares Dipolo-dipolo (Forças de Keesom) Dipolo permanentedipolo induzido Existem entre Moléculas polares Forças de dispersão de London Todos os tipos de moléculas Moléculas polares com moléculas apolares Exemplos HCl ; CH 3 CH 2 OH HCl + N 2

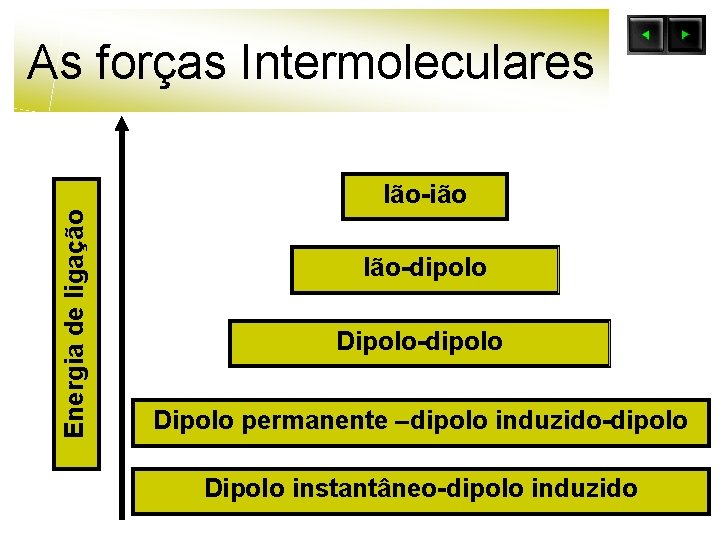
As forças Intermoleculares Energia de ligação Ião-ião Ião-dipolo Dipolo permanente –dipolo induzido-dipolo Dipolo instantâneo-dipolo induzido

Disponível em < pessoal. educacional. com. br/up/. . . /FORÇAS%20 I NTERMOLECULARES%20 -. ppt>