FORAS INTERMOLECULARES A natureza das foras que existem







- Slides: 10

FORÇAS INTERMOLECULARES A natureza das forças que existem entre as moléculas nos estados sólido e líquido e que explicam propriedades como a solubilidade de substâncias moleculares podem ser entendidas agora. Apesar de as moléculas serem constituídas por átomos, que não perdem nem ganham elétrons, em muitas há existência de dipolos elétricos permanentes e, como consequência, ocorrem interações elétricas entre elas.

Se tratando das moléculas apolares, explicando a atração entre tais moléculas quando as substâncias estão no estado sólido ou líquido, pois, afinal, se não houvesse interações entre as moléculas, tais substâncias só existiriam no estado gasoso, o que não é verdade. As forças intermoleculares podem ser de três tipos: interações dipolo permanente-dipolo permanente, ligação (ponte) de hidrogênio, dipolo instantâneo-dipolo induzido.

INTERAÇÕES DIPOLO-DIPOLO INDUZIDO ou FORÇA DE LONDON Moléculas apolares como as de I 2, quando próximas induzem a formação de dipolos instantâneos. Na verdade as forças de London se aplicam à todas as moléculas.

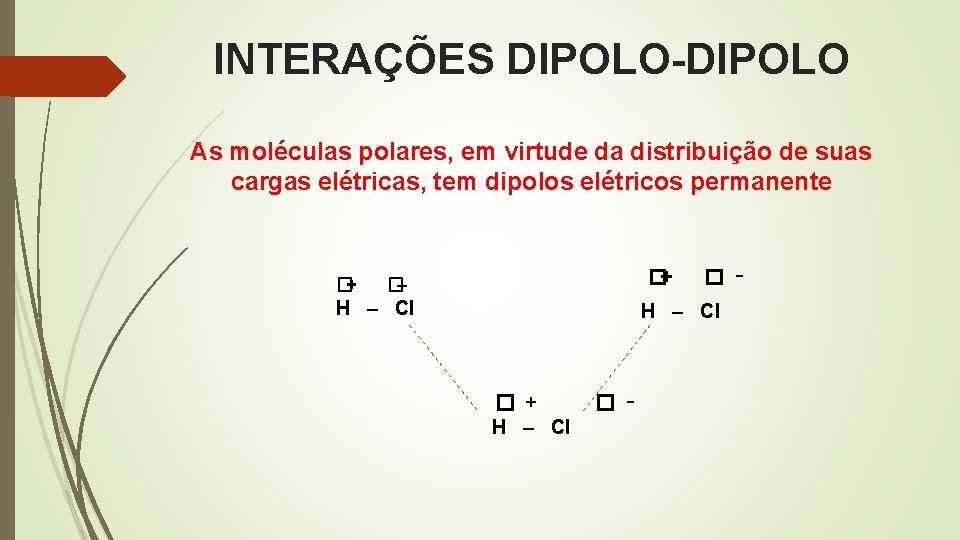
INTERAÇÕES DIPOLO-DIPOLO As moléculas polares, em virtude da distribuição de suas cargas elétricas, tem dipolos elétricos permanente �+ �+ �– H – Cl � + H – Cl � –

LIGAÇÕES DE HIDROGÊNIO As ligações de hidrogênio são forças de atração mais intensas que as de forças dipolo-dipolo e as de Van der Waals. Ocorre quando a molécula possui o hidrogênio ligado a um elemento bem eletronegativo, como o flúor, oxigênio ou nitrogênio. H – FON

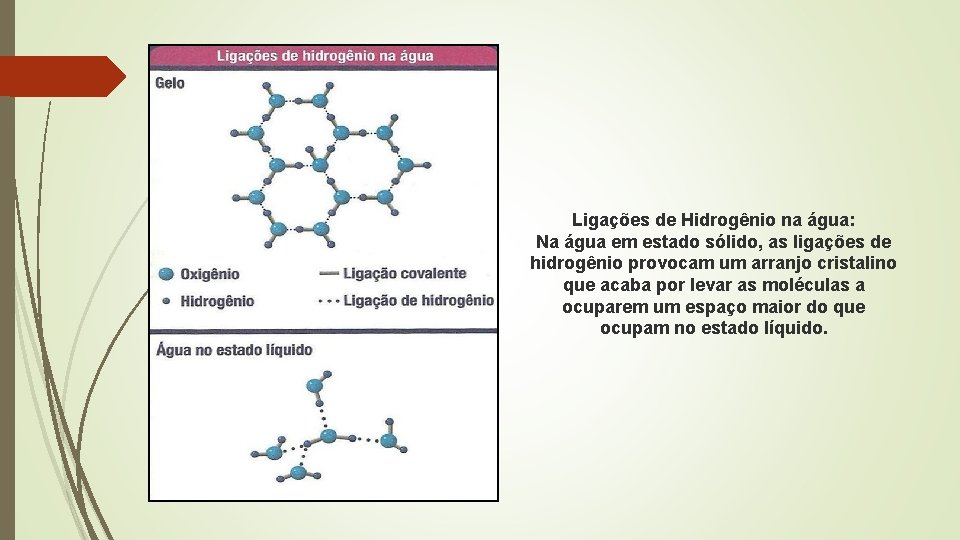
Ligações de Hidrogênio na água: Na água em estado sólido, as ligações de hidrogênio provocam um arranjo cristalino que acaba por levar as moléculas a ocuparem um espaço maior do que ocupam no estado líquido.

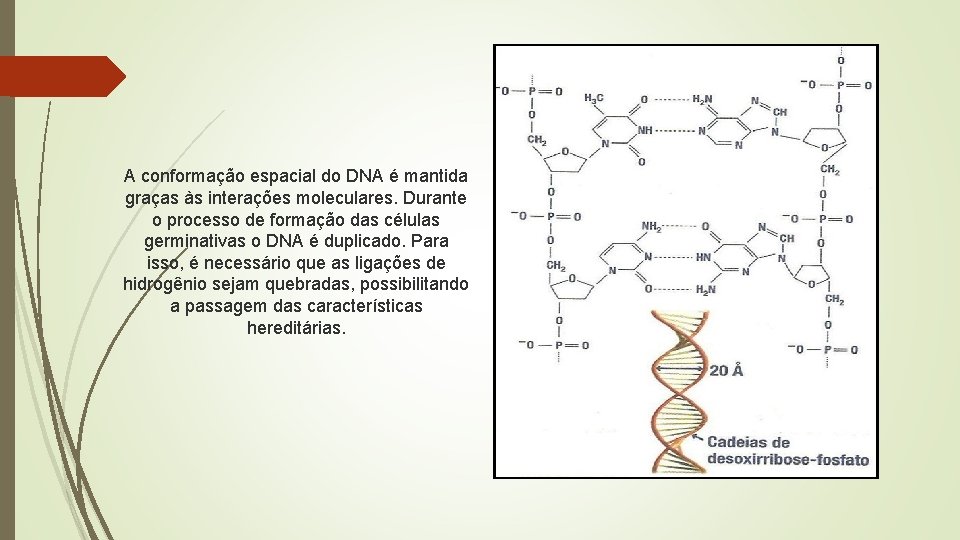
A conformação espacial do DNA é mantida graças às interações moleculares. Durante o processo de formação das células germinativas o DNA é duplicado. Para isso, é necessário que as ligações de hidrogênio sejam quebradas, possibilitando a passagem das características hereditárias.

INTENSIDADE DAS INTERAÇÕES dipolo induzido, dipolo permanente, ligação de hidrogênio

FORÇAS INTERMOLECULARES E O PONTO DE EBULIÇÃO Durante a passagem do estado líquido para o estado gasoso, de uma substância molecular, essas interações são rompidas Quanto maior a molécula dessa substância, maior a interação entre elas e é mais difícil separá-las. Logo, maior será o Ponto de Ebulição

E AGORA, VOCÊ SABERIA RESPONDER? 1. O que faz um molho de tomate aderir aos fios de um saboroso espaguete? 2. Por que as colam?