FORAS INTERMOLEC ULARES Foras Intermoleculares Aumento das foras


- Slides: 16

FORÇAS INTERMOLEC ULARES

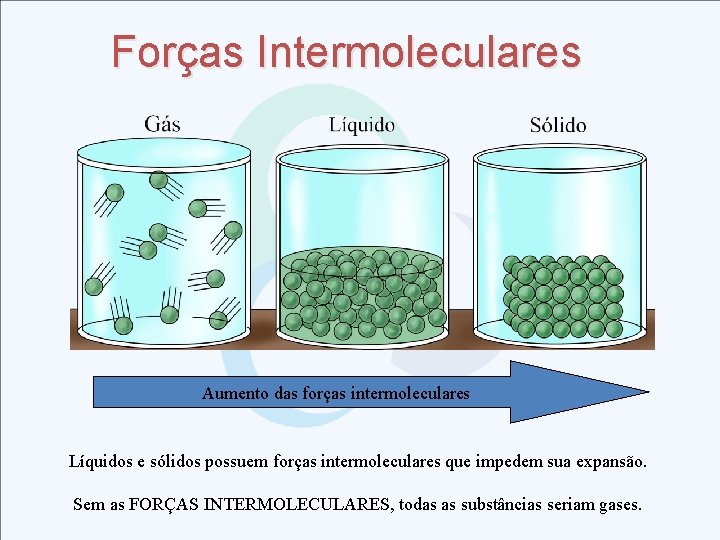
Forças Intermoleculares Aumento das forças intermoleculares Líquidos e sólidos possuem forças intermoleculares que impedem sua expansão. Sem as FORÇAS INTERMOLECULARES, todas as substâncias seriam gases.

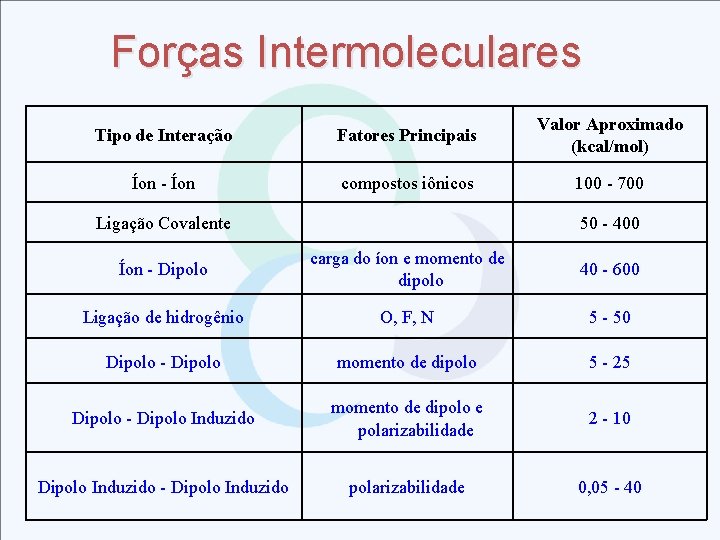
Forças Intermoleculares Tipo de Interação Fatores Principais Valor Aproximado (kcal/mol) Íon - Íon compostos iônicos 100 - 700 Ligação Covalente 50 - 400 Íon - Dipolo carga do íon e momento de dipolo 40 - 600 Ligação de hidrogênio O, F, N 5 - 50 Dipolo - Dipolo momento de dipolo 5 - 25 Dipolo - Dipolo Induzido momento de dipolo e polarizabilidade 2 - 10 Dipolo Induzido - Dipolo Induzido polarizabilidade 0, 05 - 40

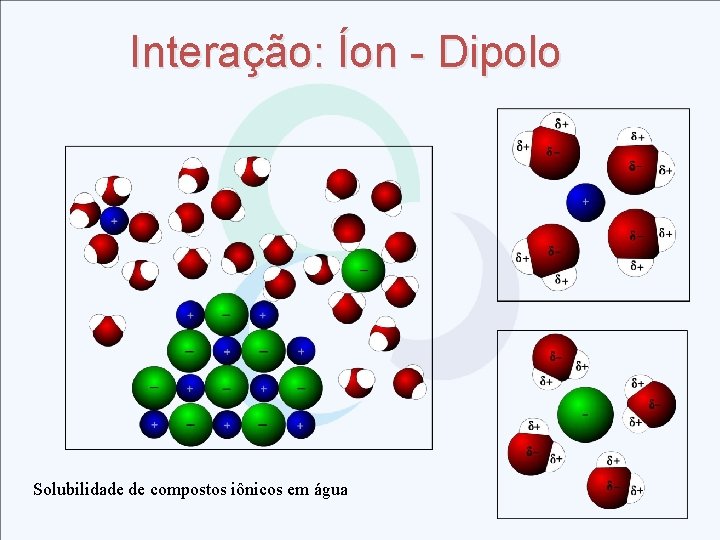
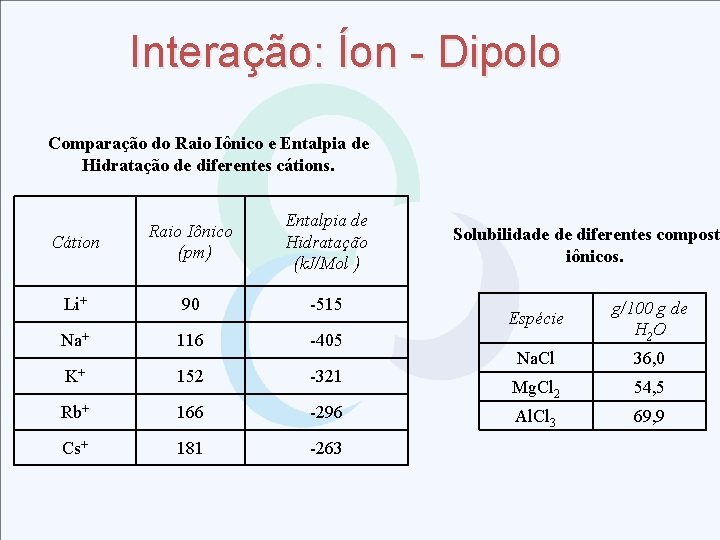
Interação: Íon - Dipolo Solubilidade de compostos iônicos em água

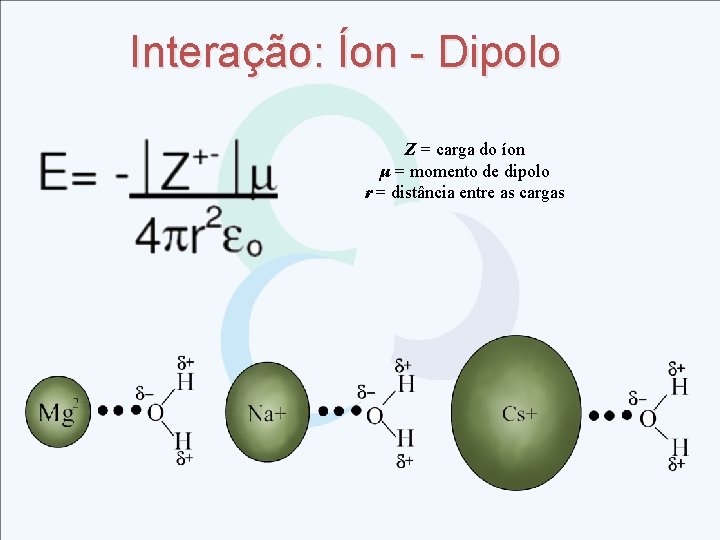
Interação: Íon - Dipolo Z = carga do íon μ = momento de dipolo r = distância entre as cargas

Interação: Íon - Dipolo Comparação do Raio Iônico e Entalpia de Hidratação de diferentes cátions. Cátion Raio Iônico (pm) Entalpia de Hidratação (k. J/Mol ) Li+ 90 -515 Na+ 116 -405 K+ 152 -321 Rb+ 166 -296 Cs+ 181 -263 Solubilidade de diferentes compost iônicos. Espécie g/100 g de H 2 O Na. Cl 36, 0 Mg. Cl 2 54, 5 Al. Cl 3 69, 9

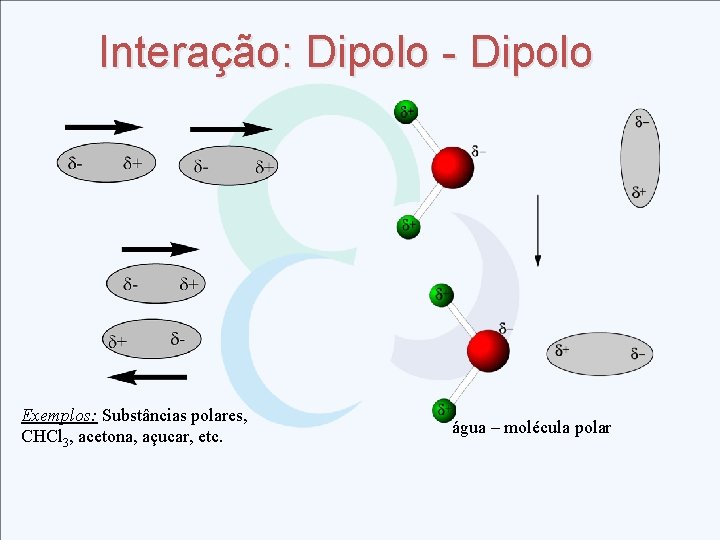
Interação: Dipolo - Dipolo Exemplos: Substâncias polares, CHCl 3, acetona, açucar, etc. água – molécula polar

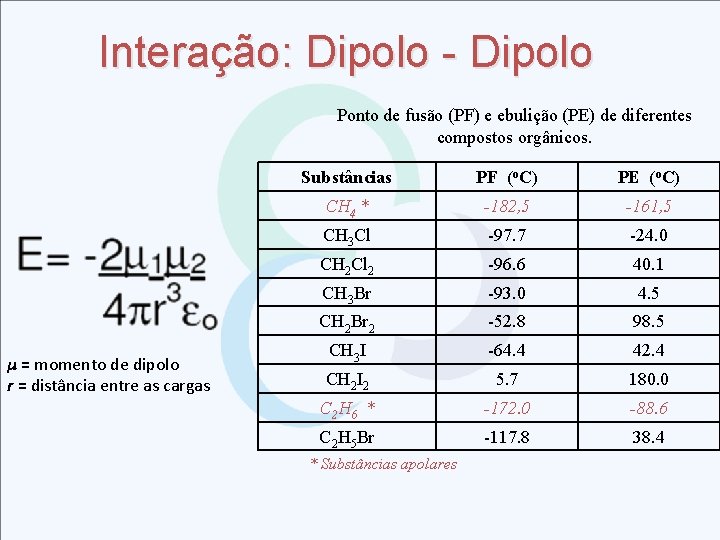
Interação: Dipolo - Dipolo Ponto de fusão (PF) e ebulição (PE) de diferentes compostos orgânicos. μ = momento de dipolo r = distância entre as cargas Substâncias PF (o. C) PE (o. C) CH 4 * -182, 5 -161, 5 CH 3 Cl -97. 7 -24. 0 CH 2 Cl 2 -96. 6 40. 1 CH 3 Br -93. 0 4. 5 CH 2 Br 2 -52. 8 98. 5 CH 3 I -64. 4 42. 4 CH 2 I 2 5. 7 180. 0 C 2 H 6 * -172. 0 -88. 6 C 2 H 5 Br -117. 8 38. 4 * Substâncias apolares

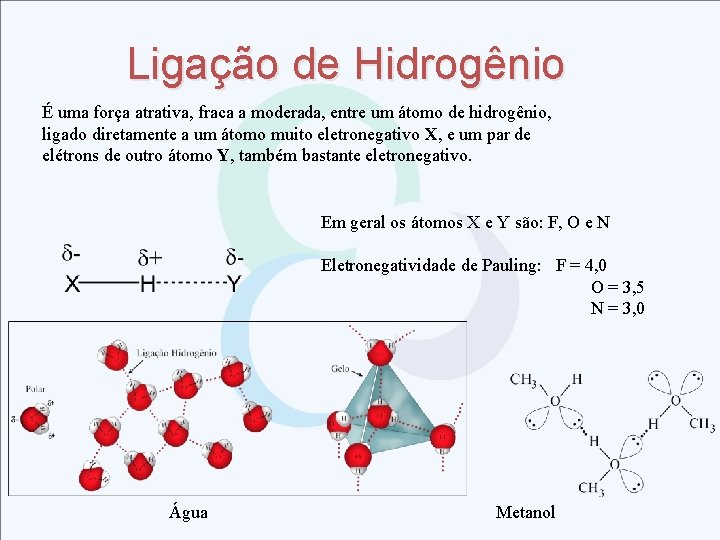
Ligação de Hidrogênio É uma força atrativa, fraca a moderada, entre um átomo de hidrogênio, ligado diretamente a um átomo muito eletronegativo X, e um par de elétrons de outro átomo Y, também bastante eletronegativo. Em geral os átomos X e Y são: F, O e N Eletronegatividade de Pauling: F = 4, 0 O = 3, 5 N = 3, 0 Água Metanol

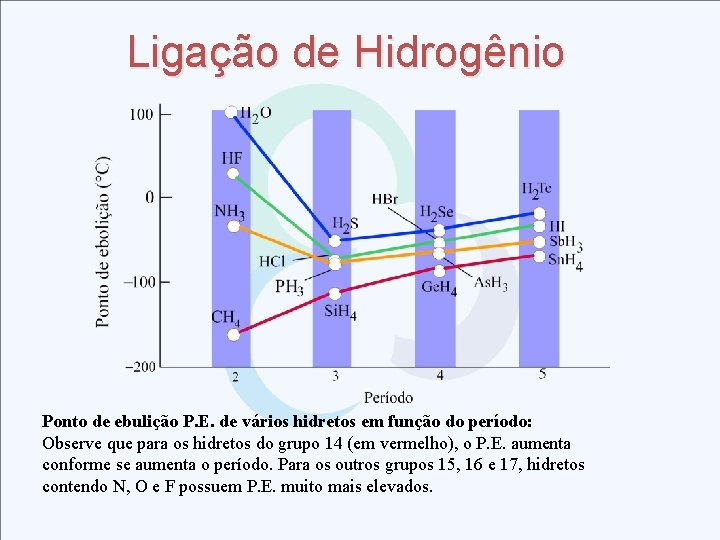
Ligação de Hidrogênio Ponto de ebulição P. E. de vários hidretos em função do período: Observe que para os hidretos do grupo 14 (em vermelho), o P. E. aumenta conforme se aumenta o período. Para os outros grupos 15, 16 e 17, hidretos contendo N, O e F possuem P. E. muito mais elevados.

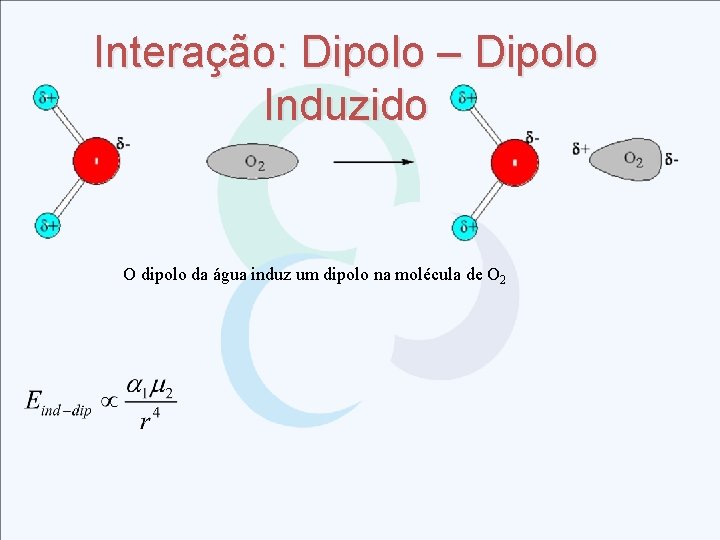
Interação: Dipolo – Dipolo Induzido O dipolo da água induz um dipolo na molécula de O 2

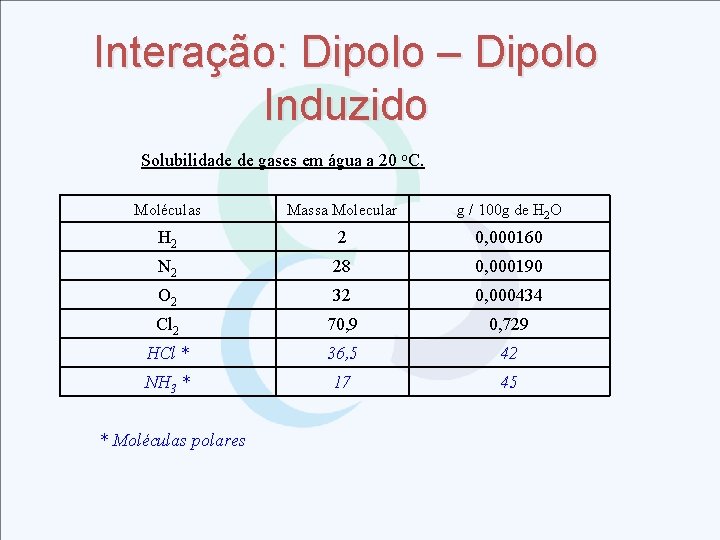
Interação: Dipolo – Dipolo Induzido Solubilidade de gases em água a 20 o. C. Moléculas Massa Molecular g / 100 g de H 2 O H 2 2 0, 000160 N 2 28 0, 000190 O 2 32 0, 000434 Cl 2 70, 9 0, 729 HCl * 36, 5 42 NH 3 * 17 45 * Moléculas polares

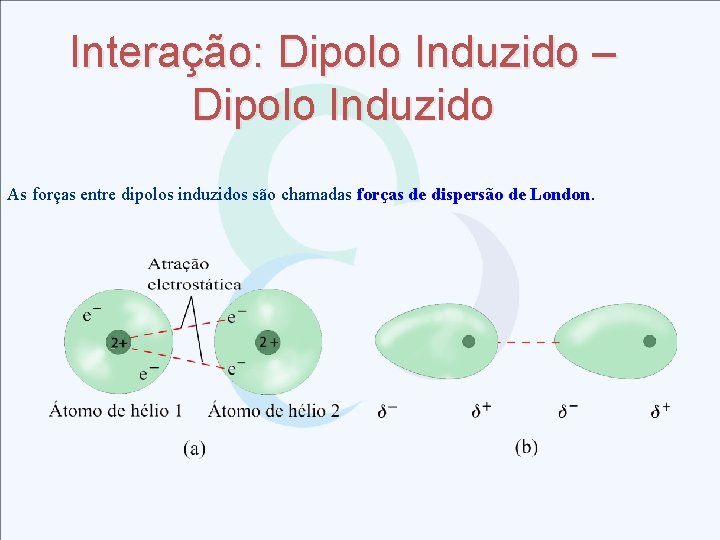
Interação: Dipolo Induzido – Dipolo Induzido As forças entre dipolos induzidos são chamadas forças de dispersão de London.

Interação: Dipolo Induzido – Dipolo Induzido Ponto de fusão e ebulição de algumas moléculas diatômicas homonucleares. Ponto de Fusão (o. C Ponto de Ebulição (o. C ) ) Espécies Massa Molecular H 2 2 -259 -253 N 2 28 -210 -196 O 2 32 -218 -183 F 2 38 -220 -188 Cl 2 71 -101 -34 Br 2 160 -7 59 I 2 254 114 184

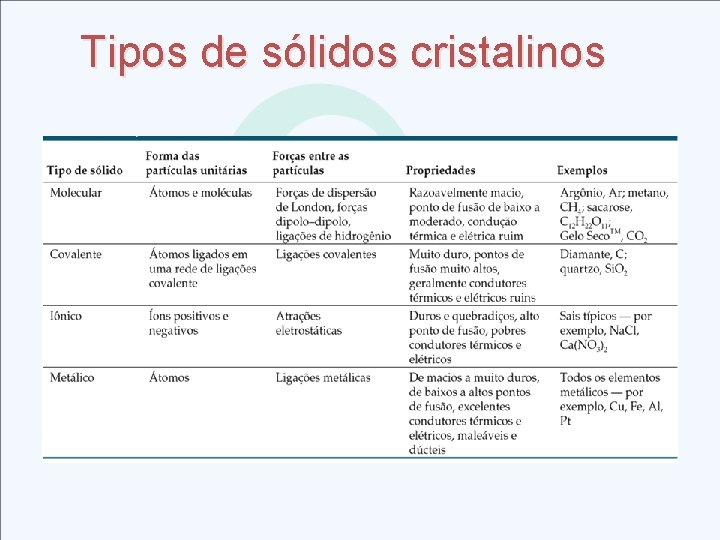
Tipos de sólidos cristalinos

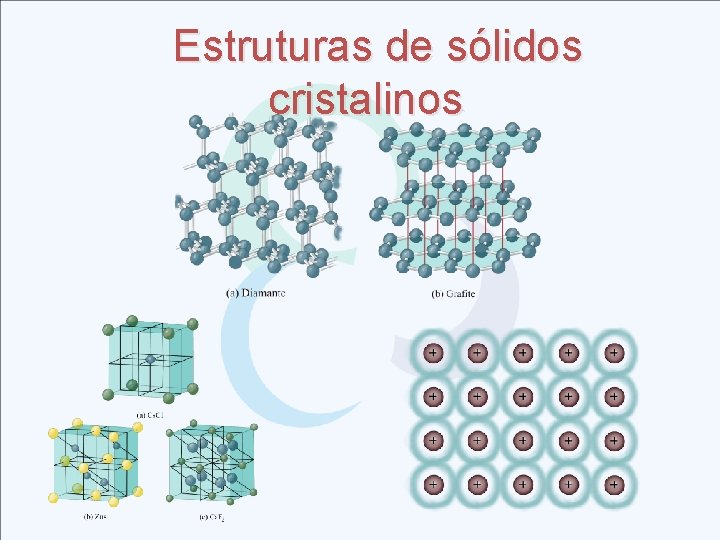
Estruturas de sólidos cristalinos