Alteraes Genmicas Raras em Cncer de Pulmo de















- Slides: 46

Alterações Genômicas Raras em Câncer de Pulmão de Células Não Pequenas Antonio C. Buzaid, MD General Medical Director Centro Oncológico Antonio Ermírio de Moraes Beneficência Portuguesa de São Paulo Member of the Steering Committee Centro Oncológico Dayan-Daycoval Hospital Israelita Albert Einstein

Declaração de Conflitos de Interesse De acordo com a Norma 1595/2000 do Conselho Federal de Medicina e com a RDC 96/2008 da ANVISA, declaro que: • Pesquisa Clínica: BMS, MSD, Roche, Pfizer, Astra. Zeneca, Novartis, Boehringer-Ingelheim. • Palestrante: Roche, Pfizer, MSD, BMS, Astra. Zeneca, Boehringer-Ingelheim, Sanofi, Eisai • Advisory Boards: BMS, MSD, Roche, Astra. Zeneca, Pfizer, Novartis, Boehringer-Ingelheim, Eusai, Blau.

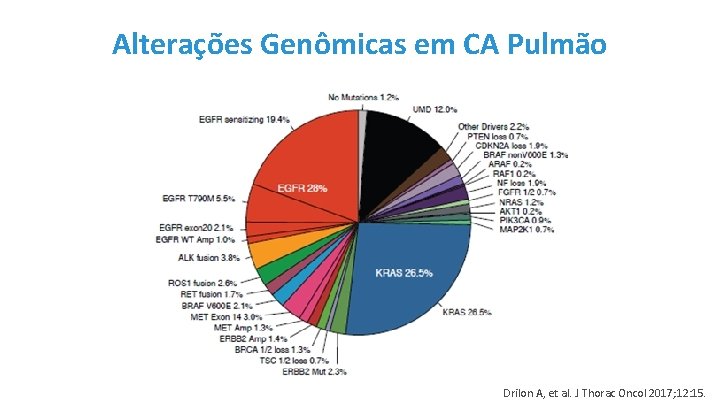
Alterações Genômicas em CA Pulmão Drilon A, et al. J Thorac Oncol 2017; 12: 15.

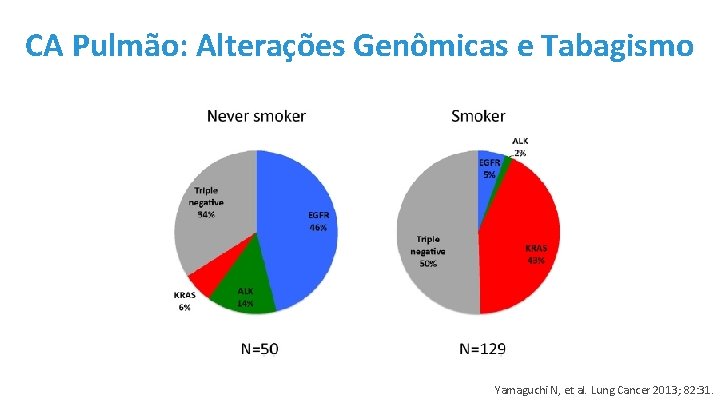
CA Pulmão: Alterações Genômicas e Tabagismo Yamaguchi N, et al. Lung Cancer 2013; 82: 31.

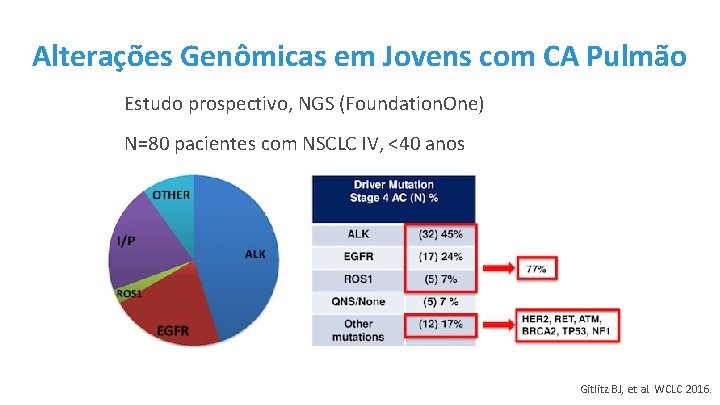
Alterações Genômicas em Jovens com CA Pulmão Estudo prospectivo, NGS (Foundation. One) N=80 pacientes com NSCLC IV, <40 anos Gitlitz BJ, et al. WCLC 2016.

ROS 1 RET BRAF MET TRK HER-2

Traslocação de ROS 1

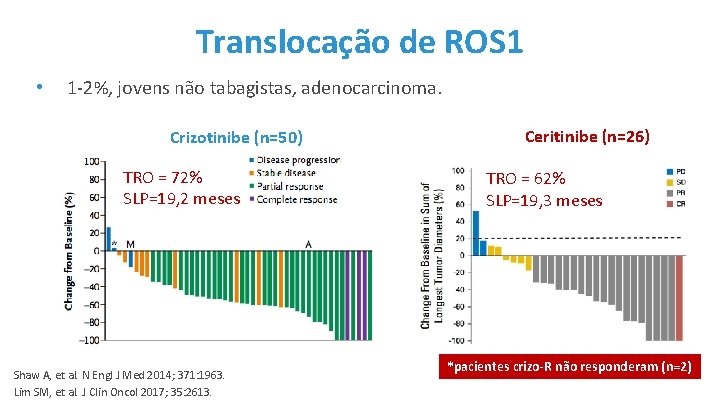
Translocação de ROS 1 • 1 -2%, jovens não tabagistas, adenocarcinoma. Crizotinibe (n=50) TRO = 72% SLP=19, 2 meses Shaw A, et al. N Engl J Med 2014; 371: 1963. Lim SM, et al. J Clin Oncol 2017; 35: 2613. Ceritinibe (n=26) TRO = 62% SLP=19, 3 meses *pacientes crizo-R não responderam (n=2)

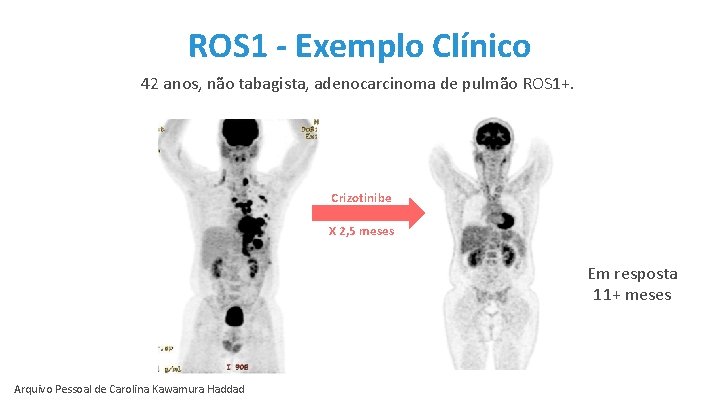
ROS 1 - Exemplo Clínico 42 anos, não tabagista, adenocarcinoma de pulmão ROS 1+. Crizotinibe X 2, 5 meses Em resposta 11+ meses Arquivo Pessoal de Carolina Kawamura Haddad

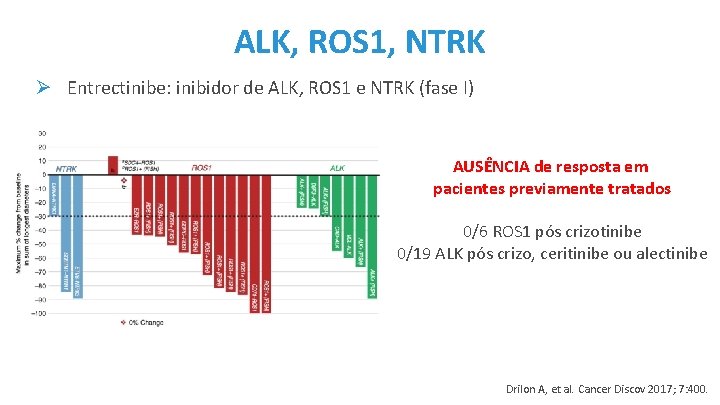
ALK, ROS 1, NTRK Ø Entrectinibe: inibidor de ALK, ROS 1 e NTRK (fase I) AUSÊNCIA de resposta em pacientes previamente tratados 0/6 ROS 1 pós crizotinibe 0/19 ALK pós crizo, ceritinibe ou alectinibe Drilon A, et al. Cancer Discov 2017; 7: 400.

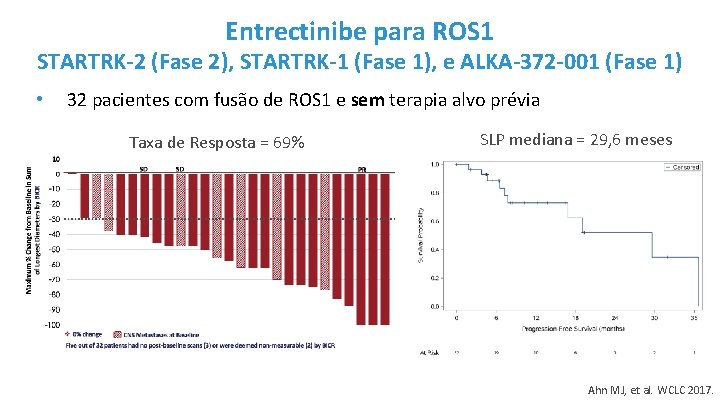
Entrectinibe para ROS 1 STARTRK-2 (Fase 2), STARTRK-1 (Fase 1), e ALKA-372 -001 (Fase 1) • 32 pacientes com fusão de ROS 1 e sem terapia alvo prévia Taxa de Resposta = 69% SLP mediana = 29, 6 meses Ahn MJ, et al. WCLC 2017.

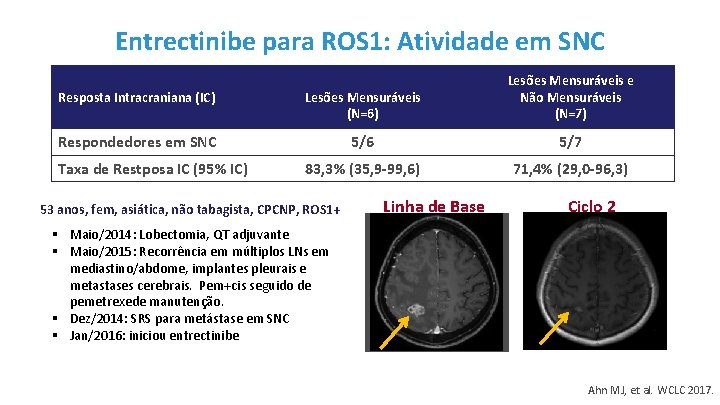
Entrectinibe para ROS 1: Atividade em SNC Resposta Intracraniana (IC) Lesões Mensuráveis (N=6) Lesões Mensuráveis e Não Mensuráveis (N=7) Respondedores em SNC 5/6 5/7 83, 3% (35, 9 -99, 6) 71, 4% (29, 0 -96, 3) Taxa de Restposa IC (95% IC) 53 anos, fem, asiática, não tabagista, CPCNP, ROS 1+ Linha de Base Ciclo 2 § Maio/2014: Lobectomia, QT adjuvante § Maio/2015: Recorrência em múltiplos LNs em mediastino/abdome, implantes pleurais e metastases cerebrais. Pem+cis seguido de pemetrexede manutenção. § Dez/2014: SRS para metástase em SNC § Jan/2016: iniciou entrectinibe Ahn MJ, et al. WCLC 2017.

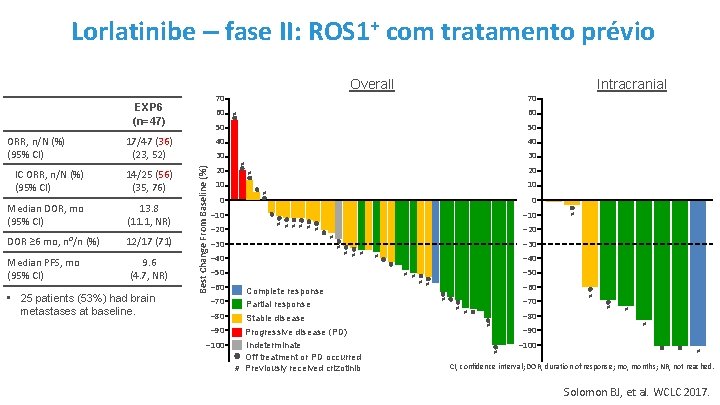
Lorlatinibe – fase II: ROS 1+ com tratamento prévio Overall 70 EXP 6 (n=47) 60 60 # 50 50 17/47 (36) (23, 52) 40 40 IC ORR, n/N (%) (95% CI) 14/25 (56) (35, 76) 20 Median DOR, mo (95% CI) 13. 8 (11. 1, NR) DOR ≥ 6 mo, n⁰/n (%) 12/17 (71) Median PFS, mo (95% CI) 9. 6 (4. 7, NR) • 25 patients (53%) had brain metastases at baseline. 30 Best Change From Baseline (%) ORR, n/N (%) (95% CI) 30 # 20 # 10 10 0 # 0 ‒ 10 ‒ 20 ‒ 10 # # # # ‒ 40 # # # ‒ 50 Complete response Partial response ‒ 80 Stable disease ‒ 90 ‒ 100 ‒ 30 ‒ 40 # # # ‒ 70 # ‒ 20 # ‒ 30 ‒ 60 Intracranial 70 Progressive disease (PD) Indeterminate Off treatment or PD occurred # Previously received crizotinib ‒ 50 # # ‒ 60 ‒ 70 # # # ‒ 80 # ‒ 90 # ‒ 100 # # # CI, confidence interval; DOR, duration of response; mo, months; NR, not reached. Solomon BJ, et al. WCLC 2017.

Mutação de BRAF V 600 E

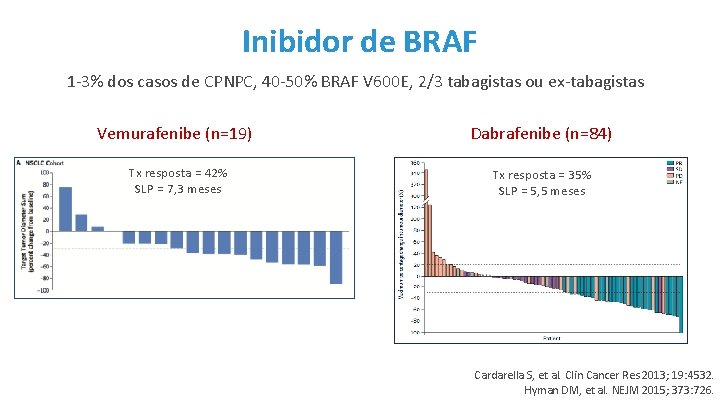
Inibidor de BRAF 1 -3% dos casos de CPNPC, 40 -50% BRAF V 600 E, 2/3 tabagistas ou ex-tabagistas Vemurafenibe (n=19) Dabrafenibe (n=84) Tx resposta = 42% SLP = 7, 3 meses Tx resposta = 35% SLP = 5, 5 meses Cardarella S, et al. Clin Cancer Res 2013; 19: 4532. Hyman DM, et al. NEJM 2015; 373: 726.

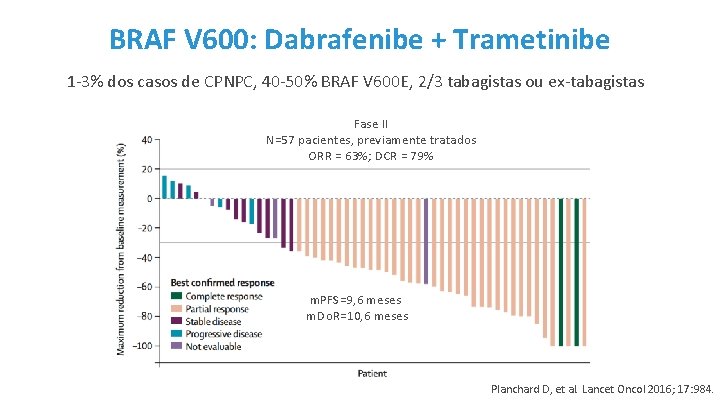
BRAF V 600: Dabrafenibe + Trametinibe 1 -3% dos casos de CPNPC, 40 -50% BRAF V 600 E, 2/3 tabagistas ou ex-tabagistas Fase II N=57 pacientes, previamente tratados ORR = 63%; DCR = 79% m. PFS=9, 6 meses m. Do. R=10, 6 meses Planchard D, et al. Lancet Oncol 2016; 17: 984.

MET

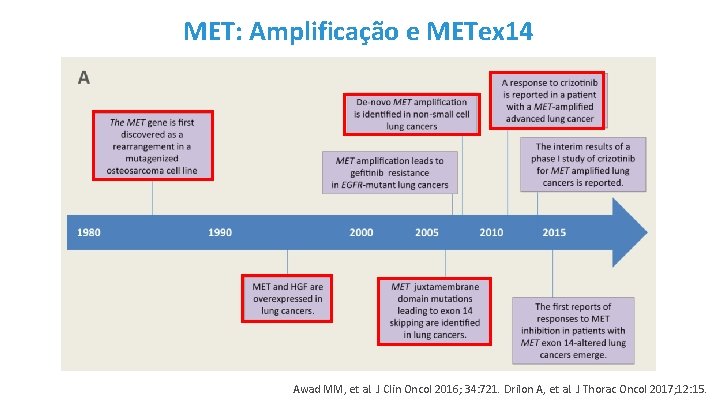
MET: Amplificação e METex 14 Awad MM, et al. J Clin Oncol 2016; 34: 721. Drilon A, et al. J Thorac Oncol 2017; 12: 15.

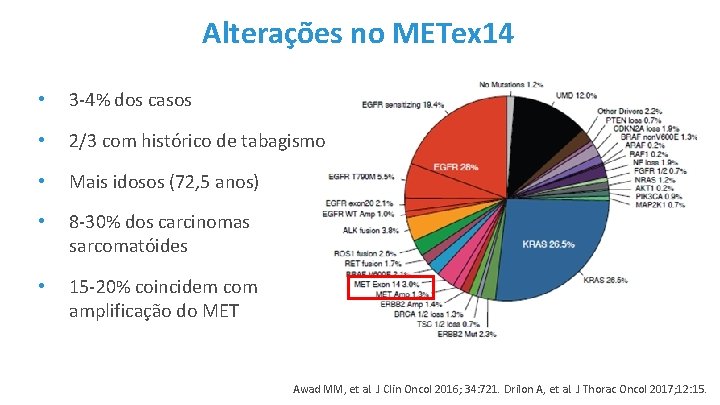
Alterações no METex 14 • 3 -4% dos casos • 2/3 com histórico de tabagismo • Mais idosos (72, 5 anos) • 8 -30% dos carcinomas sarcomatóides • 15 -20% coincidem com amplificação do MET Awad MM, et al. J Clin Oncol 2016; 34: 721. Drilon A, et al. J Thorac Oncol 2017; 12: 15.

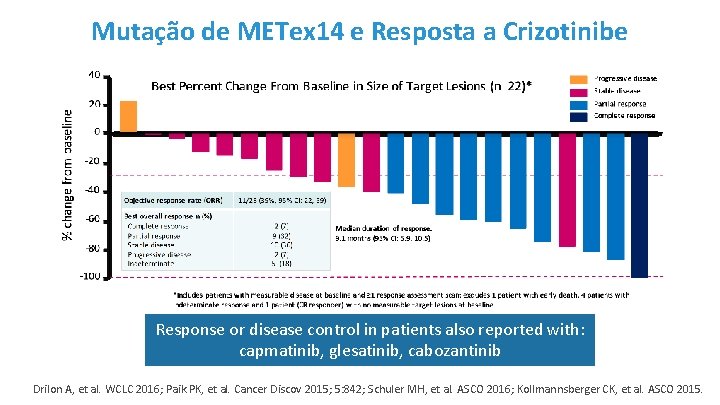
Mutação de METex 14 e Resposta a Crizotinibe Response or disease control in patients also reported with: capmatinib, glesatinib, cabozantinib Drilon A, et al. WCLC 2016; Paik PK, et al. Cancer Discov 2015; 5: 842; Schuler MH, et al. ASCO 2016; Kollmannsberger CK, et al. ASCO 2015.

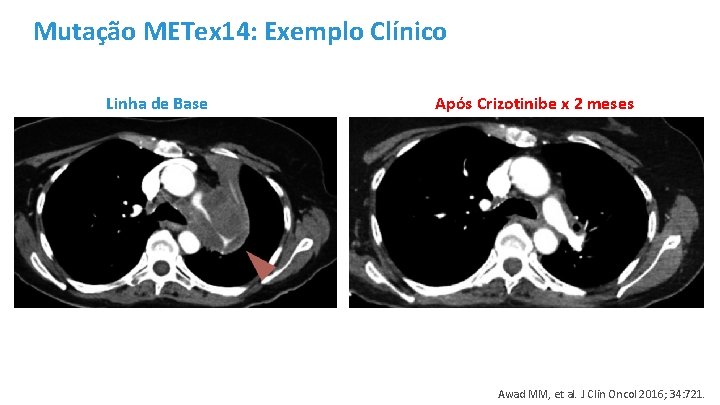
Mutação METex 14: Exemplo Clínico Linha de Base Após Crizotinibe x 2 meses Awad MM, et al. J Clin Oncol 2016; 34: 721.

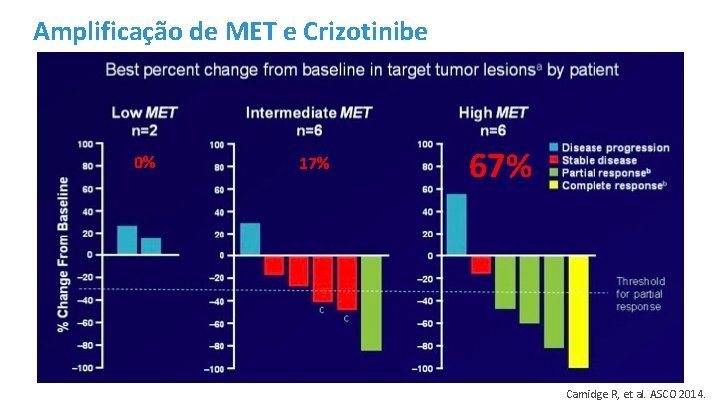
Amplificação de MET e Crizotinibe 0% 17% 67% Camidge R, et al. ASCO 2014.

Fusão de RET

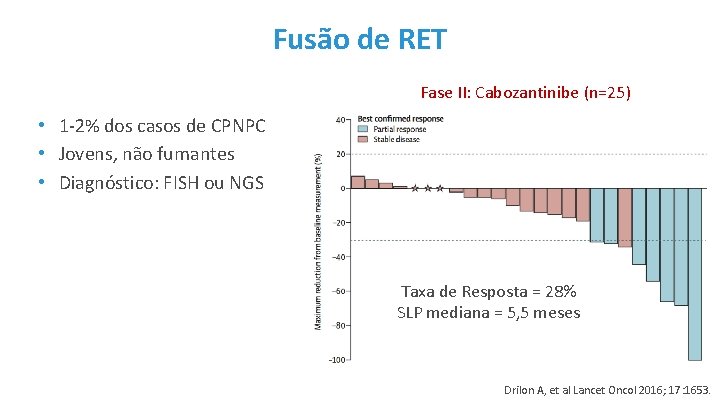
Fusão de RET Fase II: Cabozantinibe (n=25) • 1 -2% dos casos de CPNPC • Jovens, não fumantes • Diagnóstico: FISH ou NGS Taxa de Resposta = 28% SLP mediana = 5, 5 meses Drilon A, et al Lancet Oncol 2016; 17: 1653.

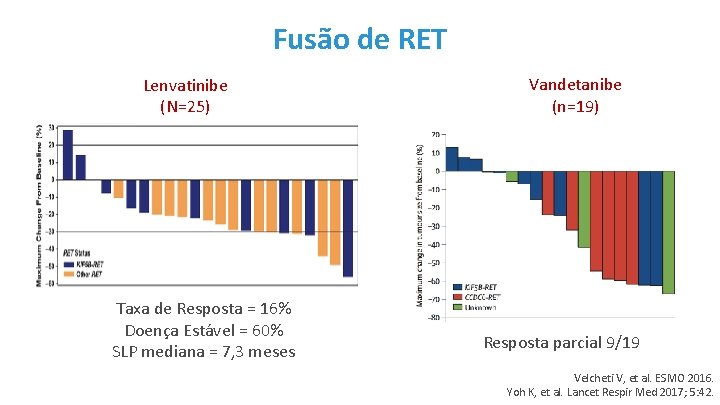
Fusão de RET Lenvatinibe (N=25) Taxa de Resposta = 16% Doença Estável = 60% SLP mediana = 7, 3 meses Vandetanibe (n=19) Resposta parcial 9/19 Velcheti V, et al. ESMO 2016. Yoh K, et al. Lancet Respir Med 2017; 5: 42.

RET: Vandetanibe + Everolimo 5/6 PR 1 SD (24% decrease) Significant CNS activity 3/3 PR (100%) Cascone T, et al. ASCO 2016.

Programa de Uso Compassivo: n=4 pacientes RET+ tratados com Alectinibe *3 pacientes previamente tratados com inibidores de RET (cabozantinibe) 2/4 respostas parciais (6 meses e 5+ meses) 1/4 doença estável (6+ semanas) Lin JJ, et al. J Thorac Oncol 2016; 11: 2027.

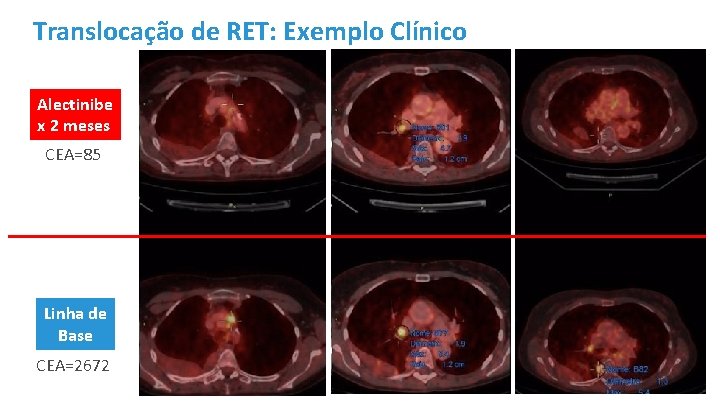
Translocação de RET: Exemplo Clínico 67 anos, feminino, não tabagista, CEA=135 (solicitado pelo Ginecologista). 2007: cirurgia (adenocarcinoma de pulmão, p. T 1 N 0) 2010: recorrência mediastinal e supraclavicular (quimiorradioterapia) 2015: PD linfonodal e aumento do CEA. Foundation One: translocação de RET. 10/2015 a 04/2016 – Cabozantinibe (Sd. mão-pé, rash cutâneo) 05/2016 a 06/2016 – Carboplatina/Pemetrexede, Bevacizumabe (má tolerância) Cortesia: Dr. Antonio C. Buzaid

Translocação de RET: Exemplo Clínico Alectinibe x 2 meses CEA=85 Linha de Base CEA=2672

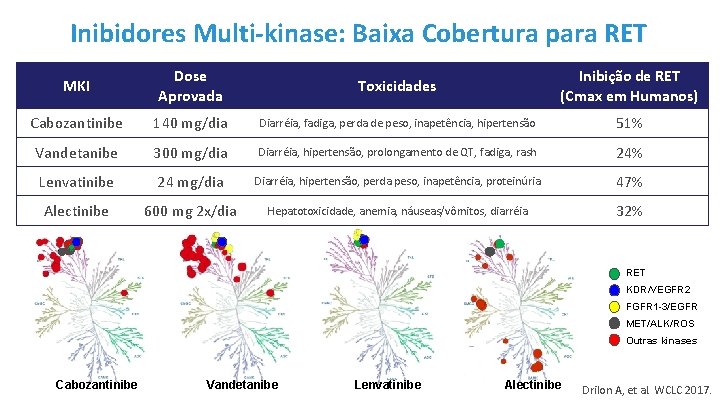
Inibidores Multi-kinase: Baixa Cobertura para RET MKI Dose Aprovada Toxicidades Inibição de RET (Cmax em Humanos) Cabozantinibe 140 mg/dia Diarréia, fadiga, perda de peso, inapetência, hipertensão 51% Vandetanibe 300 mg/dia Diarréia, hipertensão, prolongamento de QT, fadiga, rash 24% Lenvatinibe 24 mg/dia Diarréia, hipertensão, perda peso, inapetência, proteinúria 47% Alectinibe 600 mg 2 x/dia Hepatotoxicidade, anemia, náuseas/vômitos, diarréia 32% RET KDR/VEGFR 2 FGFR 1 -3/EGFR MET/ALK/ROS Outras kinases Cabozantinibe Vandetanibe Lenvatinibe Alectinibe Drilon A, et al. WCLC 2017.

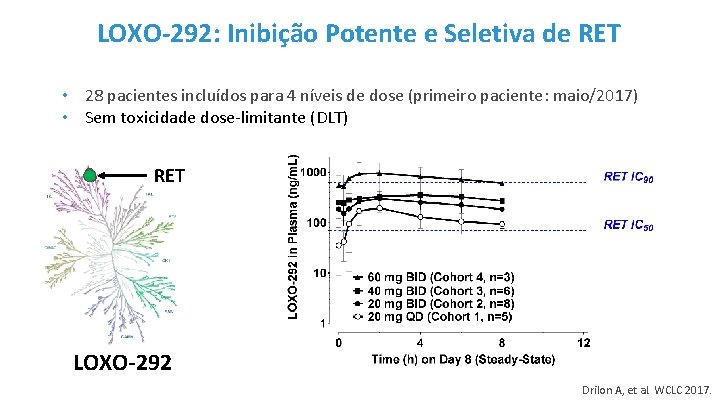
LOXO-292: Inibição Potente e Seletiva de RET • 28 pacientes incluídos para 4 níveis de dose (primeiro paciente: maio/2017) • Sem toxicidade dose-limitante (DLT) RET LOXO-292 Drilon A, et al. WCLC 2017.

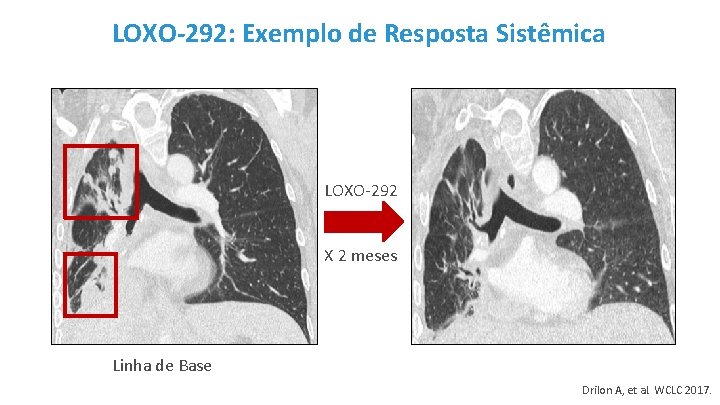
LOXO-292: Exemplo de Resposta Sistêmica LOXO-292 X 2 meses Linha de Base Drilon A, et al. WCLC 2017.

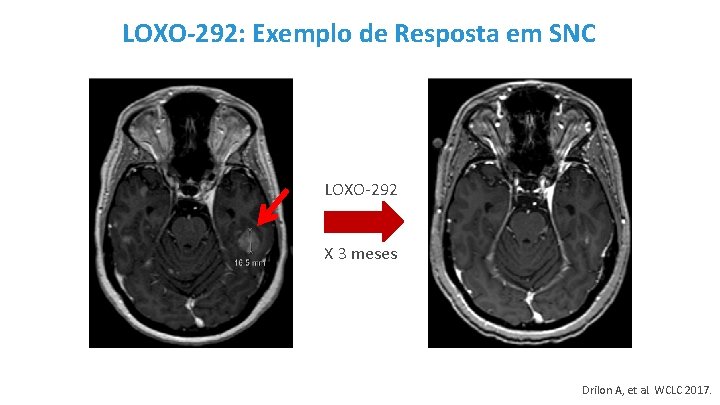
LOXO-292: Exemplo de Resposta em SNC LOXO-292 X 3 meses Drilon A, et al. WCLC 2017.

Mutação de HER 2

Mutação de HER 2 • 2 -4% dos casos de CPCNP • Mulheres, não tabagistas. • Inserção in-frame no éxon 20. • Amplificação e hiperexpressão não coincidem com mutação. • Relatos de caso com benefício: trastuzumabe, TDM-1, afatinibe, dacomitinibe, neratinibe +/- tensirolimo. • Relatos de não benefício: lapatinibe. Mazières J, et al. J Clin Oncol 2013; 31: 1997; Tomizawa K, et al. Lung Cancer 2011; 74: 139; Ross HJ, et al. Clin Cancer Res 2010; 16: 1938; Gandhi L, et al. J Clin Oncol 2014; 32: 68; Kris MG, et al. WCLC 2013.

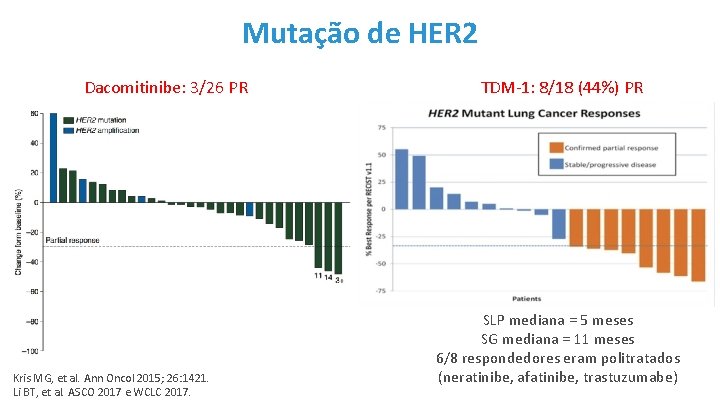
Mutação de HER 2 Dacomitinibe: 3/26 PR Kris MG, et al. Ann Oncol 2015; 26: 1421. Li BT, et al. ASCO 2017 e WCLC 2017. TDM-1: 8/18 (44%) PR SLP mediana = 5 meses SG mediana = 11 meses 6/8 respondedores eram politratados (neratinibe, afatinibe, trastuzumabe)

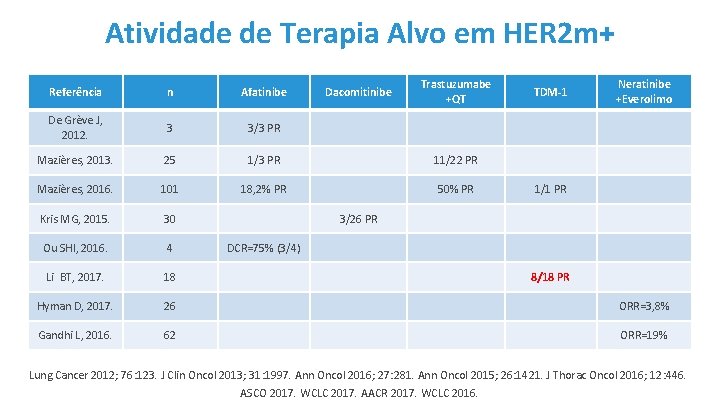
Atividade de Terapia Alvo em HER 2 m+ Dacomitinibe Trastuzumabe +QT TDM-1 Neratinibe +Everolimo Referência n Afatinibe De Grève J, 2012. 3 3/3 PR Mazières, 2013. 25 1/3 PR 11/22 PR Mazières, 2016. 101 18, 2% PR 50% PR Kris MG, 2015. 30 Ou SHI, 2016. 4 Li BT, 2017. 18 Hyman D, 2017. 26 ORR=3, 8% Gandhi L, 2016. 62 ORR=19% 1/1 PR 3/26 PR DCR=75% (3/4) 8/18 PR Lung Cancer 2012; 76: 123. J Clin Oncol 2013; 31: 1997. Ann Oncol 2016; 27: 281. Ann Oncol 2015; 26: 1421. J Thorac Oncol 2016; 12: 446. ASCO 2017. WCLC 2017. AACR 2017. WCLC 2016.

Fusão de NTRK

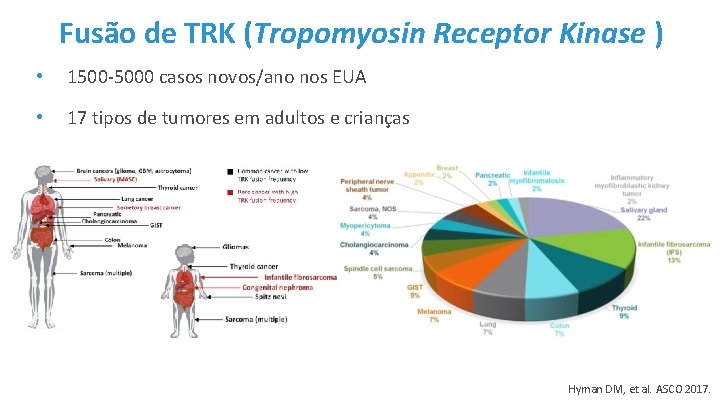
Fusão de TRK (Tropomyosin Receptor Kinase ) • 1500 -5000 casos novos/ano nos EUA • 17 tipos de tumores em adultos e crianças Hyman DM, et al. ASCO 2017.

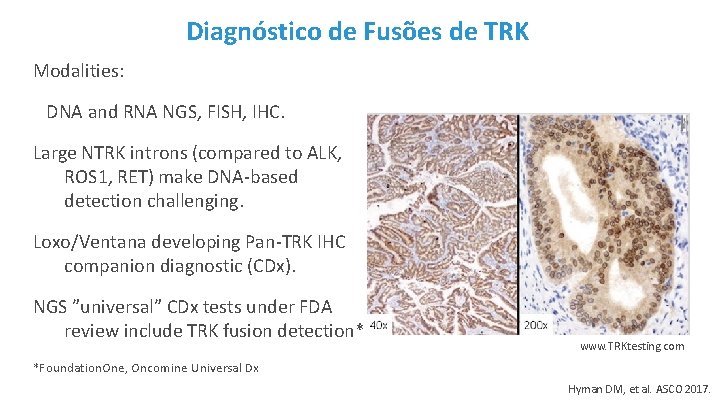
Diagnóstico de Fusões de TRK Modalities: DNA and RNA NGS, FISH, IHC. Large NTRK introns (compared to ALK, ROS 1, RET) make DNA-based detection challenging. Loxo/Ventana developing Pan-TRK IHC companion diagnostic (CDx). NGS ”universal” CDx tests under FDA review include TRK fusion detection* www. TRKtesting. com *Foundation. One, Oncomine Universal Dx Hyman DM, et al. ASCO 2017.

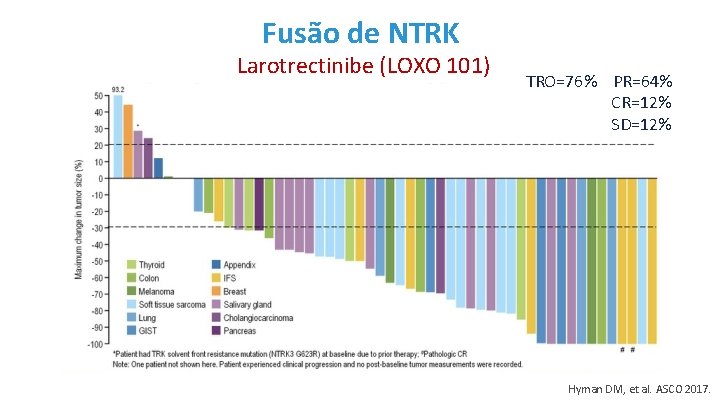
Fusão de NTRK Larotrectinibe (LOXO 101) TRO=76% PR=64% CR=12% SD=12% Hyman DM, et al. ASCO 2017.

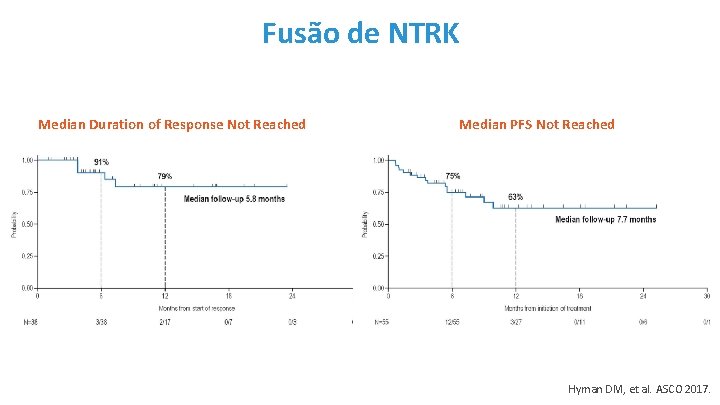
Fusão de NTRK Median Duration of Response Not Reached Median PFS Not Reached Hyman DM, et al. ASCO 2017.

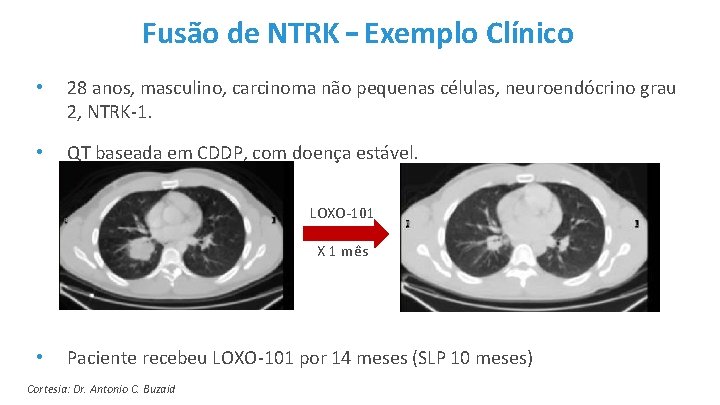
Fusão de NTRK – Exemplo Clínico • 28 anos, masculino, carcinoma não pequenas células, neuroendócrino grau 2, NTRK-1. • QT baseada em CDDP, com doença estável. LOXO-101 X 1 mês • Paciente recebeu LOXO-101 por 14 meses (SLP 10 meses) Cortesia: Dr. Antonio C. Buzaid

Take Home Message

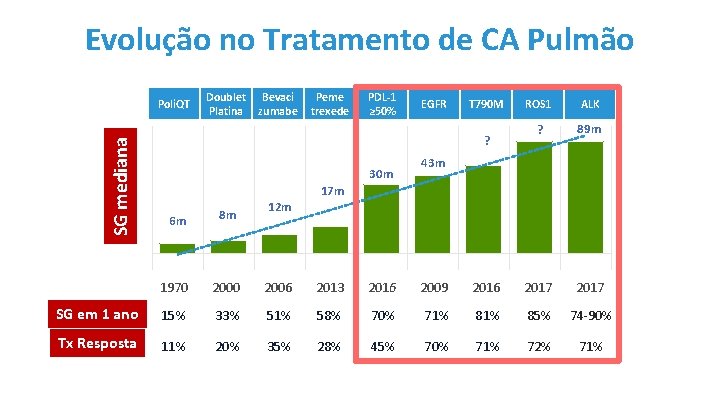
Evolução no Tratamento de CA Pulmão Bevaci zumabe Peme trexede PDL-1 ≥ 50% EGFR T 790 M ROS 1 ALK ? 89 m 30 m 2009 2016 2017 1 L- 0 M T 7 9 K FR 2016 RO S 1 re et m Pe EG e xe d e ab um 2013 2017 SG em 1 ano ub Be va e td 2006 Do le ciz 2000 Pl Po 1970 at in li. Q a T 6 m 17 m 12 m 8 m 43 m AL SG mediana ? PD Doublet Platina Poli. QT 15% 33% 51% 58% 70% 71% 85% 74 -90% Tx Resposta 11% 20% 35% 28% 45% 70% 71% 72% 71%

Thank you