Acidul hidroxipropionic acid lactic cel mai important acid










- Slides: 25

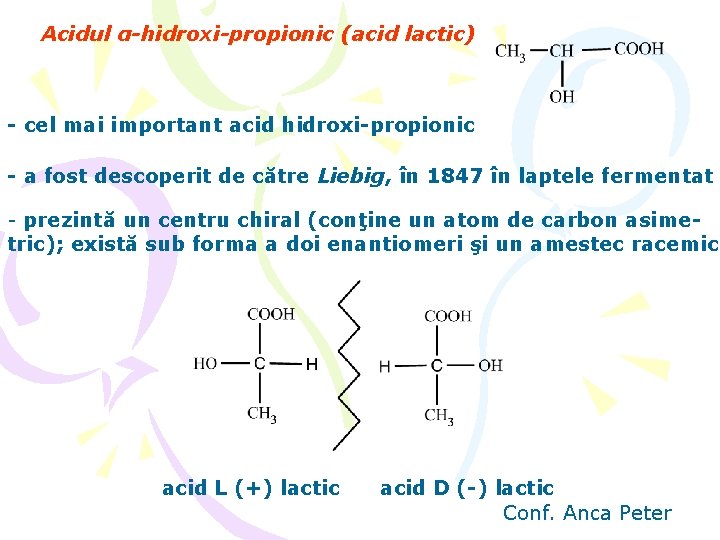
Acidul α-hidroxi-propionic (acid lactic) - cel mai important acid hidroxi-propionic - a fost descoperit de către Liebig, în 1847 în laptele fermentat - prezintă un centru chiral (conţine un atom de carbon asimetric); există sub forma a doi enantiomeri şi un amestec racemic acid L (+) lactic acid D (-) lactic Conf. Anca Peter

Obţinere: - acidul D(-) lactic se obţine prin fermentaţia microbiană a zaharozei în prezenţa Bacillus acidi laevolactici -acidul (±) lactic (acidul lactic racemic), numit şi acid lactic de fermentaţie este produsul fermentaţiei lactice - fermentaţia lactică - descompunerea glucozei, zaharozei, lactozei, etc. , sub influenţa enzimelor sinetizate de Bacillus lactic acidi şi Bacillus delbrücki - acestea produc, prin fermentare, înnăcrirea laptelui - procesul stă la baza obţinerii acidului lactic la scară industrială - ca materie primă se foloseşte amidon, căruia i se adaugă orz încolţit (malţ), pentru ca enzima din malţ (maltaza) să descompună amidonul în maltoză - in amestec se introduce, pe lângă cultura de bacterii lactice, şi carbonat de calciu care precipită acidul lactic format (bacteriile lactice sunt viabile în soluţii de acid lactic în concentraţie de cel mult 2%) -amestecul se încălzeşte la 400 C - ulterior, lactatul de calciu se filtrează şi se acidulează pentru punerea în libertate a acidului lactic, care apoi se concentrează la presiune scăzută - se obţin soluţii siropoase de 50 -80% acid lactic

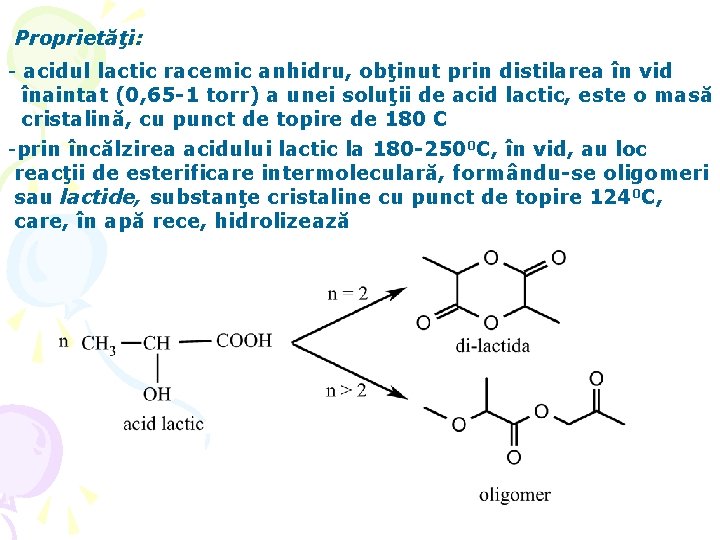
Proprietăţi: - acidul lactic racemic anhidru, obţinut prin distilarea în vid înaintat (0, 65 -1 torr) a unei soluţii de acid lactic, este o masă cristalină, cu punct de topire de 180 C -prin încălzirea acidului lactic la 180 -2500 C, în vid, au loc reacţii de esterificare intermoleculară, formându-se oligomeri sau lactide, substanţe cristaline cu punct de topire 1240 C, care, în apă rece, hidrolizează

Aplicaţii: -lactidele sunt prezente în toate soluţiile de acid lactic având concentraţie mai mare de 18 % -in soluţiile mai diluate este favorizată hidroliza completă a lactidelor obţinându-se acid lactic - lactidele se folosesc ca generatori de acid -acidul lactic se foloseşte la îmbunătăţirea caracteristicilor organoleptice a ouălor albe (ajustarea p. H-ului la 4, 8 -5, 1), la îmbunătăţirea mirosului băuturilor şi murăturilor, la prevenirea decolorării fructelor şi legumelor proaspete, iar sub formă de lactat de calciu se foloseşte ca aditiv la prepararea laptelui praf -acidul L(+) lactic se găseşte în extractul de carne, fiind prezent în lichidul celular din muşchi (ca produs de degradare a glucidelor); este o substanţă cristalină, cu punct de topire de 350 C, higroscopică

- concentraţia acidului lactic în produsele alimentare se poate determina prin cromatografie pe lichid de înaltă performanţă (HPLC) şi rezonanţă magnetică nucleară (RMN) Principiul cromatografiei: eluentul trece prin dispozitivul de introducere a probei, preia proba de analizat şi o introduce în coloana cromatografică, care este sediul procesului de separare. Din cauza interacţiunii moleculelor cu faza staţionară, componentele rămân în urma eluentului, în funcţie de diferenţele care există între constantele echilibrului de repartiţie între cele două faze. Componentele amestecului separat vor ieşi din coloană la timpuri diferite, după care sunt introduse de eluent în detector. Acesta transformă diferenţa unei proprietăţi fizice între component şi eluent, într-un semnal electric, proporţional cu concentraţia componentului din eluent. Înregistrarea grafică a semnalului detectorului în funcţie de timp se numeşte cromatogramă Rezonanţa magnetică nucleară permite determinarea structurii şi concentraţiei diferiţilor compuşi, chiar şi macromoleculari. Se bazează pe studiul nucleelor atomilor componenţi


- altă aplicaţie a bacteriilor lactice este utilizarea lor în procesele de epurare a reziduurilor apoase alimentare; Yang şi colab. [9], au demonstrat că prin inocularea de Lactobacillus salivarius pe reziduurile alimentare, are loc, în doar 10 zile transformarea fibrelor proteice reziduale în carbohidraţi - un efect nedorit rezultat ca urmare a utilizării bacteriilor lactice la prepararea produselor alimentare (din carne, lapte, cereale) este acela că bacteriile lactice stimulează creşterea rezistenţei diferiţilor agenţi patogeni din organism la acţiunea antibiotică [10] (tabel 2)


Apartenenţa la seria sterică ROSANOFF a introdus pentru prima dată noţiunea de serie sterică. El a stabilit că există două serii sterice: D şi L. Primul termen al seriei cu configuraţia: sterice D este aldehida glicerică Primul termen al seriei sterice L este aldehida glicerică cu configuraţia:

Nu există nici un fel de identitate între apartenenţa la seria sterică (care se stabileşte prin metoda corelaţiei sterice) şi tipul de enantiomerie (care se stabileşte polarimetric, în funcţie de direcţia de rotaţie a luminii polarizate); - exemple: 1) aldehida D glicerică este enantiomerul dextrogir (+), care 2) roteşte planul luminii polarizate spre dreapta, iar aldehida L 3) glicerică este enantiomerul levogir (-), care roteşte planul 4) luminii polarizate spre stânga 2) acidul D lactic este levogir (-), iar acidul L lactic este dextrogir (+). În reprezentarea substanţelor cu activitate optică se face uz şi de formulele de configuraţie

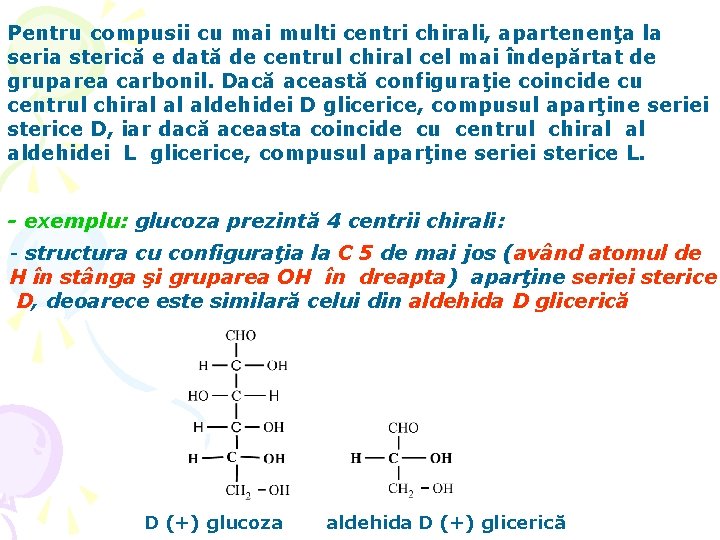
Pentru compusii cu mai multi centri chirali, apartenenţa la seria sterică e dată de centrul chiral cel mai îndepărtat de gruparea carbonil. Dacă această configuraţie coincide cu centrul chiral al aldehidei D glicerice, compusul aparţine seriei sterice D, iar dacă aceasta coincide cu centrul chiral al aldehidei L glicerice, compusul aparţine seriei sterice L. - exemplu: glucoza prezintă 4 centrii chirali: - structura cu configuraţia la C 5 de mai jos (având atomul de H în stânga şi gruparea OH în dreapta) aparţine seriei sterice D, deoarece este similară celui din aldehida D glicerică D (+) glucoza aldehida D (+) glicerică

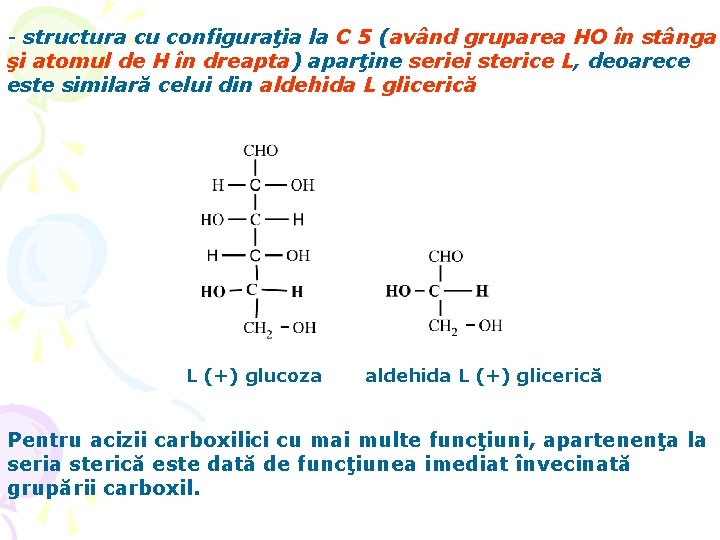
- structura cu configuraţia la C 5 (având gruparea HO în stânga şi atomul de H în dreapta) aparţine seriei sterice L, deoarece este similară celui din aldehida L glicerică L (+) glucoza aldehida L (+) glicerică Pentru acizii carboxilici cu mai multe funcţiuni, apartenenţa la seria sterică este dată de funcţiunea imediat învecinată grupării carboxil.

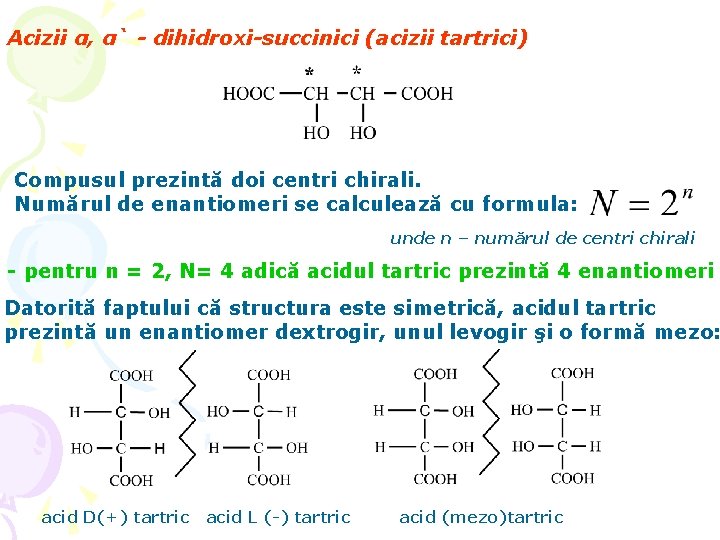
Acizii α, α` - dihidroxi-succinici (acizii tartrici) Compusul prezintă doi centri chirali. Numărul de enantiomeri se calculează cu formula: unde n – numărul de centri chirali - pentru n = 2, N= 4 adică acidul tartric prezintă 4 enantiomeri Datorită faptului că structura este simetrică, acidul tartric prezintă un enantiomer dextrogir, unul levogir şi o formă mezo: acid D(+) tartric acid L (-) tartric acid (mezo)tartric

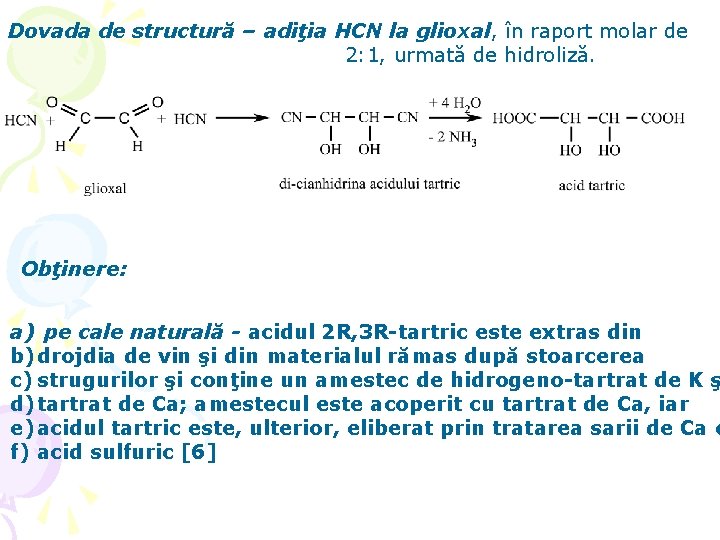
Dovada de structură – adiţia HCN la glioxal, în raport molar de 2: 1, urmată de hidroliză. Obţinere: a) pe cale naturală - acidul 2 R, 3 R-tartric este extras din b) drojdia de vin şi din materialul rămas după stoarcerea c) strugurilor şi conţine un amestec de hidrogeno-tartrat de K ş d) tartrat de Ca; amestecul este acoperit cu tartrat de Ca, iar e) acidul tartric este, ulterior, eliberat prin tratarea sarii de Ca c f) acid sulfuric [6]

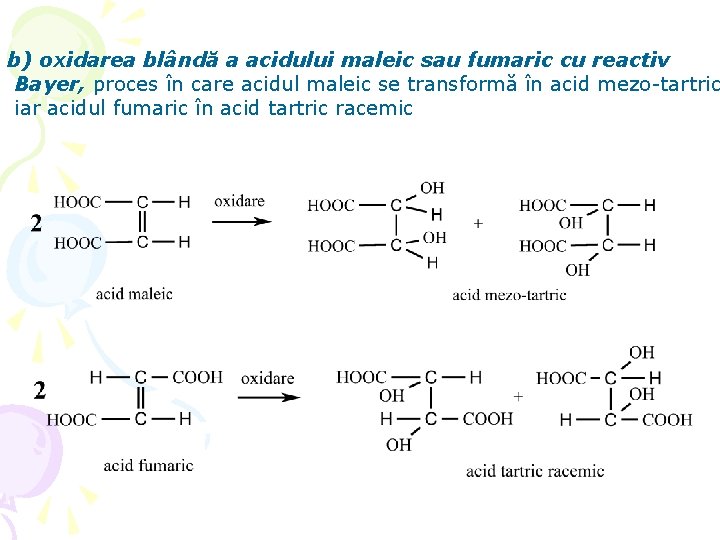
b) oxidarea blândă a acidului maleic sau fumaric cu reactiv Bayer, proces în care acidul maleic se transformă în acid mezo-tartric iar acidul fumaric în acid tartric racemic

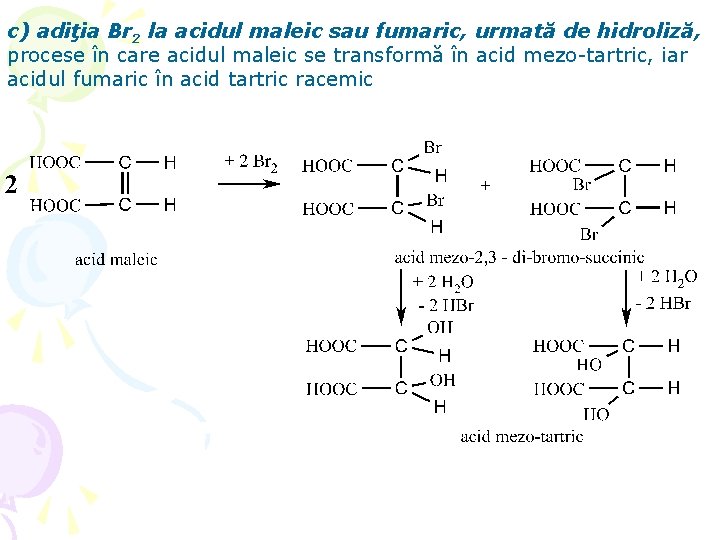
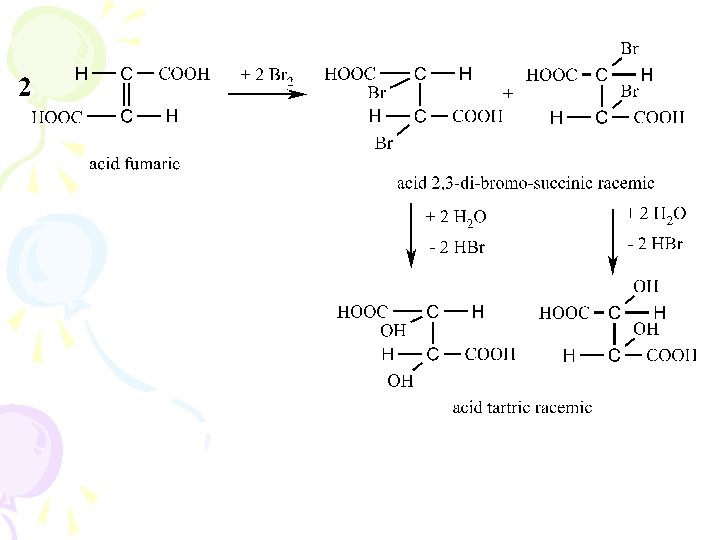
c) adiţia Br 2 la acidul maleic sau fumaric, urmată de hidroliză, procese în care acidul maleic se transformă în acid mezo-tartric, iar acidul fumaric în acid tartric racemic


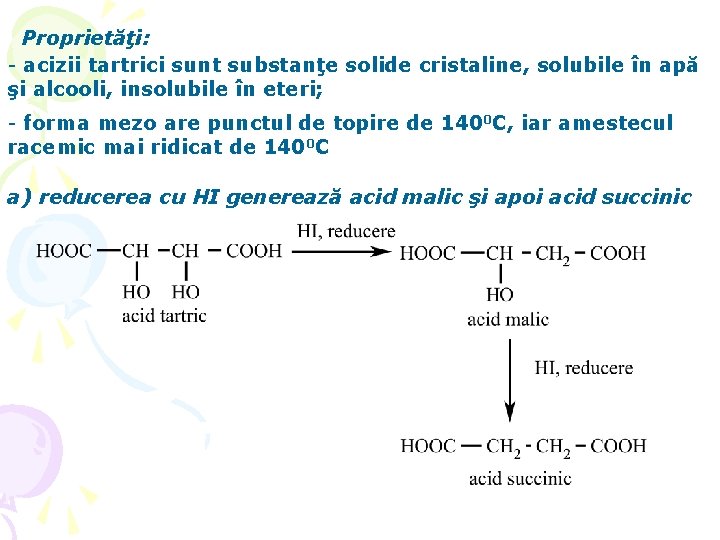
Proprietăţi: - acizii tartrici sunt substanţe solide cristaline, solubile în apă şi alcooli, insolubile în eteri; - forma mezo are punctul de topire de 1400 C, iar amestecul racemic mai ridicat de 1400 C a) reducerea cu HI generează acid malic şi apoi acid succinic

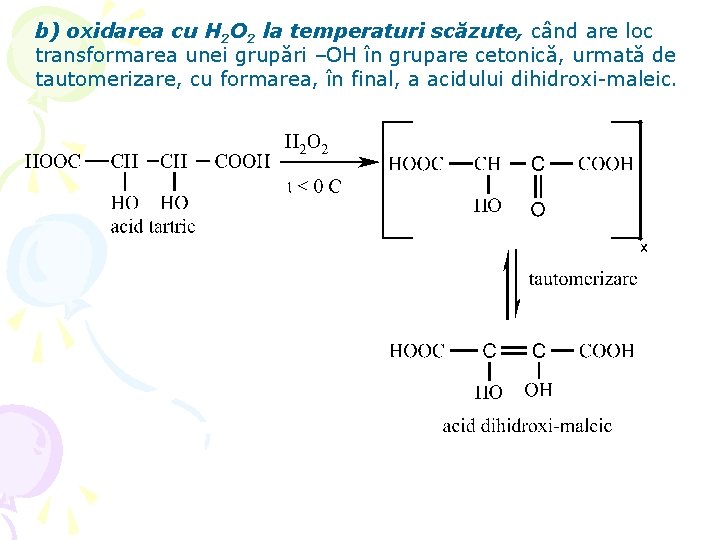
b) oxidarea cu H 2 O 2 la temperaturi scăzute, când are loc transformarea unei grupări –OH în grupare cetonică, urmată de tautomerizare, cu formarea, în final, a acidului dihidroxi-maleic.

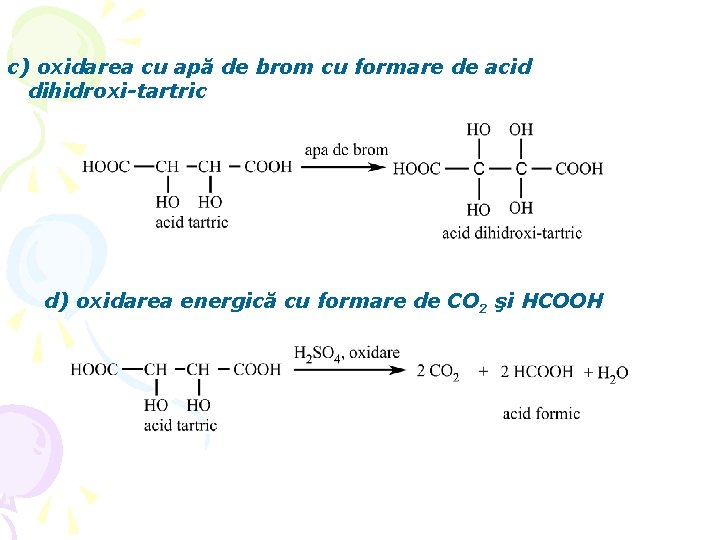
c) oxidarea cu apă de brom cu formare de acid dihidroxi-tartric d) oxidarea energică cu formare de CO 2 şi HCOOH

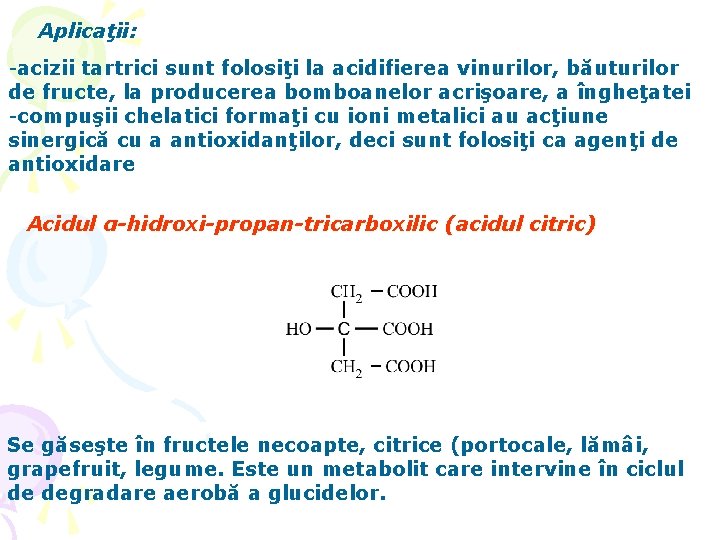
Aplicaţii: -acizii tartrici sunt folosiţi la acidifierea vinurilor, băuturilor de fructe, la producerea bomboanelor acrişoare, a îngheţatei -compuşii chelatici formaţi cu ioni metalici au acţiune sinergică cu a antioxidanţilor, deci sunt folosiţi ca agenţi de antioxidare Acidul α-hidroxi-propan-tricarboxilic (acidul citric) Se găseşte în fructele necoapte, citrice (portocale, lămâi, grapefruit, legume. Este un metabolit care intervine în ciclul de degradare aerobă a glucidelor.

Dovada de structură: a) adiţia HCN la 1, 3 -dicloro-acetonă, urmată de substituţie cu b) KCN şi hidroliză b) adiţia HCN la esterul etilic al acidului aceton-dicarboxilic, urmată de hidroliză

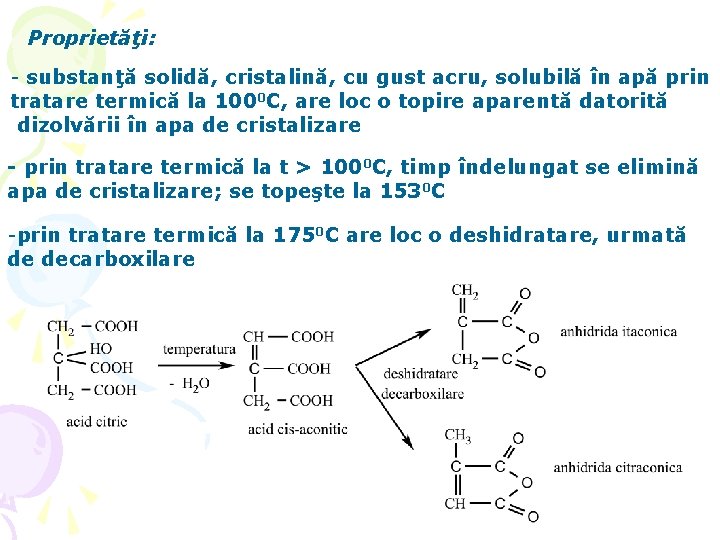
Proprietăţi: - substanţă solidă, cristalină, cu gust acru, solubilă în apă prin tratare termică la 1000 C, are loc o topire aparentă datorită dizolvării în apa de cristalizare - prin tratare termică la t > 1000 C, timp îndelungat se elimină apa de cristalizare; se topeşte la 1530 C -prin tratare termică la 1750 C are loc o deshidratare, urmată de decarboxilare

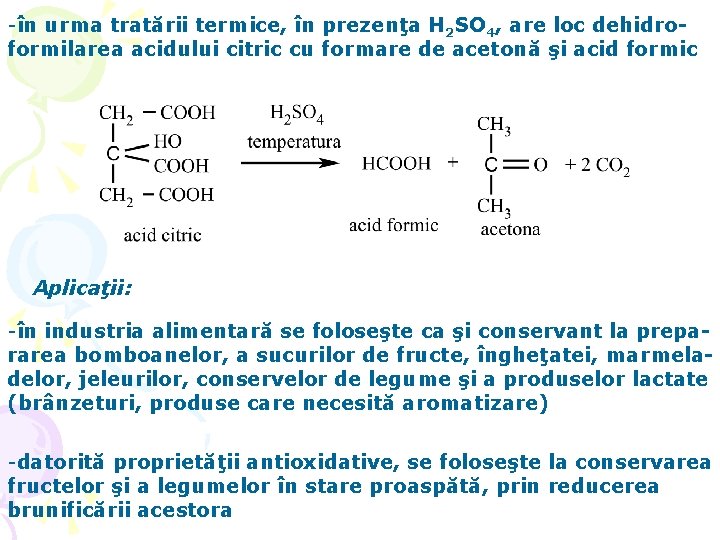
-în urma tratării termice, în prezenţa H 2 SO 4, are loc dehidroformilarea acidului citric cu formare de acetonă şi acid formic Aplicaţii: -în industria alimentară se foloseşte ca şi conservant la prepararea bomboanelor, a sucurilor de fructe, îngheţatei, marmeladelor, jeleurilor, conservelor de legume şi a produselor lactate (brânzeturi, produse care necesită aromatizare) -datorită proprietăţii antioxidative, se foloseşte la conservarea fructelor şi a legumelor în stare proaspătă, prin reducerea brunificării acestora

-în industria farmaceutică, se foloseşte la fabricarea medicamentelor, ca şi corector de p. H, exercită efect anticoagulant asupra sângelui -datorită toxicităţii si coroziunii scăzute şi a biodegradabilităţii, înlocuieşte acizii minerali în procesele de îndepărtare a oxizilor de Fe şi Cu de pe suprafaţa dispozitivelor de încălzire, a reactoarelor nucleare; -de asemenea se foloseşte la pasivarea echipamentelor şi tancurilor din oţel, ca dispersant al nămolurilor de Ti. O 2 şi ca adjustor de p. H în industria textilă