6 Energi i kemi Termokemi Vad r energi
















- Slides: 21

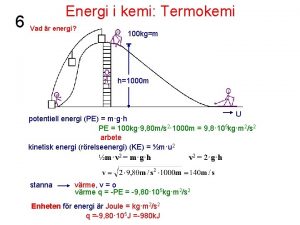
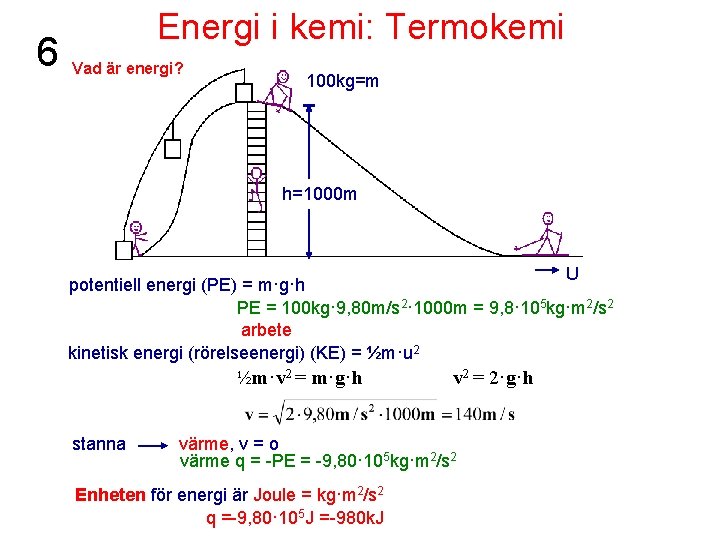
6 Energi i kemi: Termokemi Vad är energi? 100 kg=m h=1000 m U potentiell energi (PE) = m·g·h PE = 100 kg· 9, 80 m/s 2· 1000 m = 9, 8· 105 kg·m 2/s 2 arbete kinetisk energi (rörelseenergi) (KE) = ½m·u 2 ½m·v 2 = m·g·h stanna v 2 = 2·g·h värme, v = o värme q = -PE = -9, 80· 105 kg·m 2/s 2 Enheten för energi är Joule = kg·m 2/s 2 q =-9, 80· 105 J =-980 k. J

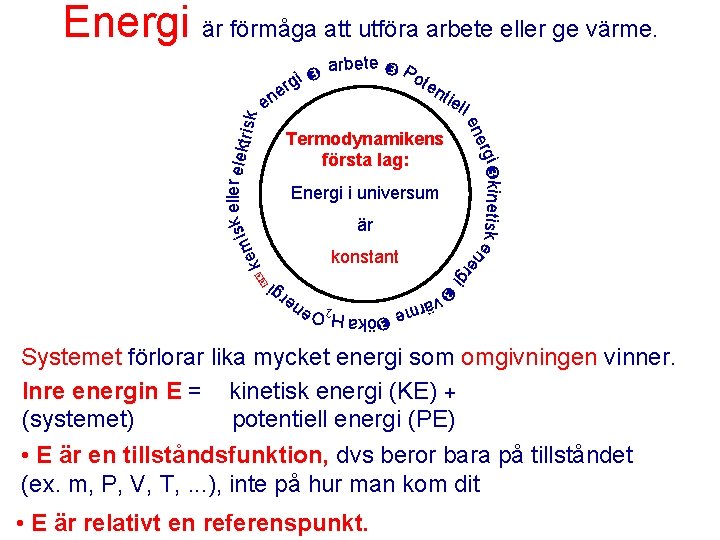
Energi är förmåga att utföra arbete eller ge värme. gi er tie ll k rgi inetisk ene Termodynamikens första lag: Energi i universum är konstant rg i i e öka H 2 Oen e rg värm ote n ene k eller elekt s i risk kem en arbete P Systemet förlorar lika mycket energi som omgivningen vinner. Inre energin E = kinetisk energi (KE) + (systemet) potentiell energi (PE) • E är en tillståndsfunktion, dvs beror bara på tillståndet (ex. m, P, V, T, . . . ), inte på hur man kom dit • E är relativt en referenspunkt.

Energiinnehåll i olika födoämnen: Standardmjölk 2, 6 k. J/g Lättmjölk 1, 6 k. J/g Okokt ris 14, 5 k. J/g Fett 38 k. J/g Kolhydrat 17 k. J/g Protein 17 k. J/g Jfr etanol 29 k. J/g Fett = (CH 2)n Varför denna stora skillnad? kolhydrat = (CH 2 O)n dvs mer oxiderat

Storleksordningen är hundratals kilojoule (k. J) per mol. Värdet kan omräknas i t. ex kronor och ören. 1 J = 1 ws, 1 Kwh = 103· 3600 ws = 3, 6· 106 ws 1 k. Wh kostar ~ 36 öre 100 k. J = 100· 103 ws 1 Kwh 36 öre _____ · · ~ 1 öre 6 1 k. Wh 3· 6· 10 ws Man får alltså 10 MJ för en krona Vad är en människas muskelarbete värt? Hårt arbete, t. ex. cykling, utvecklar max 300 watt. På en timme blir det 0, 3 k. Wh På en arbetsdag 8· 0, 3 k. Wh = 2, 4 k. Wh Ett dagsverke kostar ~en krona!

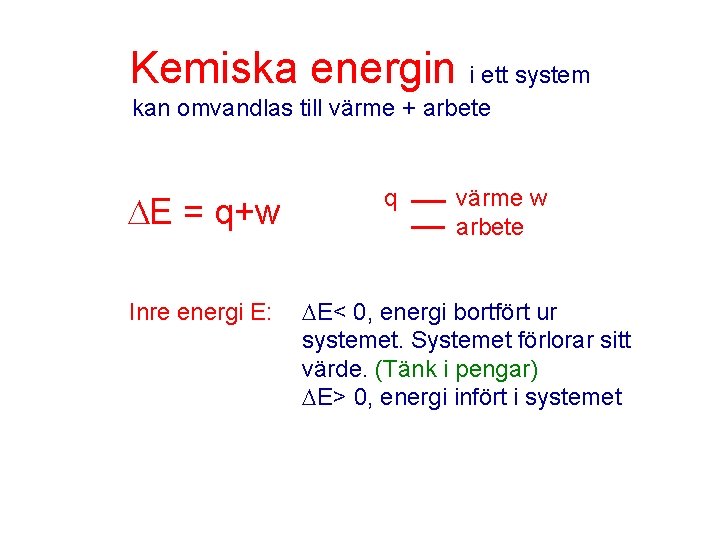
Kemiska energin i ett system kan omvandlas till värme + arbete E = q+w Inre energi E: q värme w arbete E< 0, energi bortfört ur systemet. Systemet förlorar sitt värde. (Tänk i pengar) E> 0, energi infört i systemet

Systemets energi ändras genom att 1) ge värme till omgivningen (q<0), exoterm eller få värme av omgivningen (q>0), endoterm. Värme: energiförflyttning pga temperaturskillnad. OBS! T men inte värme q är en egenskap hos systemet. Ex. Na. OH(s) 1) 2) H 2 O Na+(aq)+OH-(aq) q<o Na+(aq)+OH-(aq) q>o Systemet utför arbete på omgivningen, w<o eller omgivningen utför arbete på systemet, w>o. arbete: kraft·avstånd, t. ex. tryck-volymarbete Tecknet ses från systemets synvinkel av oss kemister (men ingenjörer ser energin från användarens synpunkt och får då omvänt tecken).

Hur mäter vi energiförändringar? genom att mäta värme (q) och arbete (w) Kalorimetri: mäta värme q q ___ T värmekapacitet C= specifik värmekapacitet: molär värmekapacitet: J/°C·g J/°C·mol Bombkalorimeter: konstant volym V=0 inget tryck-volymarbete w (sluten) E = q Öppen kalorimeter: konstant tryck P=0 E = q+w

Ex. Vattens specifika värmekapacitet är c = 4, 18 J/°C·g Hur mycket energi krävs för att värma 1 liter vatten till kokning? 1 cal = 4, 18 J värmer 1 g H 2 O 1°C. 1000 g H 2 O från 20°c till 100°C, T=80°C q = m·c· T = 1000 g· 4, 18 J/°c·g· 80°C = 334 k. J ~ 4öre (0, 09 k. Wh) (Kolla svaret: en vanlig kokplatta är på c: a 1 k. W. Det tar c: a 8 minuter att koka upp 1 liter vatten ~ 0, 12 k. Wh. )

De flesta kemiska reaktioner utförs vid konstant tryck P~1 atm 2 H 2 O 2(aq) I- 10 ml 35% H 2 O 2 Inre E: 2 H 2 O(l) + O 2(g) + värme ~1, 4 l gas vid T=20°c P=1 atm EH 2 O 2 EH 2 O E = (EH 2 O+EO 2) — EH 2 O 2 Potentiell energi EO 2 EH 2 O 2 E • arbetet (w) kan beräknas: (Tryck-volymarbete) w = -P V = -1 atm· 1, 4 l = -1, 4 l·atm (1·atm = 101, 325 J ____ 101, 325 J w = -1, 4·l·atm· 1 l·atm = -141 J EH 2 O+EO 2 BD, s. 13) • värmen (q) kan mätas med kalorimeter: q = -mlösn. ·Cp· T ~ 15 g· 4, 18 J g-1·°c-1 T eller q = E - w = E + P V Inre energi E= w+q • Tryck-volymarbete utförs bara om gaser deltar i reaktionen; de kan bildas eller förbrukas (utvidgas (w = -P V<0) eller komprimeras (w = -P V>0)). • Tryck-volymarbete -P V är alltså ganska litet (eller = 0) om inga gaser. ingår i reaktionen

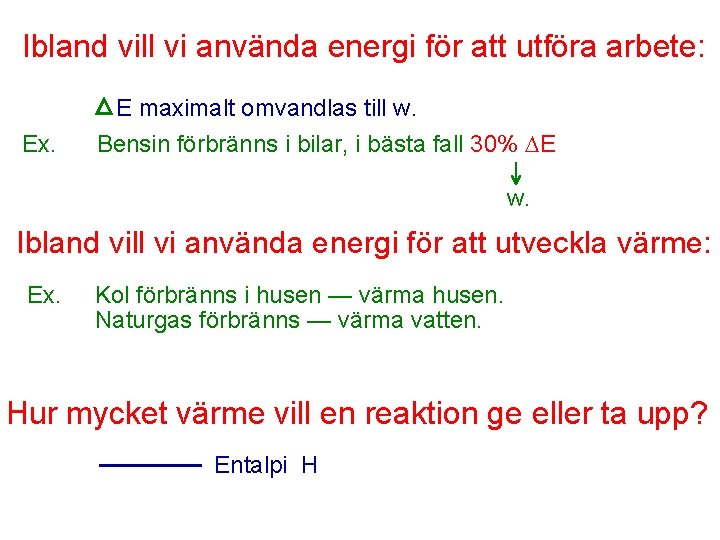
Ibland vill vi använda energi för att utföra arbete: E maximalt omvandlas till w. Ex. Bensin förbränns i bilar, i bästa fall 30% E w. Ibland vill vi använda energi för att utveckla värme: Ex. Kol förbränns i husen — värma husen. Naturgas förbränns — värma vatten. Hur mycket värme vill en reaktion ge eller ta upp? Entalpi H

Entalpi H = E+PV E, P och V är tillståndsfunktioner. H är en tillståndsfunktion. För gaser, H = E + PV =E + n. RT Vid konstant tryck P = 0: H = E + (PV) = E + P V Om arbetet i reaktionen är BARA tryck-volymarbete w = -P V E = H - P V = E + (PV) jfr med termodynamikens första lag: E = q + w q = H vid konstant tryck och bara tryck-volymarbete utförs.

2 H 2 O 2(aq) I- 2 H 2 O(l) + O 2(g) q = H = (HH 2 O + HO 2 - HH 2 O 2) istället för q = E+P V I en kemisk reaktion: H = Hprodukter — Hreaktanter • Om en reaktion är omvänd, byter H tecken. • H är proportionell mot antal mol reaktanter och produkter.

Hur mäter vi entalpiförändringar? Kalorimetri i ett öppet kärl konst tryck H = qp (I praktiken använder man bombkalorimetri, dvs vid konstant volym E = qv, sen använd PV = n. RT och H = E+PV H = qv + RT ngas) noggrannheten ± 0, 01 k. J/mol 2 H 2 O 2(aq) 2 H 2 O(l) + O 2(g) H = -98 k. J/mol H 2 O 2 Vi får även H för: jämför w bara 0, 141 k. J/mol 2 H 2 O(l) + O 2(g) 2 H 2 O 2(aq) H = 98 k. J/mol H 2 O 2

Hess’ lag: Entalpiförändringen för en nettoreaktion är oberoende av vägen dit. Ex: Ett steg: 1 mol N 2(g) + 2 mol O 2(g) 2 mol NO 2(g) 2 NO 2(g) H 1 = 68 k. J N 2(g)+2 O 2(g) eller Två steg: N 2(g) + O 2(g) 2 NO 2(g) H 2 = 180 k. J 2 NO(g) + O 2(g) 2 NO 2(g) H 3 = 112 k. J __________________ N 2(g)+2 O 2(g) H 1 = H 2 + H 3 = 68 k. J 2 NO 2(g) H 2 + H 2 = 68 k. J

Standard bildningsentalpier Hf 0 Entalpin för att bilda en mol av föreningen ur dess grundämnen under standardtillstånd. Standardtillstånd (o) Föreningar: 1) gaser: 1 atm 2) löst ämne: 1 mol dm-3 = 1 M 3) flytande fas och fasta faser: rena Grundämnen: agregationstillstånd vid 1 atm, 25°c Ex: O 2(g), Na(s), Hg(l), Ar(g), H 2 O(l), Fe(s), H 2(g) Icke standardtillstånd: I luften, p(O 2) = 0, 221 atm salt vatten stål — Fe(s) med 2% C(s)

Standard bildningsentalpi Hfo (25°c) Jfr H 2(g) + ½ O 2(g) H 2 O(l) H 2(g) + ½ O 2(g) H 2 O(g) H 2(g) + ½ O 2(g) H 2 O(l) Hfo = -285, 8 k. J/mol Hfo = -241, 8 k. J/mol Hfo = + 241, 8 k. J/mol Ho = -44, 0 k. J/mol Na(s) + ½ Cl 2(g) Hfo = -411, 2 k. J/mol Hfo finns i BD, Na. Cl(s) oorganiska ämnen tabell 5. 4 organiska ämnen tabell 5. 5 joner i vattenlösningar tabell 5. 6 OBS! Hfo är för 1 mol produkter!

Vad är H 0 för reaktionen CH 4(g) + 2 O 2(g) 2 H 2 O(l) + CO 2(g) ? C(s) + 2 H 2(g) CH 4(g) Hf 0 = -74, 8 k. J/mol CH 4(g) C(s) + 2 H 2(g) H 0 = - (-74, 8 k. J/mol) 2·(O 2(g) Hf 0 = 0 k. J/mol) C(s) + O 2 CO 2(g) Hf 0 = -393, 5 k. J/mol 2·(H 2(g) + ½ O 2(g) H 2 O(l) Hf 0 = -285, 8 k. J/mol) __________________________ CH 4(g) + 2 O 2(g) 2 H 2 O(l) + CO 2(g) oreaktion = -393. 5 k. J/mol + 2·(-285, 8 k. J/mol) – 74, 8 k. J/mol) = -891, 1 k. J/mol (-

Kom ihåg: • När en reaktion är omvänd, är storleken H samma, men tecknet bytes. • Om den balanserade reaktionsformeln är multiplicerad med n, är reaktionsentalpin n· H. • Horek = (np Hfo(produkter) - nr Hfo(reaktanter)). • Hfo för ett element vid standardtillstånd är noll.

Vad är H°, dvs q för reaktionen NH 4 NO 3(s) NH 4+(aq) + NO 3 -(aq) Antal 0, 10 mol NH 4 NO 3(s) i 100 ml vatten vid 25°c +] [NH 4 = [NO 3 -] 0, 1 mol ______ = = 1 mol dm-3 = 1 M 100 ml Horek = n·{Hfo. NH 4+(aq) + Hfo. NO 3 -(aq) – Hfo. NH 4 NO 3(s)} = 0, 10 mol·(-132, 5 k. J·mol-1 – 207, 4 k. J·mol-1 – (365, 6 k. J·mol-1)) = 0, 10 mol· 25, 7 k. J·mol-1 = 2, 57 k. J Bo. D s. 113 och s. 87

Vad blir temperaturen då? q = Horek = 2, 57 k. J, endoterm, t<0 Cp = 4, 18 J·g-1·°c-1 ~1, 0 g·cm-3 -q -2, 57· 103 J _____________ t = = = -6, 1°C 3 -3 -1 -1 m·Cp 100 cm · 1, 0 g·cm · 4, 18 J °C tfin = 25°C – 6, 1°C = 19°C

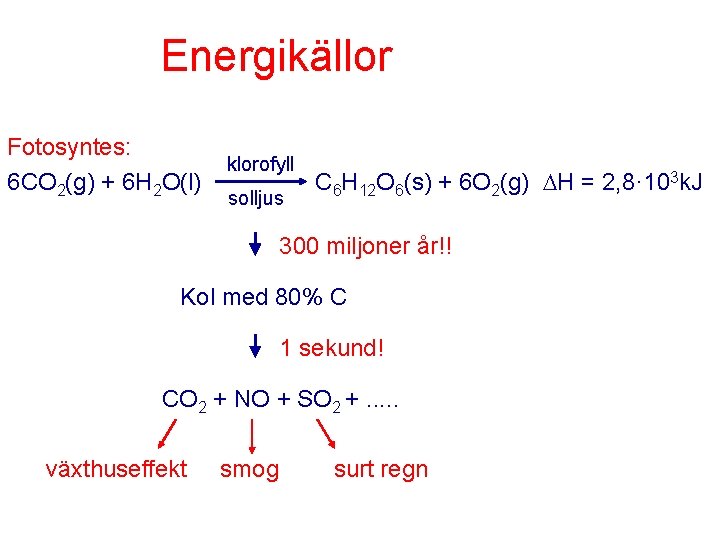
Energikällor Fotosyntes: 6 CO 2(g) + 6 H 2 O(l) klorofyll solljus C 6 H 12 O 6(s) + 6 O 2(g) H = 2, 8· 103 k. J 300 miljoner år!! Kol med 80% C 1 sekund! CO 2 + NO + SO 2 +. . . växthuseffekt smog surt regn
 Bildningsentalpier
Bildningsentalpier Energi kalor menjadi energi listrik
Energi kalor menjadi energi listrik Lampu neon mengubah energi listrik menjadi
Lampu neon mengubah energi listrik menjadi Energi listrik adalah energi yang berasal dari muatan
Energi listrik adalah energi yang berasal dari muatan Energi listrik menjadi energi cahaya
Energi listrik menjadi energi cahaya Mitstudie au
Mitstudie au Afstemning af kemiske reaktioner
Afstemning af kemiske reaktioner Kiros au
Kiros au Nr 26 kemi
Nr 26 kemi Geokaivot
Geokaivot Bachelorprojekt au
Bachelorprojekt au Llojet e togfjaleshi
Llojet e togfjaleshi Nr 25 kemi
Nr 25 kemi Kotisairaanhoito kemi
Kotisairaanhoito kemi Alkanserien
Alkanserien Isomerer
Isomerer Magnesiumfluorid strukturformel
Magnesiumfluorid strukturformel Kh kemi
Kh kemi Hac kemi
Hac kemi Sackaros uppbyggnad
Sackaros uppbyggnad Slamning kemi
Slamning kemi Avslutningstal
Avslutningstal