21 Elads Heterociklusos vegyletek HETEROCIKLUSOS VEGYLETEK Feloszts O

- Slides: 21

21. Előadás Heterociklusos vegyületek

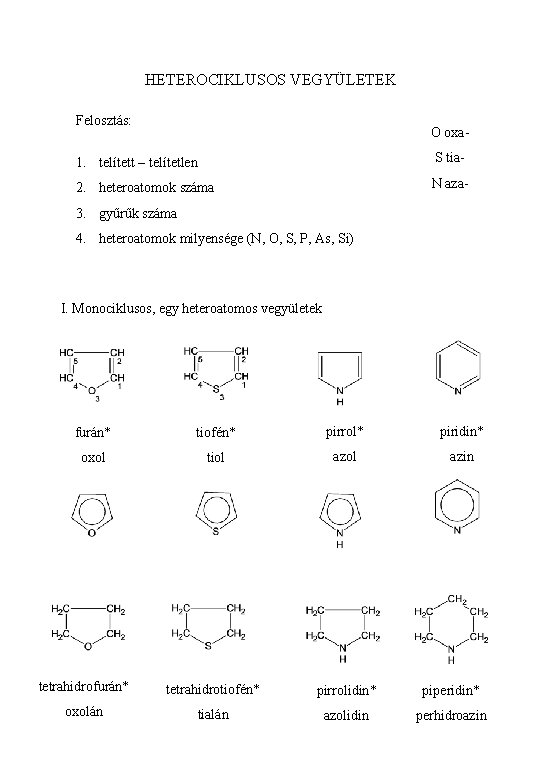
HETEROCIKLUSOS VEGYÜLETEK Felosztás: O oxa- 1. telített – telítetlen S tia- 2. heteroatomok száma N aza- 3. gyűrűk száma 4. heteroatomok milyensége (N, O, S, P, As, Si) I. Monociklusos, egy heteroatomos vegyületek furán* tiofén* pirrol* piridin* oxol tiol azin tetrahidrofurán* tetrahidrotiofén* pirrolidin* piperidin* oxolán tialán azolidin perhidroazin

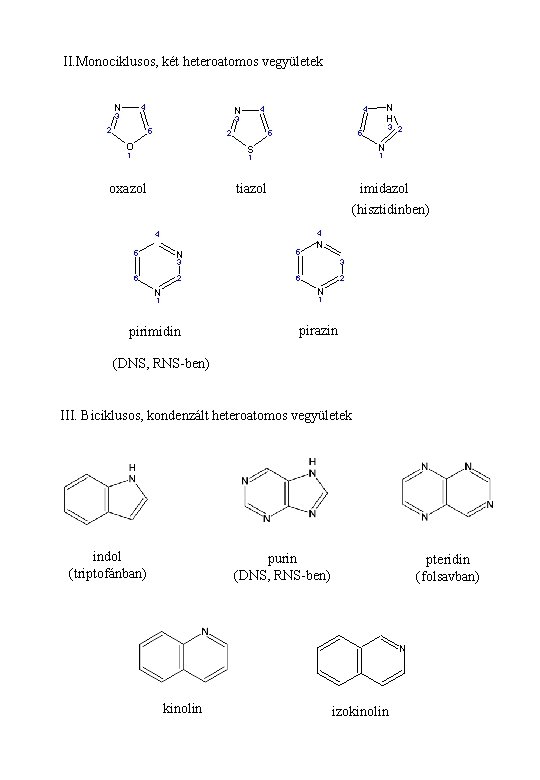
II. Monociklusos, két heteroatomos vegyületek N 4 N H 4 4 N 3 3 2 5 2 O 5 N S 1 1 1 oxazol tiazol imidazol (hisztidinben) 4 4 5 N 5 2 6 N 3 3 6 3 2 5 2 N N pirimidin pirazin 1 1 (DNS, RNS-ben) III. Biciklusos, kondenzált heteroatomos vegyületek indol (triptofánban) purin (DNS, RNS-ben) pteridin (folsavban) N kinolin izokinolin

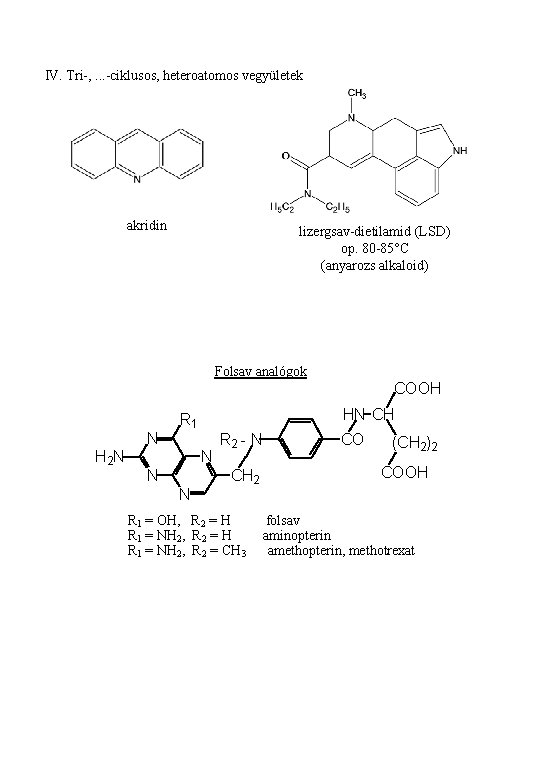
IV. Tri-, . . . -ciklusos, heteroatomos vegyületek akridin lizergsav-dietilamid (LSD) op. 80 -85°C (anyarozs alkaloid) Folsav analógok COOH N H 2 N HN CH R 1 N N N R 2 - N CH 2 R 1 = OH, R 2 = H R 1 = NH 2, R 2 = CH 3 CO (CH 2)2 COOH folsav aminopterin amethopterin, methotrexat

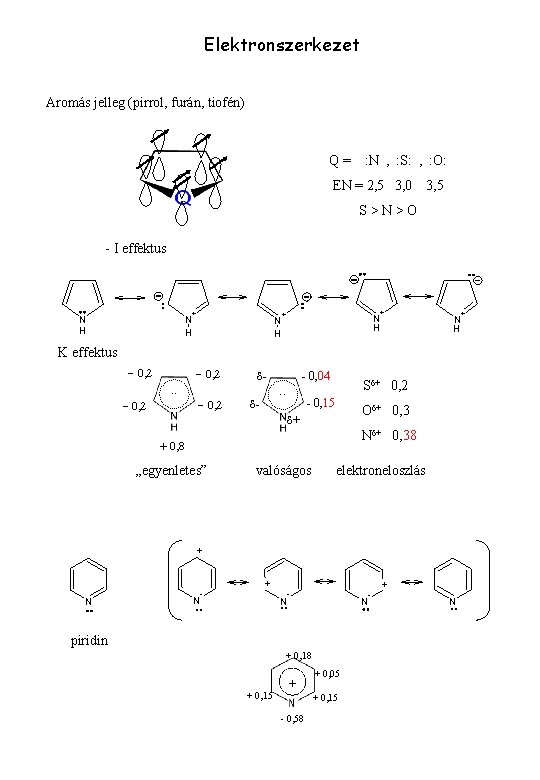
Elektronszerkezet Aromás jelleg (pirrol, furán, tiofén) Q= : N , : S: , : O: EN = 2, 5 3, 0 3, 5 S>N>O - I effektus N H + + + N H K effektus - 0, 2 . . - 0, 2 dd- - 0, 04 . . Sd+ 0, 2 - 0, 15 Od+ 0, 3 d+ Nd+ 0, 38 + 0, 8 „egyenletes” valóságos elektroneloszlás + N N - + N N piridin + 0, 18 + 0, 15 + + 0, 05 + 0, 15 - 0, 58 + N

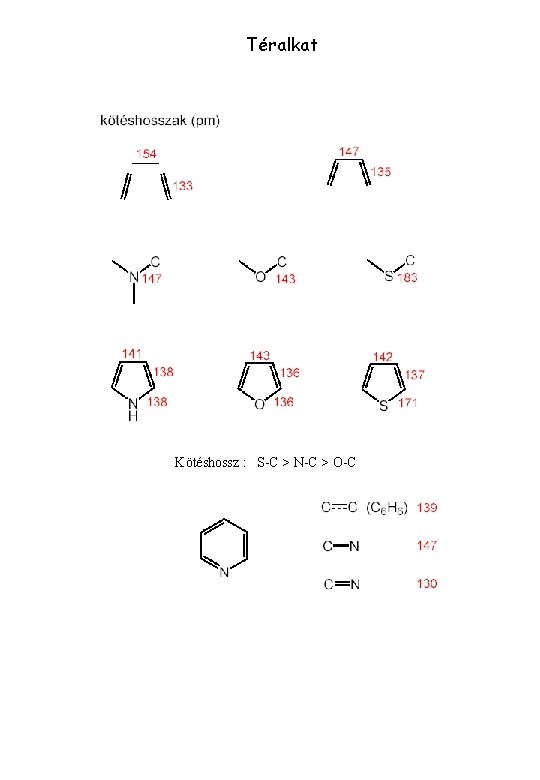
Téralkat Kötéshossz : S-C > N-C > O-C

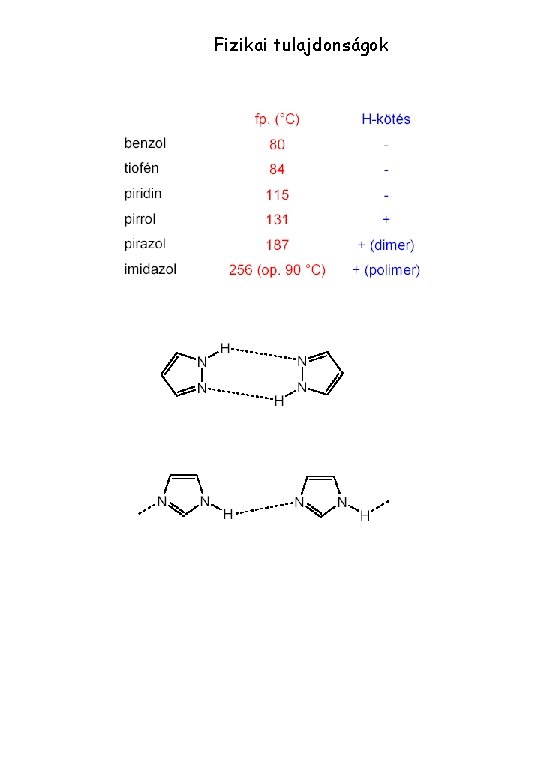
Fizikai tulajdonságok

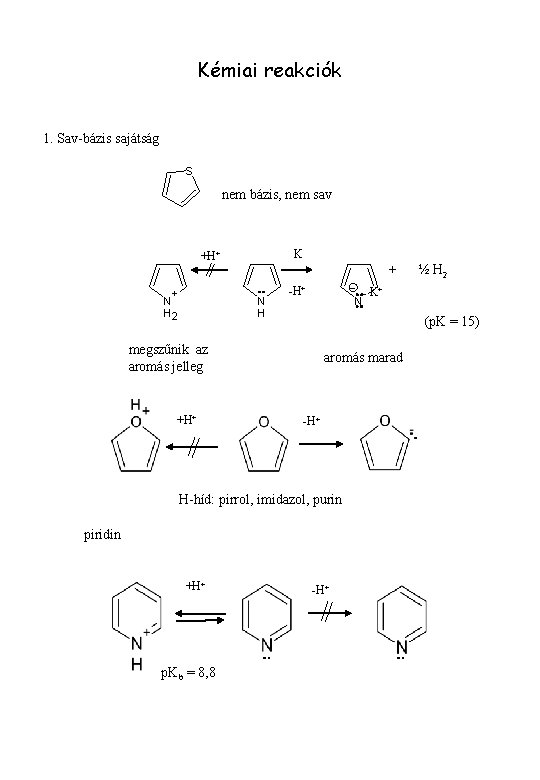
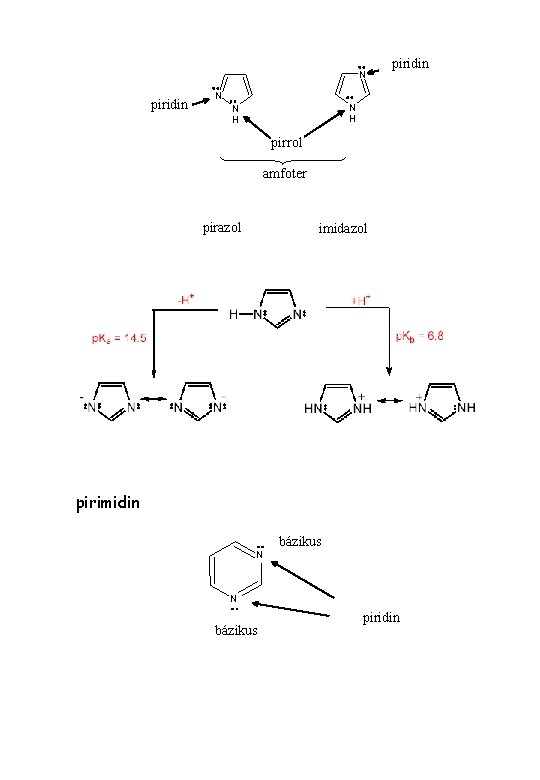
Kémiai reakciók 1. Sav-bázis sajátság S nem bázis, nem sav K +H+ + N H 2 + N H -H+ - K+ N (p. K = 15) megszűnik az aromás jelleg +H+ aromás marad -H+ H-híd: pirrol, imidazol, purin piridin +H+ p. Kb = 8, 8 ½ H 2 -H+

N piridin N N H pirrol amfoter pirazol imidazol pirimidin bázikus N N bázikus piridin

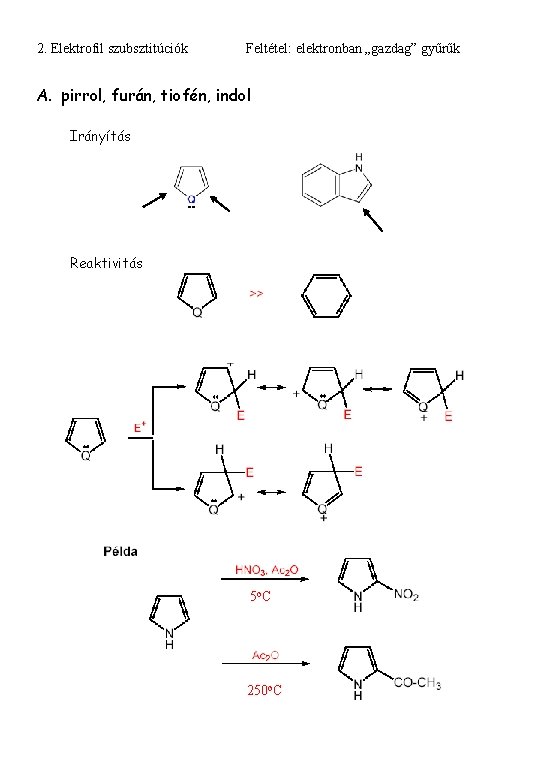
2. Elektrofil szubsztitúciók Feltétel: elektronban „gazdag” gyűrűk A. pirrol, furán, tiofén, indol Irányítás Reaktivitás 5 o. C 250 o. C

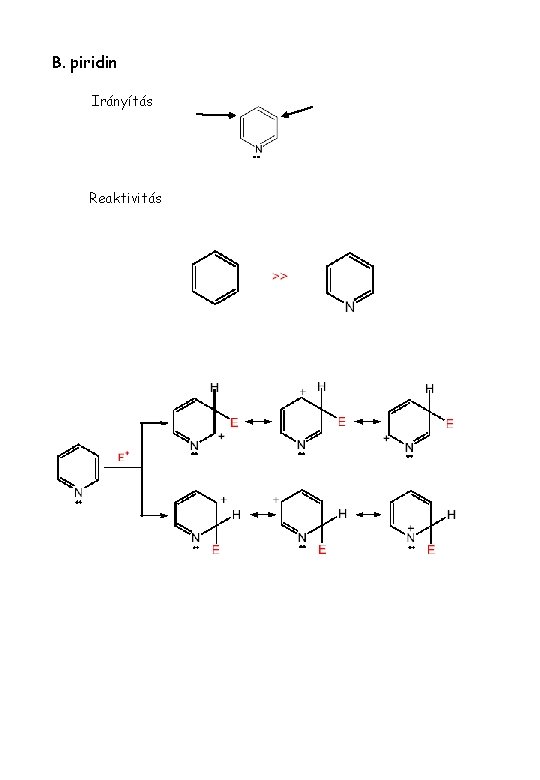
B. piridin Irányítás Reaktivitás

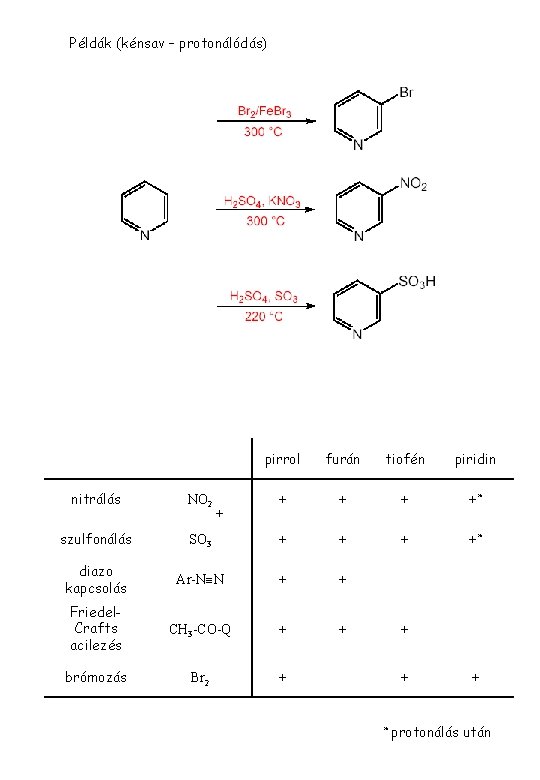
Példák (kénsav – protonálódás) Áttekintés pirrol furán tiofén piridin + +* nitrálás NO 2 szulfonálás SO 3 + + diazo kapcsolás Ar-N N + + Friedel. Crafts acilezés CH 3 -CO-Q + + brómozás Br 2 + + * + protonálás után

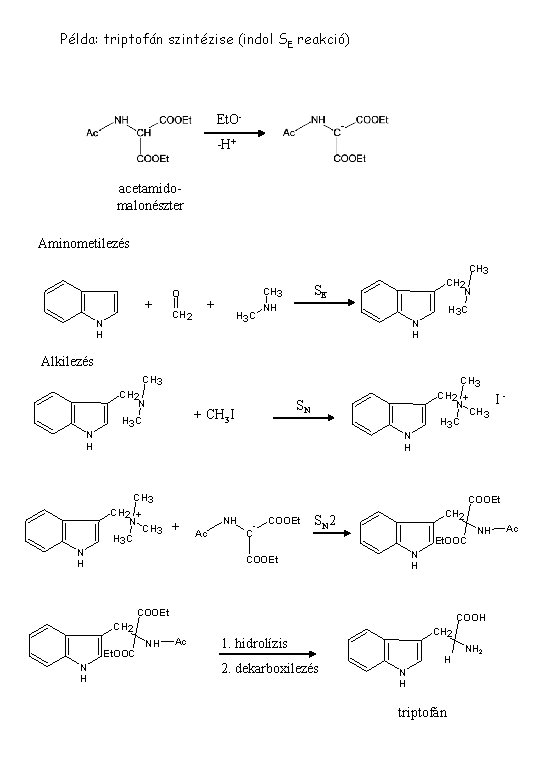
Példa: triptofán szintézise (indol SE reakció) Et. O-H+ acetamidomalonészter Aminometilezés CH 3 + N H O + CH 2 H 3 C CH 2 N SE CH 3 NH H 3 C N H Alkilezés CH 3 CH 2 N SN + CH 3 I H 3 C CH 3 CH 2 + N CH 3 H 3 C N H CH 3 CH 2 + N CH 3 H 3 C COOEt + N H NH Ac C - COOEt CH 2 SN 2 Et. OOC COOH CH 2 Et. OOC NH NH N H COOEt N H I- Ac CH 2 1. hidrolízis 2. dekarboxilezés H N H triptofán NH 2 Ac

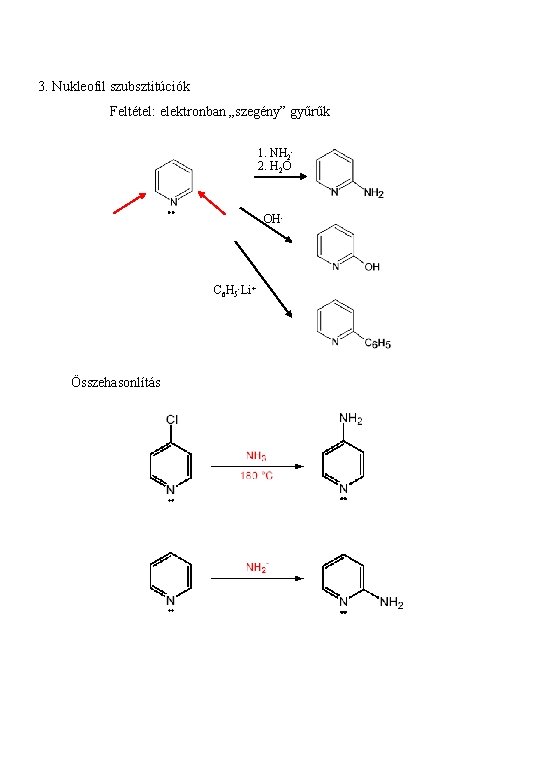
3. Nukleofil szubsztitúciók Feltétel: elektronban „szegény” gyűrűk 1. NH 22. H 2 O OH- C 6 H 5 -Li+ Összehasonlítás

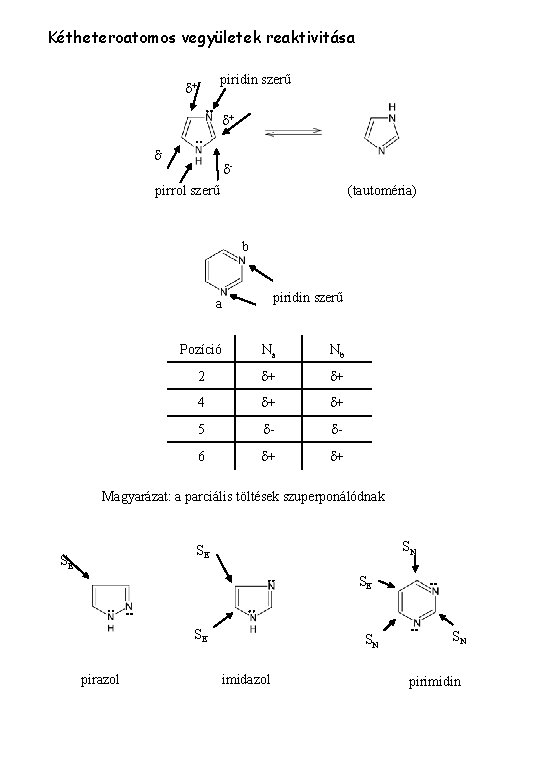
Kétheteroatomos vegyületek reaktivitása piridin szerű d+ d+ d- d- pirrol szerű (tautoméria) b piridin szerű a Pozíció Na Nb 2 d+ d+ 4 d+ d+ 5 d- d- 6 d+ d+ Magyarázat: a parciális töltések szuperponálódnak SN SE SE pirazol SN imidazol SN pirimidin

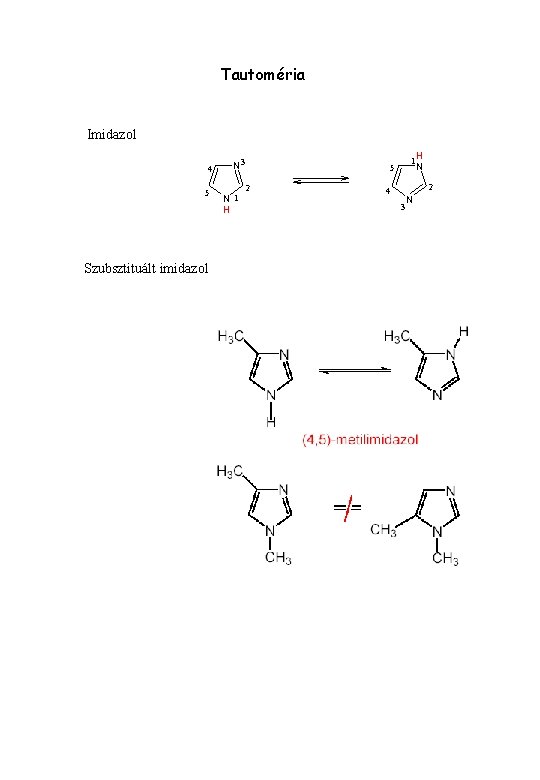
Tautoméria Imidazol 4 5 Szubsztituált imidazol N 3 N 1 H 1 5 2 H N 2 4 3 N

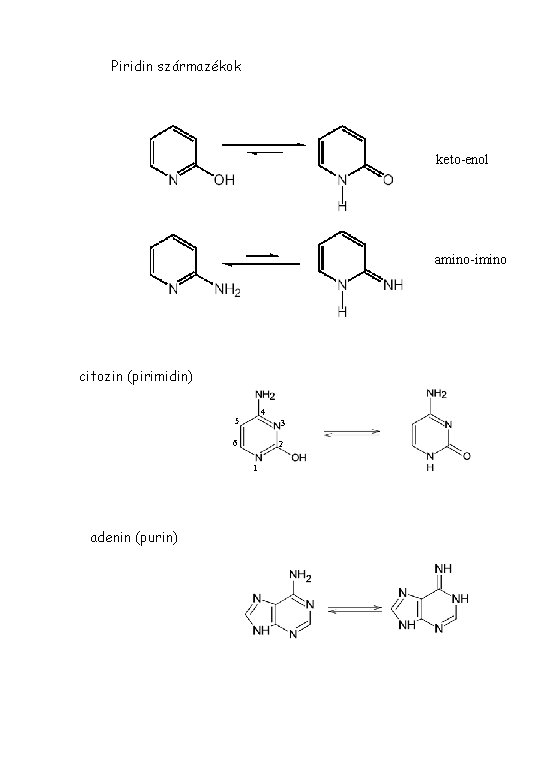
Piridin származékok keto-enol amino-imino citozin (pirimidin) 4 5 3 6 2 1 adenin (purin)

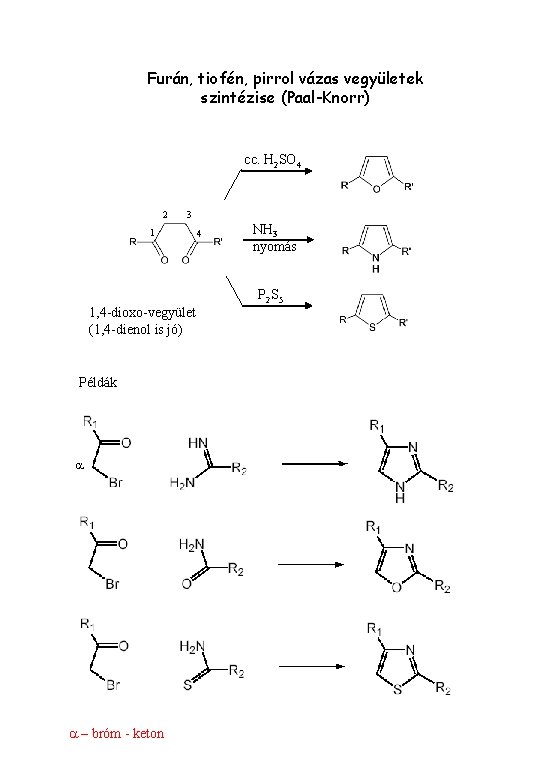
Furán, tiofén, pirrol vázas vegyületek szintézise (Paal-Knorr) cc. H 2 SO 4 2 3 1 4 NH 3 nyomás P 2 S 5 1, 4 -dioxo-vegyület (1, 4 -dienol is jó) Példák a a – bróm - keton

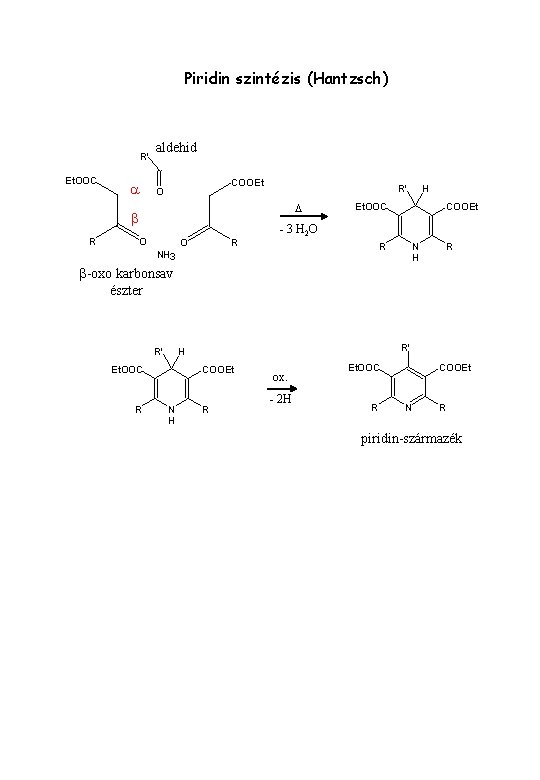
Piridin szintézis (Hantzsch) R' Et. OOC a aldehid COOEt O D b R R' O O R H Et. OOC COOEt - 3 H 2 O R NH 3 N H R b-oxo karbonsav észter R' Et. OOC R R' H COOEt N H R ox. - 2 H Et. OOC R COOEt N R piridin-származék

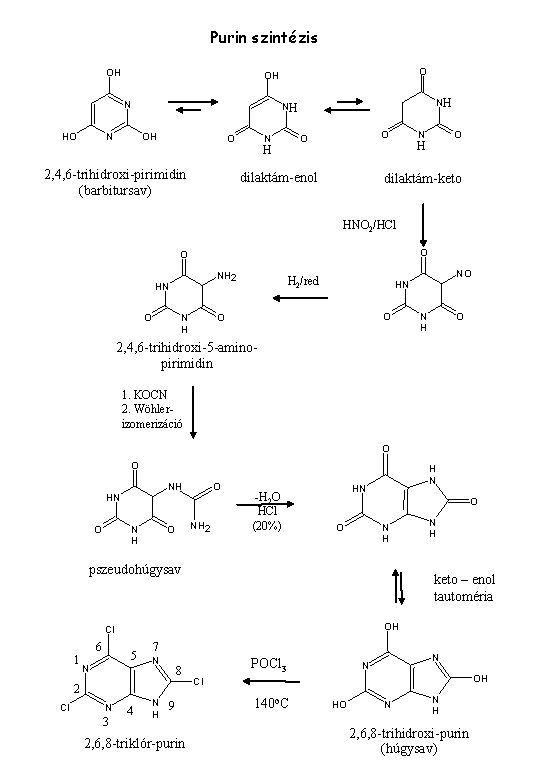
Purin szintézis OH N HO O OH N NH NH OH O 2, 4, 6 -trihidroxi-pirimidin (barbitursav) N O O H dilaktám-enol N O H dilaktám-keto HNO 2/HCl O O NH 2 HN O N H H 2/red NO HN O O N H O 2, 4, 6 -trihidroxi-5 -aminopirimidin 1. KOCN 2. Wöhlerizomerizáció O O NH HN O N H O NH 2 O -H 2 O HCl (20%) H N HN O O N H pszeudohúgysav keto – enol tautoméria OH Cl 6 1 5 N 7 N 8 2 Cl N 3 N H 4 N H 9 2, 6, 8 -triklór-purin POCl 3 N N OH Cl 140 o. C HO N N H 2, 6, 8 -trihidroxi-purin (húgysav)

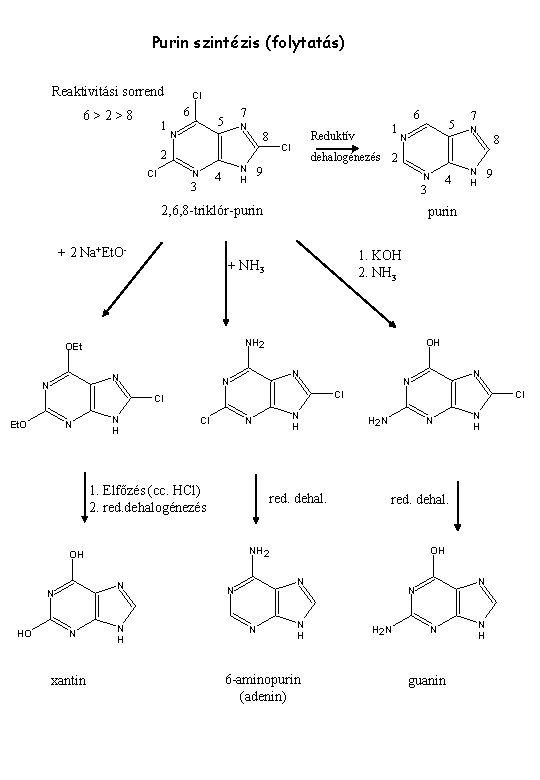
Purin szintézis (folytatás) Reaktivitási sorrend Cl 6 6>2>8 1 7 5 6 N N 8 2 Cl N N H 4 3 1 Reduktív Cl N N H HO N N xantin N N Cl N H N red. dehal. Cl H 2 N N OH N N H red. dehal. NH 2 N H 9 Cl OH N N H OH N 1. Elfőzés (cc. HCl) 2. red. dehalogénezés N 8 1. KOH 2. NH 3 Cl Et. O N purin NH 2 N N 4 3 + NH 3 OEt 7 dehalogénezés 2 9 2, 6, 8 -triklór-purin + 2 Na+Et. O- 5 N H 6 -aminopurin (adenin) N N H 2 N N guanin N H