13 CSOPORT IIIA CSOPORT Vegyszetilelmiszeripari Kzpiskola CSKA Ksztette



































- Slides: 40

13. CSOPORT (IIIA CSOPORT) Vegyészeti-élelmiszeripari Középiskola CSÓKA Készítette: Varga István 1

Al Ga In Sűrűség növekszik B A +3 oxidációs állapotra való hajlam csökken A +1 oxidációs állapotra való hajlam erősödik Tl cs ö k k e n Ei A vegyértékelektronok általános elektronszerkezete 2 1 ns np 2

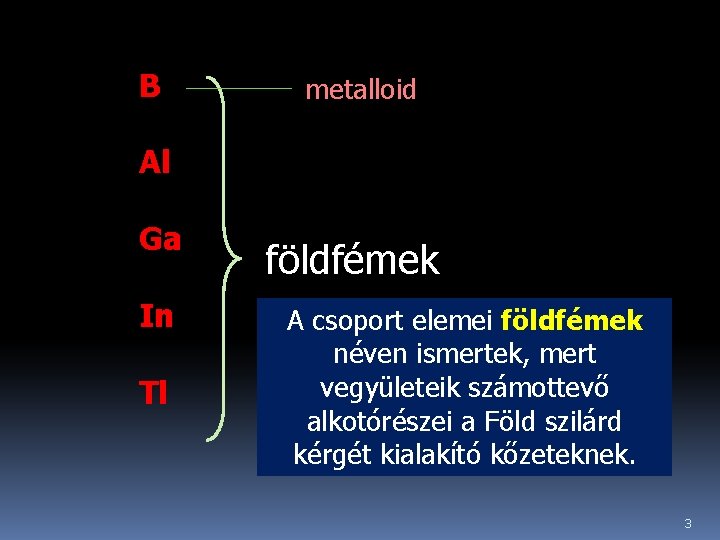
B metalloid Al Ga In Tl földfémek A csoport elemei földfémek néven ismertek, mert vegyületeik számottevő alkotórészei a Föld szilárd kérgét kialakító kőzeteknek. 3

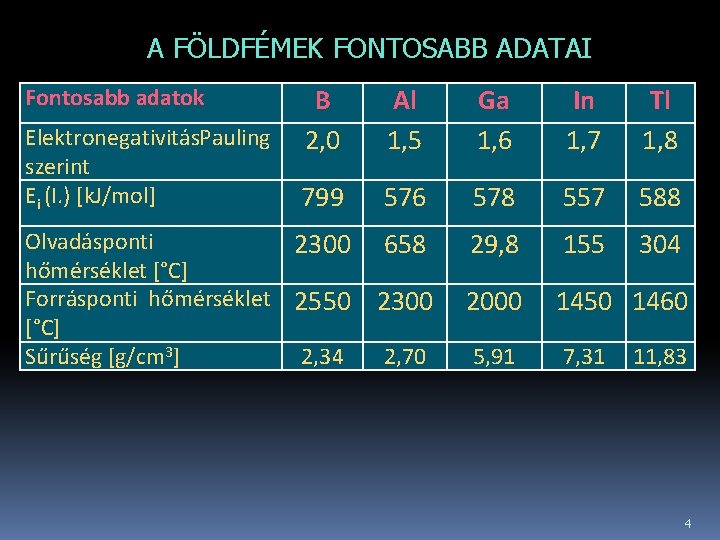
A FÖLDFÉMEK FONTOSABB ADATAI B 2, 0 Al 1, 5 Ga 1, 6 In 1, 7 Tl 1, 8 799 576 578 557 588 Olvadásponti 2300 hőmérséklet [°C] Forrásponti hőmérséklet 2550 [°C] Sűrűség [g/cm 3] 2, 34 658 29, 8 155 304 2300 2000 1450 1460 2, 70 5, 91 7, 31 Fontosabb adatok Elektronegativitás Pauling szerint Ei (I. ) [k. J/mol] 11, 83 4

ALUMÍNIUM (aluminium, aluminijum, алюминий) 5

A 3. leggyakrabban előforduló elem. Nagy reakcióképessége miatt csak vegyületei (ásványai) alakjában fordul elő a természetben. Az alumínium elnevezése latin eredetű: alumen magyarul timsót jelent. 6

Az alumíniumot először H. C. Oersted dán fizikus és kémikus állította elő 1825 -ben vízmentes alumínium-klorid redukálásával. Fontosabb ásványai: Ø bauxit Al 2 O 3·H 2 O Hans Christian Ørsted (1777 -1851) Ø kriolit Na 3[Al. F 6] Ø korund Al 2 O 3 Ø mészpát Ca[Al 2 Si 3 O 8] Ø kaolinit Al 2 O 3· 2 Si. O 2· 2 H 2 O 7

Ezüstfehér színű, csillogó, tiszta állapotban jól nyújtható és hengerelhető, puha könnyűfém. Köbös lapcentrált kristályok formájában kristályosodik. Elektromos vezetőképessége a rézének kb. 60%-a. 8

Az alumínium izotópjai q Az alumíniumnak 1 stabil (27 Al – 100%) és több radioaktív izotópja van. Emissziós színképe a látható tartományban 9

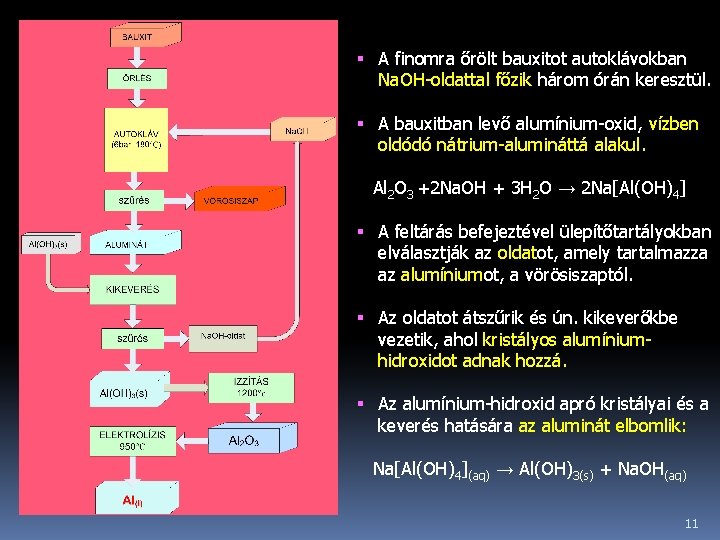
Ipari előállítása Bauxitból történik két lépésben: ü a bauxitból először lúgos feltárással timföldet (Al 2 O 3) állítanak elő, majd ü a timföld elektrolízisével tiszta alumíniumot kapnak. A gyártáshoz használt bauxit ásvány összetétele a következő: Al 2 O 3 40 -60% Víz 12 -30% Fe 2 O 3 7 -30% Si. O 2 1 -15% Ti. O 2 3 -4% F, P 2 O 5, V 2 O 5 0, 05 -0, 2% A timföldgyártás főleg Baeyer-féle eljárással történik. 10

A finomra őrölt bauxitot autoklávokban Na. OH-oldattal főzik három órán keresztül. A bauxitban levő alumínium-oxid, vízben oldódó nátrium-alumináttá alakul. Al 2 O 3 +2 Na. OH + 3 H 2 O → 2 Na[Al(OH)4] A feltárás befejeztével ülepítőtartályokban elválasztják az oldatot, amely tartalmazza az alumíniumot, a vörösiszaptól. Az oldatot átszűrik és ún. kikeverőkbe vezetik, ahol kristályos alumíniumhidroxidot adnak hozzá. Az alumínium-hidroxid apró kristályai és a keverés hatására az aluminát elbomlik: Na[Al(OH)4](aq) → Al(OH)3(s) + Na. OH(aq) 11

A Na. OH-oldatot visszavezetik a bauxit lúgos feltárásának folyamatába. Az alumínium-hidroxidot 1200°C-on forgókemencében kiizzítják (kalcinálják), vagyis timfölddé – tiszta Al 2 O 3 -dá alakítják. 2 Al(OH)3 → Al 2 O 3 + 3 H 2 O A kapott Al 2 O 3 –ot kriolittal keverik, hogy az olvadáspontja 935°C-ra csökkenjen (a tiszta timföld olvadáspontja 2050°C). A megolvasztott keveréket elektrolizálókádakba vezetik. 12

katód (-): anód (+): A képződő oxigén az anód anyagával (szénnel) szénmonoxiddá egyesülve távozik a cellából. 13

A megolvadt alumínium az elektrolizálókád alján gyűlik össze, ahonnan szabályos időközökben lecsapolják, majd tömbökbe öntik és így kerül feldolgozásra. A kinyert alumínium tisztasága 99, 5 -99, 9% között van. Az elektrolízis bruttó folyamata: 14

Élettani jelentősége q Az alumíniumsók mérgező hatásúak. A szervezetbe jutva megkötik a foszfátokat és rosszul oldódó, alumínium-foszfát keletkezik. Ezáltal a vér foszfáttartalma lecsökken. q Oldott állapotban a fehérjéket irreverzibilisen kicsapja. q Az emésztésben résztvevő enzimek működését lelassítja. Ø A timsót (KAl(SO 4)2· 12 H 2 O), vérzéscsillapítóként és élelmiszeradalékként is használják E 440 kóddal, mint stabilizálót és sav-szabályozót. 15

Felhasználása Ötvözetek formájában repülők, autók gyártására, csomagolóanyagként (alufólia, üdítős dobozok), por alakban redukálószerként, fémek előállítására, fedőfestékként megfelelő kötőanyaghoz keverve (metál festékek), elektromos huzalok gyártása, szerkezeti elemek gyártása, fémek előállítása (aluminotermia), alumíniumvegyületek előállítására. 16

Levegőn állva a felülete már szobahőmérsékleten vékony, tömör és kemény, a további oxidációtól védő, összefüggő oxidréteggel vonódik be. Az oxigénnel magas hőmérsékleten vakító fénnyel egyesül: 4 Al + 3 O 2 → 2 Al 2 O 3 17

Az oxigénnel szembeni reakciókészsége annyira nagy, hogy az ún. aluminotermiás reakciókban a nehezen redukálható fémoxidokból is elvonja az oxigént. Króm(III)oxiddal a következő reakció szerint reagál: Cr 2 O 3 + 2 Al → Al 2 O 3 + 2 Cr A vizet az alábbi egyenlet szerint bontja: 2 Al + 6 H 2 O → 2 Al(OH)3 + 3 H 2 18

Híg savakkal reagálva H 2 -gázt fejleszt a következő reakció szerint: 2 Al + 6 HCl → 2 Al. Cl 3 + 3 H 2 Alkáli bázisok oldataival hidrogénfejlődés közben reagál. 2 Al + 6 H 2 O + 2 Na. OH → 2 Na[Al(OH)4]+ 3 H 2 Az alumínium amfoter tulajdonságú elem, mivel savakkal és bázisokkal egyaránt reakcióba lép. Ilyenkor megfelelő só keletkezik és hidrogén szabadul fel. 19

Halogénekkel hevesen reagál: klórral hőfejlődés közben, brómmal tűztünemény kíséretében. 2 Al + 3 Cl 2 → 2 Al. Cl 3 2 Al + 3 Br 2 → 2 Al. Br 3 Nitrogénnel magas hőmérsékleten egyesülve alumínium-nitridet ad: 2 Al + N 2 → 2 Al. N 20

Vegyületeiben az alumínium oxidációs száma +3. Alumínium-oxid (korund, timföld) – Al 2 O 3: Fehér, vízben oldhatatlan, kemény, magas olvadáspontú vegyület. A természetben több változata fordul elő (korund, zafír, rubin). A γ-Al 2 O 3 -módosulat savban és lúgban egyaránt oldódik (amfoter jellegű vegyület): Al 2 O 3 + 6 HCl → 2 Al. Cl 3 + 3 H 2 O Al 2 O 3 + 2 Na. OH + 3 H 2 O → 2 Na[Al(OH)4] 21

Korund Zafír Rubin 22

Nagy adszorbeáló képessége következtében gyakran használják: ü az adszorpciós analízisben, üa kromatográfiában, üa textiliparban, mint festék megkötőt (pácfestés). 23

Alumínium-hidroxid - Al(OH)3: Fehér színű, vízben gyengén oldódó amfoter vegyület. Alumíniumiont tartalmazó vegyületekből állítható elő bázis segítségével. Al(OH)3 + 3 HCl → Al. Cl 3 + 3 H 2 O 2 Al(OH)3 + 2 Na. OH → 2 Na[Al(OH)4] nátrium-tetrahidroxoaluminát 24

25

Alumínium-szulfát – Al 2(SO 4)3· 18 H 2 O: Színtelen, tű alakú kristályokat képez. Vízmentes alakban fehér porszerű vegyület. Alumínium-hidroxid meleg kénsavban való oldásával állítják elő. Ø Fontos szerepe van a víztisztításban. Ha a szennyezett vízhez alumínium-szulfátot és kalcium-hidroxidot adnak, a közöttük lejátszódó reakcióban kocsonyás alumínium -hidroxid keletkezik, amellyel együtt a vízben levő szennyezőanyagok és mikroorganizmusok is kicsapódnak. 26

Számos hidrátalakja létezik, leggyakrabban hexadekahidrát Al 2(SO 4)3· 16 H 2 O és oktadekahidrát Al 2(SO 4)3· 18 H 2 O formában van jelen. 27

Alumínium-klorid-hexahidrát – Al. Cl 3 · 6 H 2 O: Színtelen, vízben jól oldódó, higroszkópos vegyület. Vizes oldata a hidrolízis következtében savas kémhatású. Alumíniumforgácsból állítják elő száraz sósavgázban történő hevítéssel. A kőolaj feldolgozásakor és a szerves reakcióknál katalizátorként használják elektronpár megkötő képessége miatt. 28

29

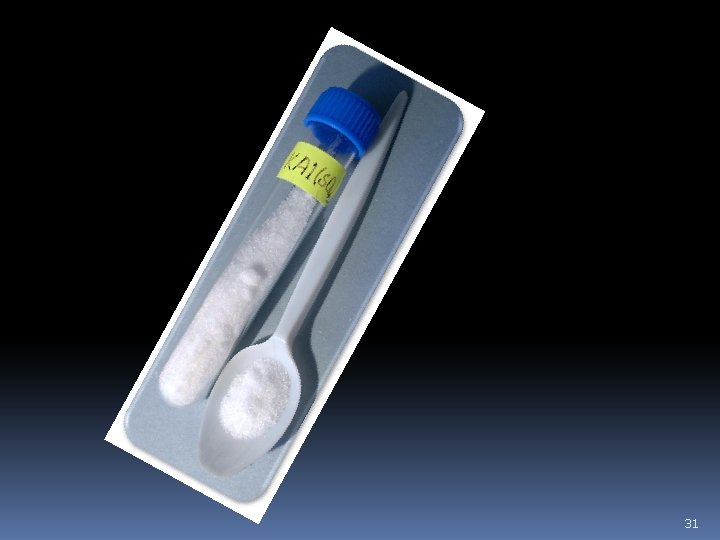
Káliumtimsó – KAl(SO 4)2· 12 H 2 O: Színtelen, oktaéderes kristályos, fanyar ízű vegyület, amely a természetben is előfordul. Ipari előállítása a bauxit kénsavas feltárásával történik. Hideg vízben gyengén, melegben pedig jól oldódik. Vizes oldata savas kémhatású. Víz tisztítására, a gyógyászatban pedig vérzéscsillapítóként és enyhe fertőtlenítőszerként használják. 30

31

A CSOPORT TÖBBI ELEME 32

BÓR A természetben csak ásványaiban fordul elő. Fontosabb ásványai a: nyersbórax (Na 2 B 4 O 7· 10 H 2 O), kernit (Na 2 B 4 O 7· 4 H 2 O) és az ulexit (Na 2 Ca 2 B 10 O 18· 16 H 2 O). Előállítása ásványaiból történik redukcióval. Az elemi bór szobahőmérsékleten nem reakcióképes. A hőmérséklet növelésével a reakcióképessége nagymértékben növekszik. 700°C-on meggyullad és bór-trioxiddá (B 2 O 3) ég el. A lángot zöldre festi. 33

Fontosabb vegyületei: boránok: kellemetlen szagú gáz vagy cseppfolyós halmazállapotú bór-hidrogének. A diborán (BH 3)2, például színtelen, mérgező gáz, amely a szerves kémiában használatos redukálószer. bórsav (H 3 BO 3): Fehér, vízben könnyen oldódó kristályos vegyület. Vizes oldata gyenge sav, amely fertőtlenítő hatású. bórax (Na 2 B 4 O 7· 10 H 2 O): színtelen, kristályos vegyület 34

Bór 35

GALLIUM q Ezüstösen csillogó, lágy és jól nyújtható fém. Levegőn állva a felülete vékony oxidréteggel vonódik be. q Csak vegyületei formájában, a cinkércek és a bauxit kísérőanyagaként fordul elő. q A cink- és alumíniumgyártás melléktermékeként gallium is keletkezik. q A gallium nitrogéncsoport elemeivel alkotott vegyületei széles körben használt félvezetők. 36

Gallium 37

Részaránya a földkéregben kb. 10 -5%, tehát olyan gyakori, mint az ezüst. Levegőn állva a felülete vékony oxidréteggel vonódik be, amely védi a fémet a víz és savak hatásaitól. Csak ásványai formájában fordul elő a cink- és ólomércek kísérőanyagaként. Előállítása a cink-, ólom- és kadmium-gyártás során keletkező melléktermék elektrolízisével történik. 38

Indiumtömb Indiumhuzal 39

TALLIUM q Fémesen csillogó, lágy, jól nyújtható, nehézfém. q Csak ásványai formájában fordul elő a cink-, réz- és ólomércek kísérőanyagaként. q A tallium és vegyületei nagyon mérgezőek. 40