1 CSOPORT IA CSOPORT Vegyszetilelmiszeripari Kzpiskola CSKA Ksztette

![AZ ALKÁLIFÉMEK FONTOSABB ADATAI Fontosabb adatok Elektronegativitás Pauling szerint Ei (I. ) [k. J/mol] AZ ALKÁLIFÉMEK FONTOSABB ADATAI Fontosabb adatok Elektronegativitás Pauling szerint Ei (I. ) [k. J/mol]](https://slidetodoc.com/presentation_image_h2/6ab5468d434d0d6691360abbc478d341/image-4.jpg)
















































- Slides: 61

1. CSOPORT (IA CSOPORT) Vegyészeti-élelmiszeripari Középiskola CSÓKA Készítette: Varga István 1

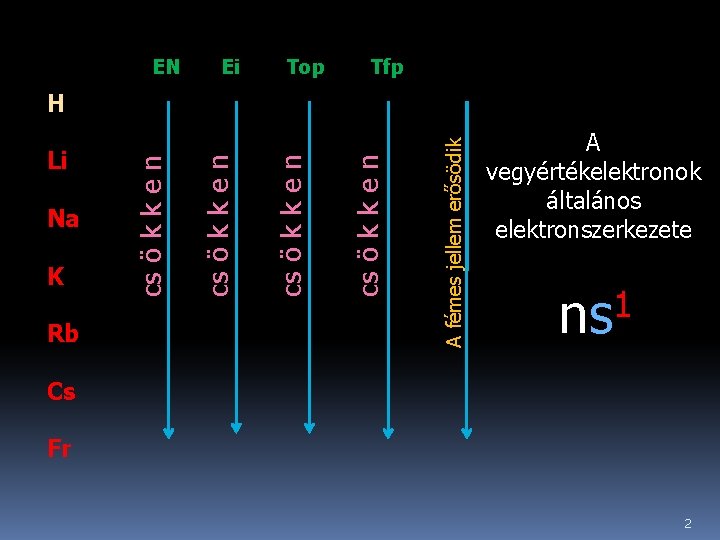
EN Ei Top Tfp A fémes jellem erősödik Rb cs ö k k e n K cs ö k k e n Na cs ö k k e n Li cs ö k k e n H A vegyértékelektronok általános elektronszerkezete 1 ns Cs Fr 2

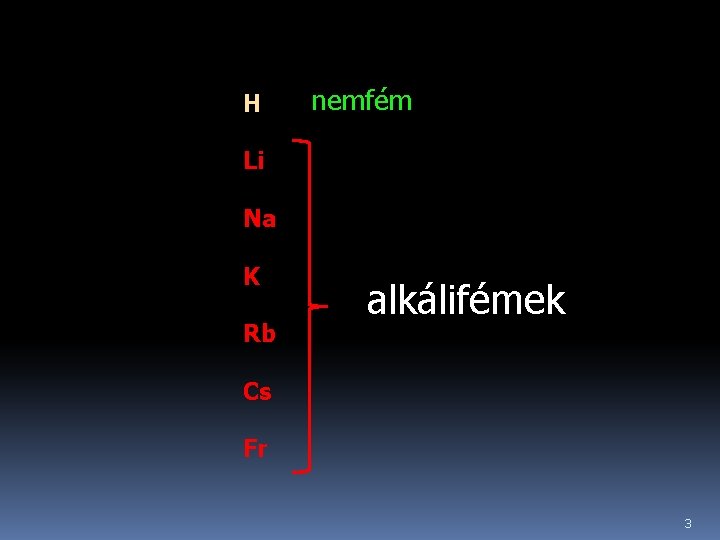
H nemfém Li Na K Rb alkálifémek Cs Fr 3
![AZ ALKÁLIFÉMEK FONTOSABB ADATAI Fontosabb adatok Elektronegativitás Pauling szerint Ei I k Jmol AZ ALKÁLIFÉMEK FONTOSABB ADATAI Fontosabb adatok Elektronegativitás Pauling szerint Ei (I. ) [k. J/mol]](https://slidetodoc.com/presentation_image_h2/6ab5468d434d0d6691360abbc478d341/image-4.jpg)
AZ ALKÁLIFÉMEK FONTOSABB ADATAI Fontosabb adatok Elektronegativitás Pauling szerint Ei (I. ) [k. J/mol] Olvadásponti hőmérséklet [°C] Forrásponti hőmérséklet [°C] Sűrűség [g/cm 3] Lángfestés A bázisok erőssége a nyíl irányában növekszik Li 0, 98 Na 0, 96 K 0, 82 Rb 0, 82 Cs 0, 79 Fr 0, 77 520 180, 5 502 97, 8 420 63, 5 400 38, 9 380 28, 7 380 27 1330 892 760 688 670 677 0, 534 1, 0066 0, 863 1, 532 1, 886 1, 87 piros sárga lila vörös kék - 4

A NÁTRIUM (natrium, sodium, natrijum, натрий) 5

A 6. leggyakrabban előforduló elem, de az alkálifémek közül a nátrium a legelterjedtebb a természetben. 6

A nátriumot Davy angol kémikus fedezte fel 1807 -ben miközben Na. OH-ot elektrolizált. Fontosabb ásványai: Sir Humphry Davy (1778 – 1829) Ø Ø Ø halit (kősó) Na. Cl chilei salétrom Na. NO 3 szóda Na 2 CO 3 glaubersó Na 2 SO 4 kriolit Na 3[Al. F 6] nátriumföldpát Na[Al. Si 3 O 6] 7

A nátrium ezüstfehér színű, erős fémfényű, puha (késsel vágható) paramágneses fém. Elektromos és hővezető képessége a rézének kb. 40%-a. Levegőn gyorsan oxidálódik, ezért levegőtől elzárva tárolják. Kisebb mennyiségű nátriumot általában petróleumban célszerű tárolni. A paramágnesesség párosítatlan elektronokat tartalmazó atomokban és molekulákban fordul elő, amelyek betöltetlen elektronhéjakkal rendelkező ionokat tartalmaznak. 8

A nátrium izotópjai q 13 izotópja ismert. Ezek közül csak a 23 -as tömegszámú stabil (a többi izotóp radioaktív). A két legjelentősebb radioaktív izotópja: 22 Na, felezési ideje 2, 602 év, és a 24 Na, felezési ideje 15 óra. 9

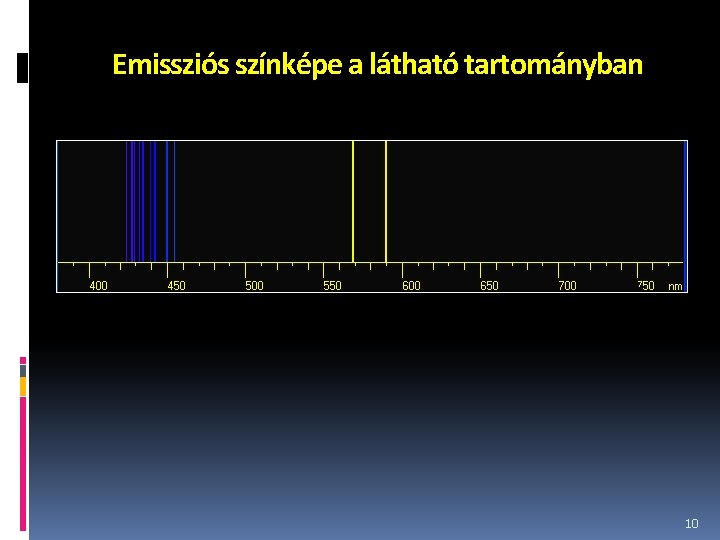
Emissziós színképe a látható tartományban 10

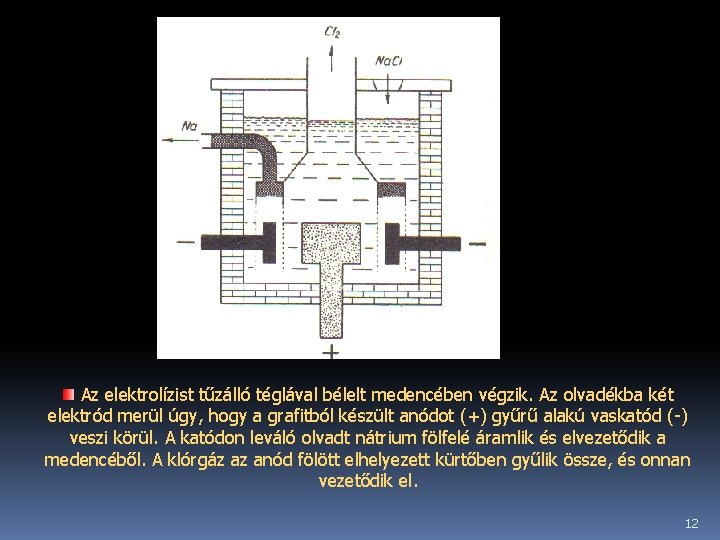
Ipari előállítása Na. Cl vagy 40%-Na. Cl és 60% Ca. Cl 2 összetételű keverék megolvasztásával nyert olvadék elektrolízisével állítják elő. A tiszta Na. Cl 1100°C-on, míg az említett keverék 600°C-on olvad, ezért a keverékből való előállítás gazdaságosabb. katód (-) anód (+) 11

Az elektrolízist tűzálló téglával bélelt medencében végzik. Az olvadékba két elektród merül úgy, hogy a grafitból készült anódot (+) gyűrű alakú vaskatód (-) veszi körül. A katódon leváló olvadt nátrium fölfelé áramlik és elvezetődik a medencéből. A klórgáz az anód fölött elhelyezett kürtőben gyűlik össze, és onnan vezetődik el. 12

Élettani jelentősége Az élő szervezetek számára nélkülözhetetlen. ü A felnőtt ember szervezetében mintegy 83 -97 g nátrium található. Ennek 60 -65%-a test víztereiben, 3540%-a kötött formában, a csontokban, a kötőszövetekben. ü A káliummal szorosan összefüggve, fontos szerepe van a nátrium pumpának: a sejt negatív töltésű ionjai vonzzák a sejten kívül található pozitív nátrium ionokat, amelyek a sejtfalon áthaladnak, így semlegesíteni tudják a távozott kálium ionok hatását. ü 13

Felhasználása Ø Redukálószerként más fémek előállításakor. Például: Ti. Cl 4 + 4 Na → Ti + 4 Na. Cl Ø Repülőgépmotorok és nagy teljesítményű atomreaktorok hűtőközege (cseppfolyós állapotban). Ø Nátriumlámpákban (nagyon jó fényhasznosulás, de a színe miatt csak korlátozottan használható: pl. az erős narancssárga fényű utcai lámpákban). Ø Szerves vegyületek víztelenítésére. Ø Festék-, lakk- és műkaucsuk-gyártás során. 14

Kémiai tulajdonságai Alacsony a standardpotenciálja, ezért jó redukálószer. Levegőben elégetve dinátrium-peroxid keletkezik. 2 Na + O 2 → Na 2 O 2 Vízzel heves, exoterm reakció közben nátriumhidroxid és H 2 -gáz fejlődik: 2 Na + 2 H 2 O → 2 Na. OH + H 2 15

Híg savakkal reagálva H 2 -gázt fejleszt a következő reakció szerint: 2 Na + 2 HCl → H 2 + 2 Na. Cl A halogén elemekkel szintén hevesen reagál, miközben megfelelő nátrium-halogenid keletkezik. Klórral a reakcióban fehér Na. Cl keletkezik a következő reakció szerint: 2 Na + Cl 2 → 2 Na. Cl A nátrium és vegyületei a lángot sárgára festik. 16

17

Fontosabb vegyületei Vegyületeiben a nátrium oxidációs száma +1. q Nátrium-klorid (konyhasó, kősó) – Na. Cl: Színtelen, szagtalan, kristályos (ionrácsos), magas olvadáspontú, nem nedvszívó vegyület. Szilárd állapotban lapközepes kockarácsot alkot. Az ionrácsot pozitív nátrium (Na+) és negatív klorid (Cl−) ionok alkotják. Az ionokat erős elektrosztatikus vonzóerő - az ionkötés tartja össze. Minden pozitíviont, hat negatívion, és minden negatíviont hat pozitívion vesz körül. 18

Olvadáspont: 801°C Forráspont: 1465 °C Sűrűség: 2, 16 g/cm 3 Kősókristály Konyhasó Cl--ionok Na+-ionok 19

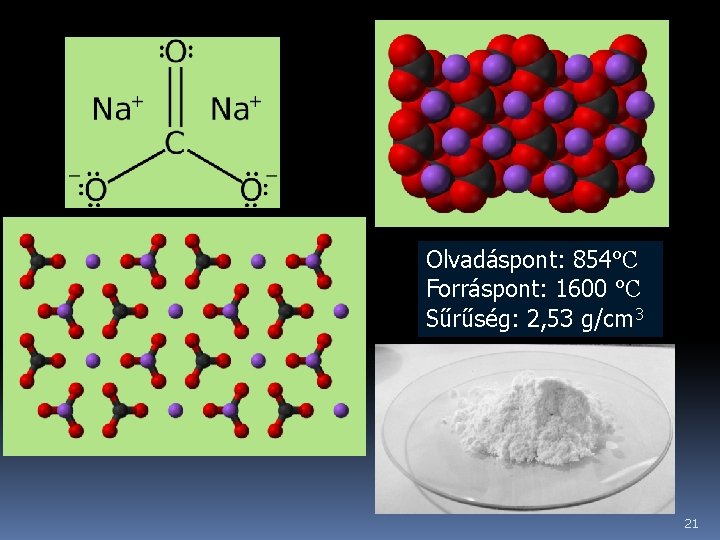
q Nátrium-karbonát (szóda, kalcinált szóda, sziksó) – Na 2 CO 3: A természetben is előforduló nátriumvegyület. Vízmentes állapotban fehér porszerű vegyület (kalcinált szóda), amely vízben hőfejlódés közben oldódik. Vizes oldata bázisos kémhatású a karbonátion hidrolízise miatt. 20

Olvadáspont: 854°C Forráspont: 1600 °C Sűrűség: 2, 53 g/cm 3 21

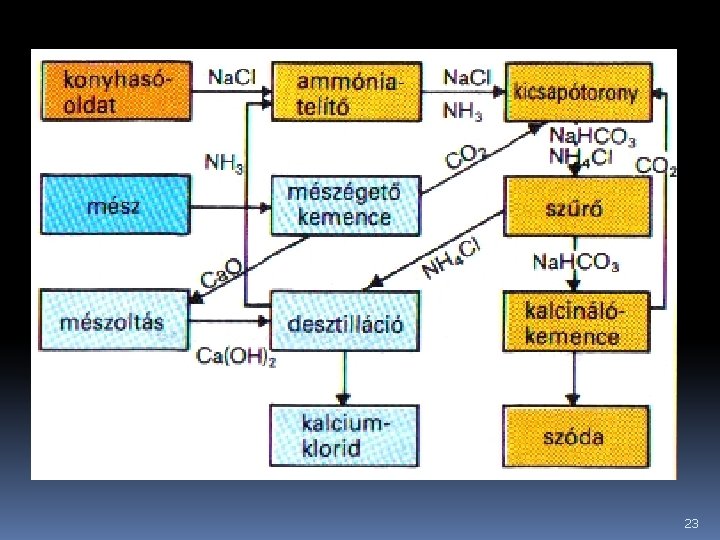
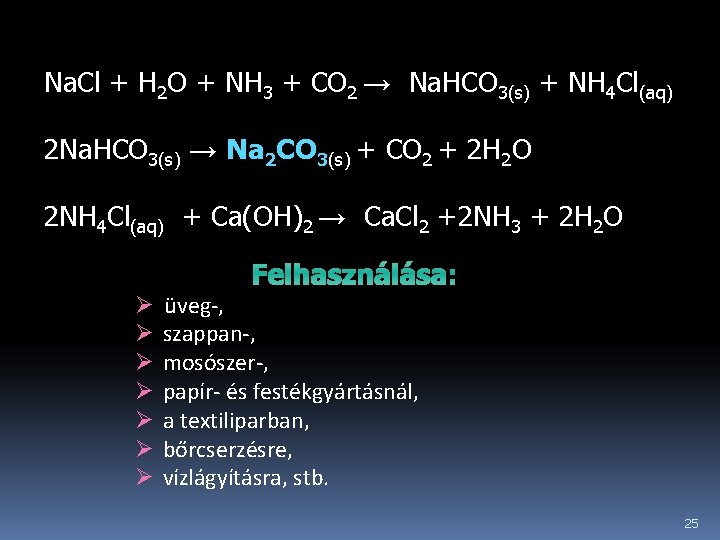
Ipari előállítása Solvay-féle (ammóniás) eljárással történik konyhasóból, ammóniából és szén-dioxidból úgy, hogy a telített Na. Cl-oldatba először ammóniát, majd CO 2 -gázt vezetnek. NH 4 HCO 3 kelet-kezik, ami a konyhasóval reagálva Na. HCO 3 -ot és NH 4 Cl-ot ad. A Na. HCO 3 az oldat hűtésekor kikristályosodik, míg az NH 4 Cl oldatban marad. 22

23

A kristályos Na. HCO 3 -ot szűréssel elválasztják az oldattól, majd 180°C-on hevítve (kalcinálás) szódává alakítják. A hevítés során felszabaduló szén-dioxidot visszavezetik a folyamatba. Az NH 4 Cl-ot tartalmazó oldatból Ca(OH)2 oldat segítségével felszabadítják, regenerálják az ammóniát és visszavezetik a folyamatba. 24

Na. Cl + H 2 O + NH 3 + CO 2 → Na. HCO 3(s) + NH 4 Cl(aq) 2 Na. HCO 3(s) → Na 2 CO 3(s) + CO 2 + 2 H 2 O 2 NH 4 Cl(aq) + Ca(OH)2 → Ca. Cl 2 +2 NH 3 + 2 H 2 O Ø Ø Ø Ø Felhasználása: üveg-, szappan-, mosószer-, papír- és festékgyártásnál, a textiliparban, bőrcserzésre, vízlágyításra, stb. 25

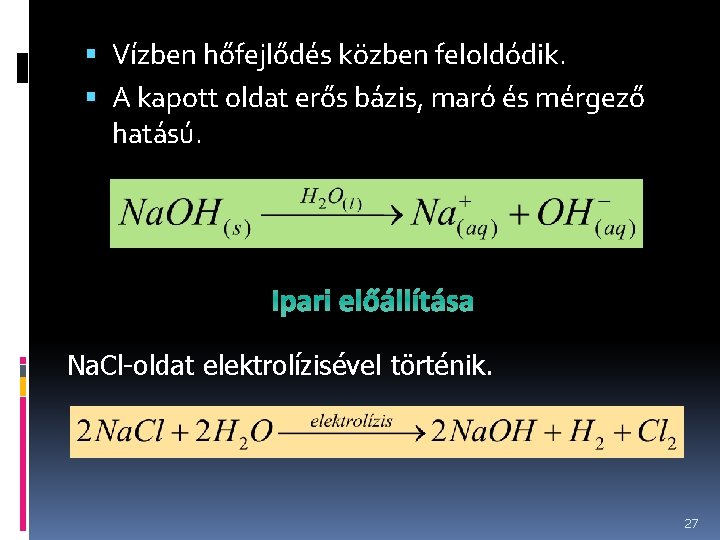
Nátrium-hidroxid (marónátron, zsírszóda, kőszóda) – Na. OH: Fehér színű, kristályos, higroszkópos vegyület. Levegőn tartva először elfolyósodik, majd a levegő szén-dioxidjával egyesülve nátrium-karbonáttá alakul. 26

Vízben hőfejlődés közben feloldódik. A kapott oldat erős bázis, maró és mérgező hatású. Ipari előállítása Na. Cl-oldat elektrolízisével történik. 27

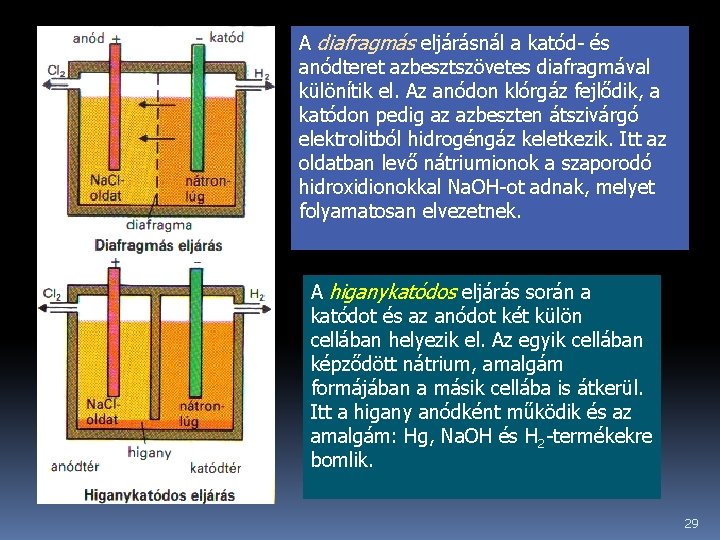
A katód- és az anódteret el kell választani egymástól, hogy a katódon képződött hidroxidionok ne reagálhassanak az anódon képződött klórral valamint, hogy a hidrogén és a klór ne képezzenek klórdurranógázkeveréket. A katód- és anódtér elkülönítésének módja alapján kétféle eljárást különböztetünk meg: - a diafragmás- és - higanykatódos eljárást. 28

A diafragmás eljárásnál a katód- és anódteret azbesztszövetes diafragmával különítik el. Az anódon klórgáz fejlődik, a katódon pedig az azbeszten átszivárgó elektrolitból hidrogéngáz keletkezik. Itt az oldatban levő nátriumionok a szaporodó hidroxidionokkal Na. OH-ot adnak, melyet folyamatosan elvezetnek. A higanykatódos eljárás során a katódot és az anódot két külön cellában helyezik el. Az egyik cellában képződött nátrium, amalgám formájában a másik cellába is átkerül. Itt a higany anódként működik és az amalgám: Hg, Na. OH és H 2 -termékekre bomlik. 29

Felhasználása: Ø timföldgyártás, Ø szappangyártás, Ø cellulóz-, műselyem- és papírgyártás, tisztítószerek gyártása, Ø kőolajtermékek tisztítása. Ø Híg vizes oldatát fertőtlenítésre is fel lehet használni. 30

Nátrium-szulfát (glaubersó) – Na 2 SO 4: A természetben is előforduló színtelen, kristályos vegyület. +32°C alatt dekahidrát formájában, míg +32°C fölött vízmentes állapotban kristályosodik. 31

Iparilag kősóból állítják elő magnéziumszulfát segítségével. 2 Na. Cl + Mg. SO 4 → Na 2 SO 4 + Mg. Cl 2 Felhasználása: Nagy mennyiségben használja az üveg-, papír- és textilipar. 32

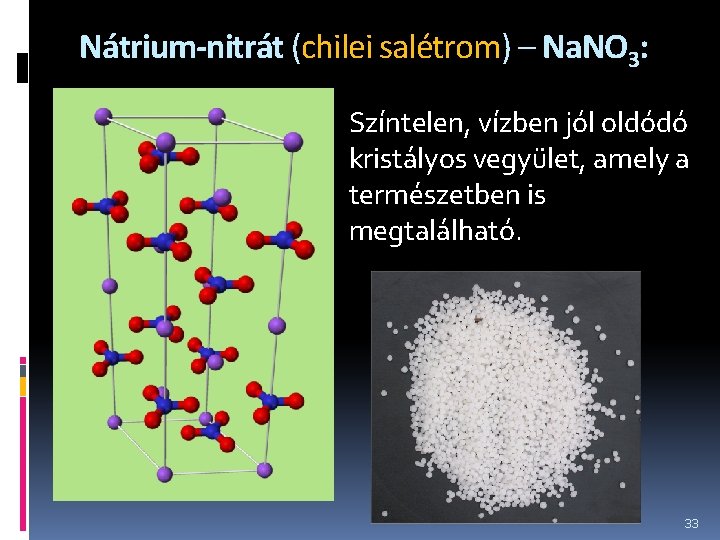
Nátrium-nitrát (chilei salétrom) – Na. NO 3: Színtelen, vízben jól oldódó kristályos vegyület, amely a természetben is megtalálható. 33

Ipari előállítása szódából és salétromsavból történik a következő reakció szerint: Na 2 CO 3 + 2 HNO 3 → 2 Na. NO 3 + H 2 O + CO 2 Elsősorban nitrogéntartalmú műtrágya gyártására használják, de egyes robbanóanyagok gyártásánál is fontos nyersanyag. 34

A KÁLIUM (kallium, potassium, kalijum, калий) 35

A 7. leggyakrabban előforduló elem. 36

q Humphry Davy állított elő 1807 -ben, KOHolvadék elektrolízisével. q Nagy reakcióképessége miatt csak vegyületei (ásványai) alakjában fordul elő, mint amilyenek a: káliumföldpát K[Al. Si 3 O 8] muszkovit KAl 2[Al. Si 3 O 10](OH, F)2 szilvin KCl karnalit KMg. Cl 3· 6 H 2 O glaserit K 3 Na(SO 4)2 37

A kálium ezüstfehér színű (a nátriumnál kissé sötétebb), erős fémfényű, puha (késsel vágható) paramágneses, jó elektromos- és hővezető fém. Levegőn gyorsan oxidálódik, ezért levegőtől elzárva tárolják. Kisebb mennyiségű káliumot általában petróleumban célszerű tárolni. 38

A kálium izotópjai q A káliumnak 24 ismert izotópja van. Ebből három fordul elő a természetben: 39 K - 93, 3%-ban, 40 K - 0, 0117%-ban (radioaktív felezési ideje 1, 25· 109 év) és 41 K - 6, 7%-ban. 39

Emissziós színképe a látható tartományban 40

Ipari előállítása KOH-olvadék elektrolízisével. KCl redukálásával magas hőmérsékleten kb. 870°C-on elemi nátrium segítségével a következő reakció szerint: KCl + Na → K + Na. Cl KF-ból kalcium-karbiddal 1000 -1100°C-on: 2 KF + Ca. C 2 → Ca. F 2 + 2 K + 2 C 41

Élettani jelentősége Az élő szervezetek számára nélkülözhetetlen. ü A szervezetben az ingerület-átvitelben van elengedhetetlen szerepe a nátriummal együtt. üEzen kívül fontos még az izomműködéshez, a sejtek energiaellátásában és a sav-bázis egyensúly fenntartásában. ü Az emberi szervezetben körülbelül 150 gramm kálium található. Hiánya ritkán alakul ki (például hányás, hasmenés esetén), akkor izomgyengeség, szívműködési problémák léphetnek fel és a vesék is károsodhatnak. ü 42

Felhasználása Ø A 42 -es tömegszámú K-izotópot az orvosi diagnosztikában Ø Egyes szerves vegyületek szintézisénél Ø KO 2 előállítására Ø Más káliumvegyületek előállítására. 43

Kémiai tulajdonságai Reakcióképesebb a nátriumnál. Oxigénnel közvetlenül KO 2 (kálium-szuperoxidot) képez a következő reakció szerint: K + O 2 → KO 2 Vízzel heves, exoterm reakció közben káliumhidroxid és H 2 -gáz fejlődik: 2 K + 2 H 2 O → 2 KOH + H 2 44

Peroxid és oxid a következő reakciók szerint keletkezik: 2 K + 2 O 2 → K 2 O 4 + 6 K → 4 K 2 O A halogén elemekkel szintén hevesen reagál, miközben megfelelő kálium-halogenid keletkezik. Klórral a reakcióban fehér KCl keletkezik a következő reakció szerint: 2 K + Cl 2 → 2 KCl 45

A hidrogénnel, mint más alacsony standardpotenciálú fémek, kálium-hidridet (KH) képez. 2 K + H 2 → 2 KH Savakkal nagyon heves exoterm reakcióban megfelelő sók keletkeznek és hidrogéngáz szabadul fel. Például, sósavval: 2 K + 2 HCl → 2 KCl + H 2 A kálium és vegyületei a lángot fakóibolya színűre festik. 46

47

Fontosabb vegyületei Vegyületeiben a kálium oxidációs száma +1. q Kálium-klorid (szilvin) – KCl: Fehér, kristályos vegyület. Gazdasági szempontból ez a legfontosabb káliumsó. Nagy mennyiségű KCl-ot használnak káliumműtrágyaként, mert a kálium a növények növekedési ütemét nagyban befolyásolja. ü Előállítása karnalitból történik (KCl·Mg. Cl 2· 6 H 2 O) frakcionált kristályosítással. 48

K+ Cl− Olvadáspont: 776°C Forráspont: 1500 °C Sűrűség: 1, 98 g/cm 3 49

Kálium-karbonát (hamuzsír) – K 2 CO 3: Fehér, porszerű, higroszkópos anyag. Vízben jól oldódik. Vizes oldata bázisos kémhatású. Ipari előállítása KOH-ból történik CO 2 segítségével. 2 KOH + CO 2 → K 2 CO 3 + H 2 O Ø Kenőszappanok és káliumüveg előállításánál használják. 50

Olvadáspont: 891°C Forráspont: elbomlik Sűrűség: 2, 29 g/cm 3 51

Kálium-nitrát (salétrom) – KNO 3: Fehér, kristályos vegyület, amely 350°C-ig hőálló. E hőmérséklet fölött kálium-nitritté alakul. Nem higroszkópos. Előállítása chilei salétromból történik KCl segítségével, a következő reakció szerint: Na. NO 3 +KCl → KNO 3 + Na. Cl Ø Lőporgyártásra valamint műtrágyaként használják. 52

Olvadáspont: 334°C Forráspont: 400°C-on elbomlik Sűrűség: 2, 11 g/cm 3 53

Kálium-szulfát (arkanit) – K 2 SO 4: Színtelen, rombos kristályosszerkezetű anyag, amely nem higroszkópos. Vízben csak kis mértékben oldódik. Ø Szinte kizárólag műtrágyaként használják. 54

Kálium-hidroxid (marókáli, kálilúg) – KOH: Fehér, higroszkópos vegyület. Vízben hőfejlődés közben jól oldódik. Vizes oldata erősebb bázis, mint a nátrium-hidroxid. Előállítása KCl vizes oldatának elektrolízisével történik. Ø Mosószerek, vízlágyítók és kenőszappanok készítésére, valamint CO 2 abszorbeálására használják. 55

Olvadáspont: 406°C Forráspont: 1379°C Sűrűség: 2, 04 g/cm 3 56

Kálium-szuperoxid (KO 2): Narancssárga kristályos anyag. Szén-dioxid hatására nagy mennyiségű oxigén szabadul fel belőle, ezért tengeralattjárókban, űrhajókban oxigénforrásként szolgál: 4 KO 2 + 2 CO 2 → 2 K 2 CO 3 + 3 O 2 57

58

LÍTIUM Az elemek gyakorisági sorában a 27. helyen áll. A természetben csak vegyületei formájában fordul elő. Előállítása Li. Cl-olvadék elektrolízisével történik. Fontosabb vegyületei Li. Cl: Szárítószerként használják, mivel nagyon higroszkópos vegyület. Li. H: Rakéta-üzemanyagok alkotórésze. Li. Al. H 4: Erős redukálószerként használatos egyes szerves vegyületek szintézisénél. 59

RUBÍDIUM Az elemek gyakorisági sorában a 21. helyen áll. A természetben csak vegyületei formájában fordul elő. Fontosabb vegyületei: Rb. Cl, Rb 2 CO 3 és a Rb. OH. CÉZIUM Az elemek gyakorisági sorában a 21. helyen áll. A természetben csak vegyületei formájában fordul elő. Fontosabb vegyületei a: Rb. Cl, Rb 2 CO 3 és a Rb. OH. FRANCIUM Egyike a legritkábban előforduló elemeknek. Az egész földkéregben kb. 50 g-nyi francium van. Uránásványokban fordul elő, mint az urán bomlási terméke. 60

Li Cs 61




























