Unidad Mtodo cientfico y composicin de la materia

![¿De qué está formada la materia? Materia [Bariónica] [Todo aquello que ocupa un volumen ¿De qué está formada la materia? Materia [Bariónica] [Todo aquello que ocupa un volumen](https://slidetodoc.com/presentation_image_h2/3a7ebea20cde5fb66a3e0629b7eba5d6/image-2.jpg)
















- Slides: 26

Unidad: Método científico y composición de la materia Imagen extraída de: Unlp. cl Fuente: Archivos departamento / Química Ed. Santillana 2008 -2018
![De qué está formada la materia Materia Bariónica Todo aquello que ocupa un volumen ¿De qué está formada la materia? Materia [Bariónica] [Todo aquello que ocupa un volumen](https://slidetodoc.com/presentation_image_h2/3a7ebea20cde5fb66a3e0629b7eba5d6/image-2.jpg)
¿De qué está formada la materia? Materia [Bariónica] [Todo aquello que ocupa un volumen y tiene masa] Sustancias Puras [Se puede representar por fórmulas] Mezclas de sustancias [Se pueden separar las sustancias] Moléculas Homogéneas y Heterogéneas Elementos Compuestos Formados por sólo un tipo de átomos Formados por dos o más átomos Elementos o compuestos que se agrupan en estado gaseoso Átomos: unidad mínima y estable que forma toda la materia

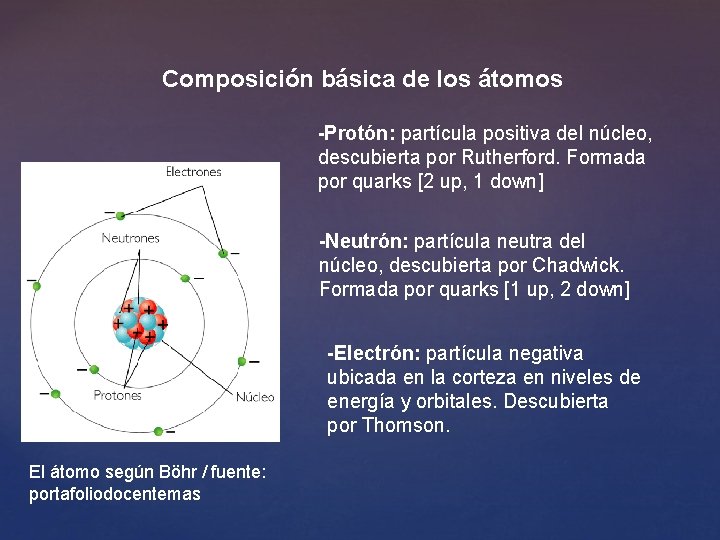
Composición básica de los átomos -Protón: partícula positiva del núcleo, descubierta por Rutherford. Formada por quarks [2 up, 1 down] -Neutrón: partícula neutra del núcleo, descubierta por Chadwick. Formada por quarks [1 up, 2 down] -Electrón: partícula negativa ubicada en la corteza en niveles de energía y orbitales. Descubierta por Thomson. El átomo según Böhr / fuente: portafoliodocentemas

Ampliando conocimientos ¿Los átomos tienen otras partículas? Sí, bastantes más y que se estudian en la química cuántica y la física de las partículas. Fuente: udlp. cl Ejemplos: • Bosón • Positrón • Fermión • Lepton • Neutrino • Hadrón • Quark [up, down, charm, strange, top, bottom] • Mesón

Representando los átomos: Modelos atómicos Autor Año Modelo Propuesto Características Demócrito 460 a. C. – 370 a. C. Átomos de fuego, agua, aire y tierra. Átomos son eternos, indestructibles y la materia cambia según el movimiento, formas y dimensiones de sus átomos. John Dalton 1808 Átomo es una esfera sólida, indivisible y sin carga. Los átomos del mismo elemento tienen igual masa y propiedades. Joseph Thomson 1897 Modelo budín de pasas. Los átomos tienen cargas positivas y la negativa (electrones) están incrustadas en el.

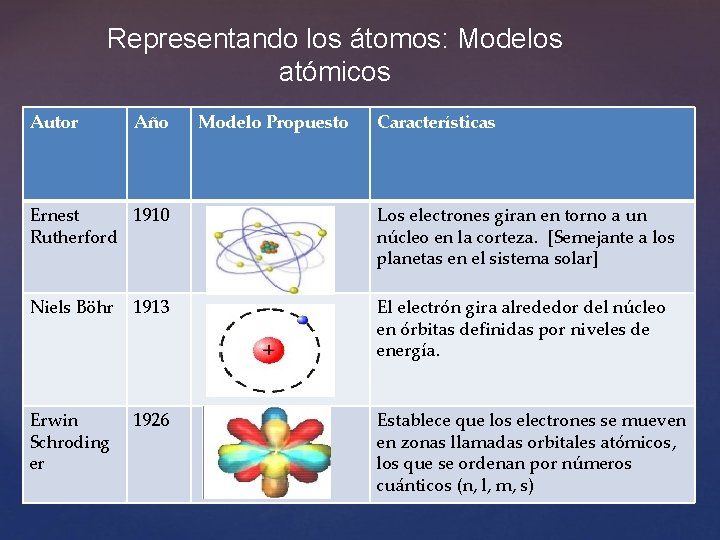
Representando los átomos: Modelos atómicos Autor Año Modelo Propuesto Características Ernest 1910 Rutherford Los electrones giran en torno a un núcleo en la corteza. [Semejante a los planetas en el sistema solar] Niels Böhr 1913 El electrón gira alrededor del núcleo en órbitas definidas por niveles de energía. Erwin Schroding er 1926 Establece que los electrones se mueven en zonas llamadas orbitales atómicos, los que se ordenan por números cuánticos (n, l, m, s)

Algunos conceptos del modelo cuántico. -El átomo está formado por partículas fundamentales (protón, neutrón, electrón, lepton, etc. ) -El núcleo contiene la mayor cantidad de masa y tiene carga positiva (debida al protón). -En el átomo se observan niveles de energía ordenados desde menor (más cerca del núcleo) a mayor (más externo). -Los electrones se mueven en zonas llamadas orbitales. Cada orbital se designa con letras s, p, d, f. etc.

Algunos conceptos del modelo cuántico. -Los electrones del átomo se pueden caracterizar por números cuánticos. -Los números cuánticos son 4: ü n: número cuántico principal o nivel de energía. ü l: número cuántico secundario azimutal. Señala el tipo de orbital. ü m: número cuántico magnético. Indica las orientaciones espaciales del orbital. ü s: número cuántico de giro o spín. Señala el giro del electrón.

Ahora tú 1) Cada modelo atómico fue aportando conocimiento sobre el átomo y su estructura, pero fueron modificándose con el tiempo. Identifica para cada modelo, anterior al actual, aquello que se mantiene hasta hoy y lo que ha cambiado y por qué. Ejemplo: a) Democrito, mantiene que la materia está formada por átomos (al menos la bariónica) y se cambió que los átomos fueran de fuego, aire, agua y tierra. 2) ¿En qué se diferencia una órbita de un orbital? Justifica con un ejemplo. 3) Investiga: ¿Qué características tienen las otras partículas que hay en el átomo?

¿Cómo representar los elementos químicos? Se usan símbolos químicos que encontramos en la tabla periódica. Los elementos químicos son sustancias formadas solo por un tipo de átomos. Poseen una cantidad determinada de electrones, los que se ordenan siguiendo los principios del modelo cuántico. Fuente: dreamtime. es

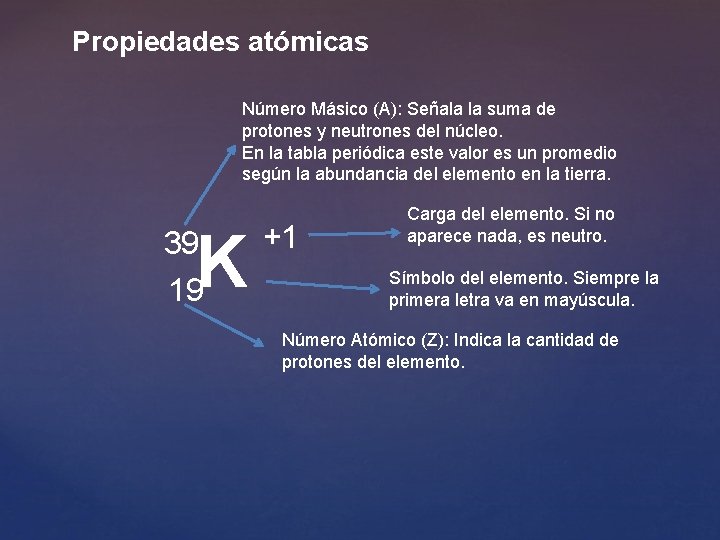
Propiedades atómicas Número Másico (A): Señala la suma de protones y neutrones del núcleo. En la tabla periódica este valor es un promedio según la abundancia del elemento en la tierra. K 39 19 +1 Carga del elemento. Si no aparece nada, es neutro. Símbolo del elemento. Siempre la primera letra va en mayúscula. Número Atómico (Z): Indica la cantidad de protones del elemento.

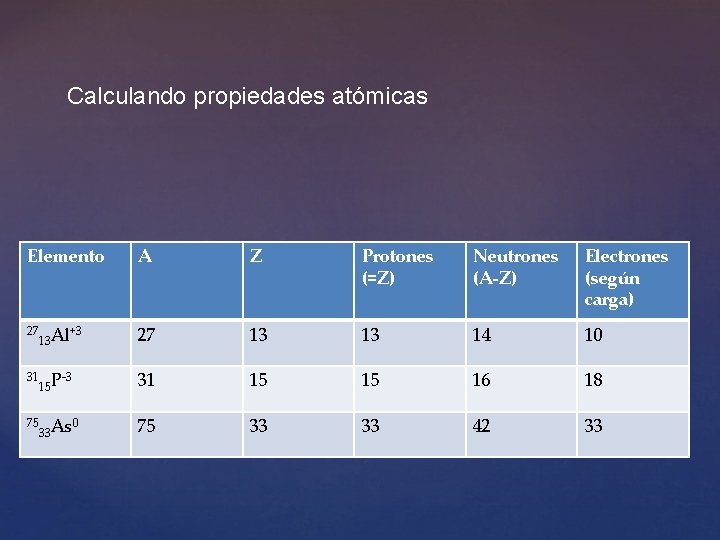
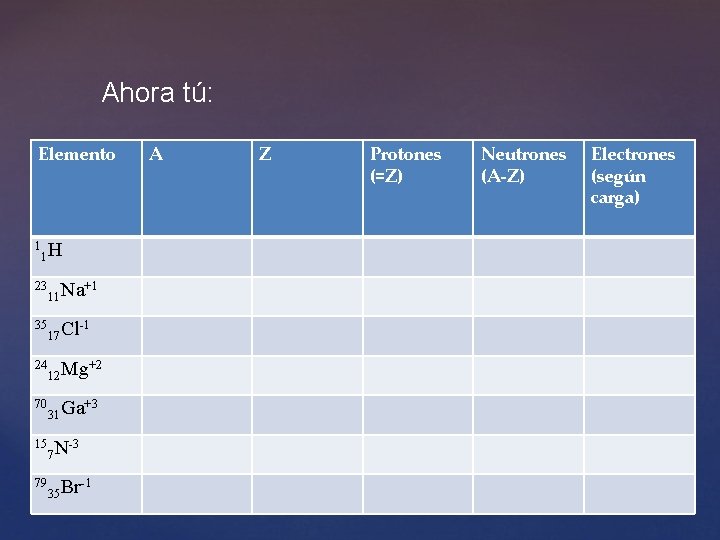
Calculando propiedades atómicas Elemento 27 13 Al 31 15 P 75 33 As +3 -3 0 A Z Protones (=Z) Neutrones (A-Z) Electrones (según carga) 27 13 13 14 10 31 15 15 16 18 75 33 33 42 33

Ahora tú: Elemento 1 1 H 23 11 Na 35 17 Cl 24 12 Mg 70 31 Ga 15 7 N 79 35 Br +1 -1 +2 +3 -3 -1 A Z Protones (=Z) Neutrones (A-Z) Electrones (según carga)

¿Cómo se ordenan los electrones de un átomo? • Para ordenar los electrones, se usa la llamada configuración electrónica. ¿Qué debemos saber para hacer la configuración electrónica? • Conocer la cantidad de electrones del átomo. n • Ubicar los electrones en cada nivel de energía ( ) • Saber la cantidad que se pueden distribuir en los orbitales atómicos. (l) • Aplicar los principios que rigen la configuración.

Principio de Construcción o de Aufbau Diagrama de llenado de orbitales. Fuente: Blog, Física&Química para sec. OS

Principio de Pauling Ningún par de electrones de cualquier átomo puede tener los cuatro números cuánticos iguales… Deben diferenciarse en al menos uno… • Cada orbital acepta como máximo dos electrones, cada uno de los cuales tiene un giro (número cuántico s) o espín contrario…

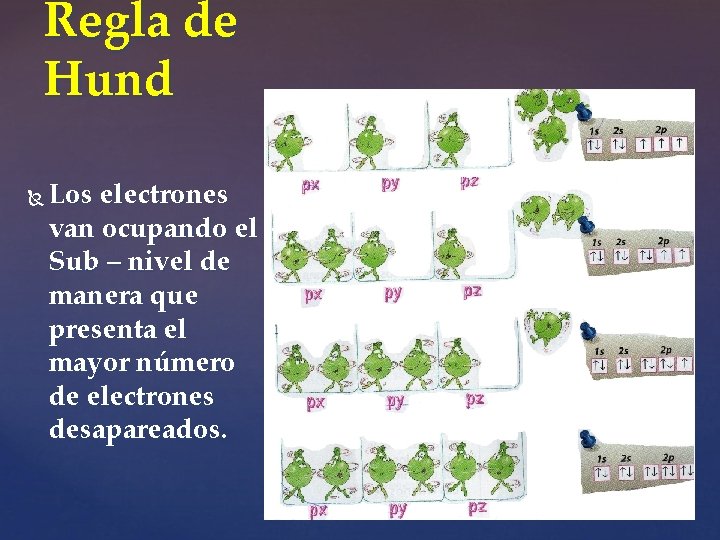
Regla de Hund Los electrones van ocupando el Sub – nivel de manera que presenta el mayor número de electrones desapareados.

Ejemplos: Oxígeno: Neón: Argón: Kriptón: 16 O 8 20 Ne 10 40 Ar 18 84 Kr 36

Ahora tú 35 31 17 Cl 15 P 31 Ga 223 87 Fr 127 53 I 70

Configuración simplificada Cuando la configuración de un elemento es muy extensa, es posible simplificarla mediante el uso de la configuración de los gases nobles o inertes porque son los elementos más estables de la tabla periódica. Por ejemplo, si queremos escribir la configuración simplificada del Francio…

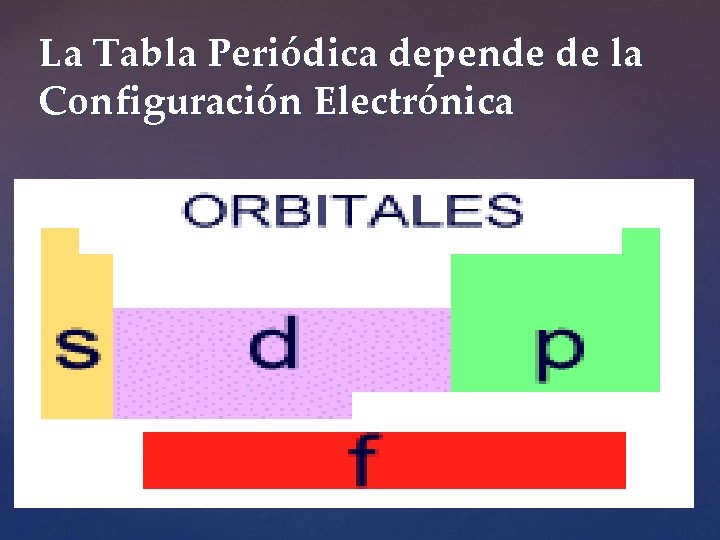
Configuración electrónica y tabla periódica de los elementos. Actualmente sabemos que las configuraciones electrónicas de los elementos están relacionadas con su posición en la Tabla periódica, pues en ella los elementos que tienen un patrón similar de configuración de los electrones de la capa externa están dispuestos en las mismas columnas , mientras aquellos que tienen niveles energéticos muy similares y algunos idénticos se encuentra en las mismas filas

La Tabla Periódica depende de la Configuración Electrónica

¿Cómo se organiza la tabla periódica? Entre 1860 y 1870, el científico ruso Dimitri Mendeleiev y el alemán Julius Lothar Meyer, trabajando en forma independiente, llegaron a organizar los elementos químicos conocidos de acuerdo con su masa atómica, lo que les permitió deducir que en orden creciente de masa los elementos presentaban propiedades similares que se repetían periódicamente, estableciendo la Ley Periódica. Gracias a la cual se ordenaron los elementos de similares características en una misma columna

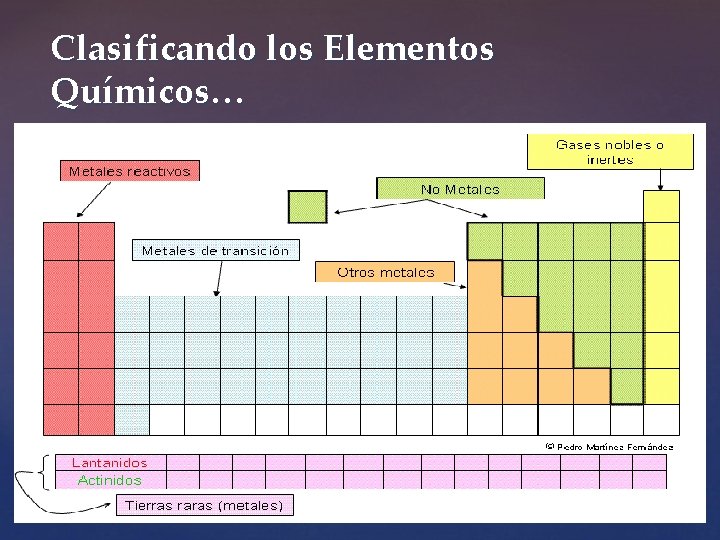
La Tabla Periódica Hoy… -Se organiza por los Números Atómicos (Z), en orden creciente… -Existen Filas Horizontales llamadas Periodos -Y Columnas Verticales denominadas Grupos

Los grupos de la tabla se organizan por números, partiendo de izquierda a derecha. Los grupos van desde el 1 al 18 (en la clasificación actual) o bien en la tabla periódica más común, se organizan en grupos A (elementos representativos) y B (elementos de transición).

Clasificando los Elementos Químicos…
 Caracteristicas del metodo de estudio lser
Caracteristicas del metodo de estudio lser Composicin
Composicin Composicion de color
Composicion de color Decenas centenas y unidades
Decenas centenas y unidades Propiedades organolepticas de la materia
Propiedades organolepticas de la materia Proprietà macroscopiche della materia
Proprietà macroscopiche della materia Ratio materiae
Ratio materiae Materia de la confirmacion
Materia de la confirmacion Piramides troficas
Piramides troficas Passaggi di stato della materia
Passaggi di stato della materia Analisi termica di una sostanza pura
Analisi termica di una sostanza pura La materia está en constante cambio
La materia está en constante cambio Estado de gas
Estado de gas Materia correlativa
Materia correlativa Pirámide ecológica
Pirámide ecológica Flusso di materia
Flusso di materia Agroindustrial
Agroindustrial Materia electoral
Materia electoral Materiaren propietateak
Materiaren propietateak Materia inorgánica
Materia inorgánica Estados de la materia intro
Estados de la materia intro Unidad de medida de lluvia
Unidad de medida de lluvia Materia natura
Materia natura Qu es la materia
Qu es la materia Aud materia plangand
Aud materia plangand Aristóteles potencia
Aristóteles potencia Imágenes de origen inorgánico o mineral
Imágenes de origen inorgánico o mineral

















































