Transplantation rnale dans lamylose AL et les autres








- Slides: 21

Transplantation rénale dans l’amylose AL et les autres MG(C)RS : indications, devenir des greffons Frank Bridoux, Marion Tassery, Florent Joly, Laure Ecotière, Estelle Desport, Vincent Javaugue, Antoine Thierry Service de Néphrologie et Transplantation Rénale, CHU Poitiers RÉUNION RÉGIONALE AMYLOSE Mercredi 24 mars 2021

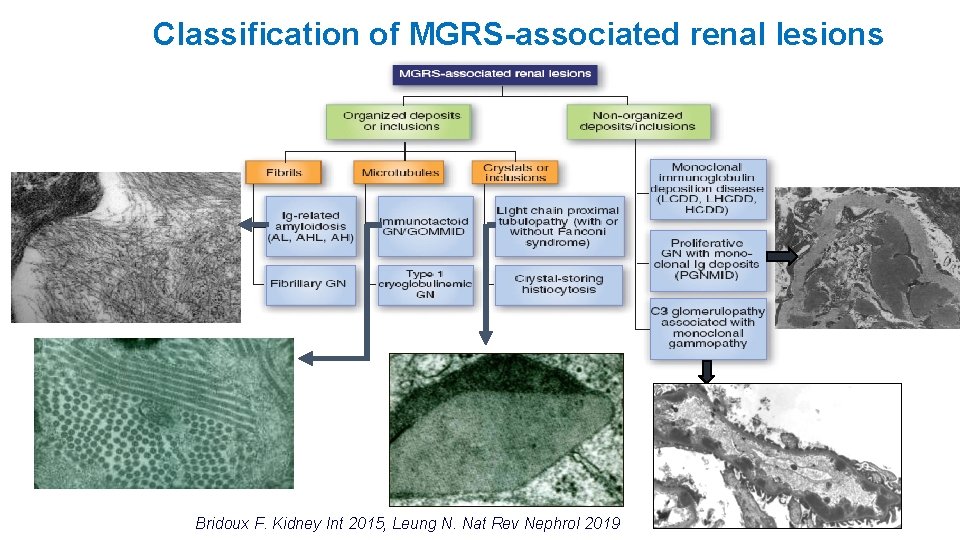
Classification of MGRS-associated renal lesions Bridoux F. Kidney Int 2015, Leung N. Nat Rev Nephrol 2019

Toxicité rénale des Ig monoclonales • Propriété intrinsèque • Indépendante de la taille du clone (exception = NCM) • Déterminée par les caractéristiques physico-chimiques (structure primaire du domaine variable ++) et fonctionnelles (activité anticorps, activation complément…. ) • Récidive à l’identique sur le greffon rénal en l’absence de contrôle du clone plasmocytaire/ lymphocytaire B sous-jacent

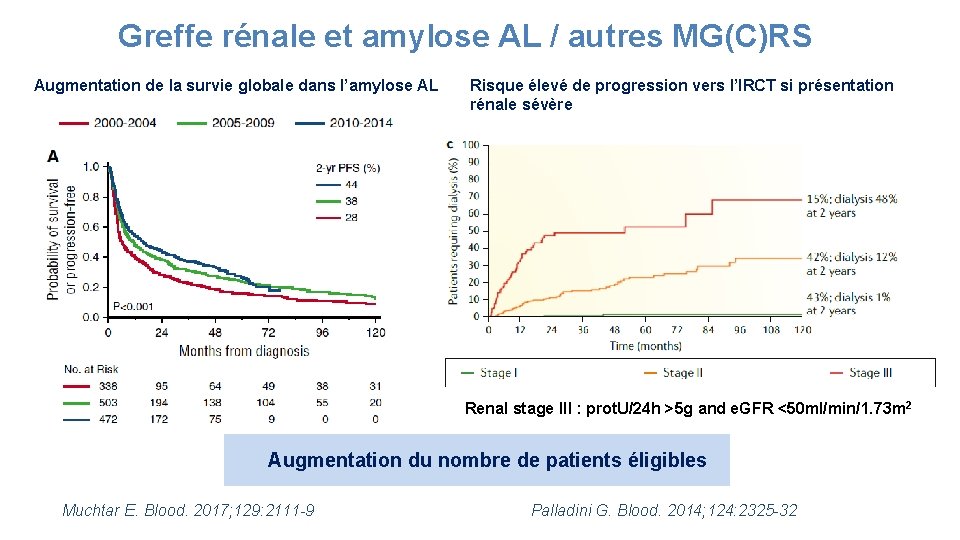
Greffe rénale et amylose AL / autres MG(C)RS Augmentation de la survie globale dans l’amylose AL Risque élevé de progression vers l’IRCT si présentation rénale sévère Renal stage III : prot. U/24 h >5 g and e. GFR <50 ml/min/1. 73 m 2 Augmentation du nombre de patients éligibles Muchtar E. Blood. 2017; 129: 2111 -9 Palladini G. Blood. 2014; 124: 2325 -32

Greffe rénale et amylose AL / autres MG(C)RS • Longtemps controversée (< années 2000) – – Récidive sur le greffon Progression systémique de la maladie Risque de progression hématologique + risque infectieux Contexte de pénurie d’organes Pasternack A et al, Transplantation 1986; 42: 598 -601 Hartmann A et al, Transpl Int 1992; 5: 15 -18 Alpers C et al, Am J Kid Dis 1989; 13: 418 -423 Inscription sur liste de transplantation rénale : En 2011: <10% des patients avec amylose AL en IRCT Pinney JH, et al. , J Clin Oncol 2011; 29: 674 -81

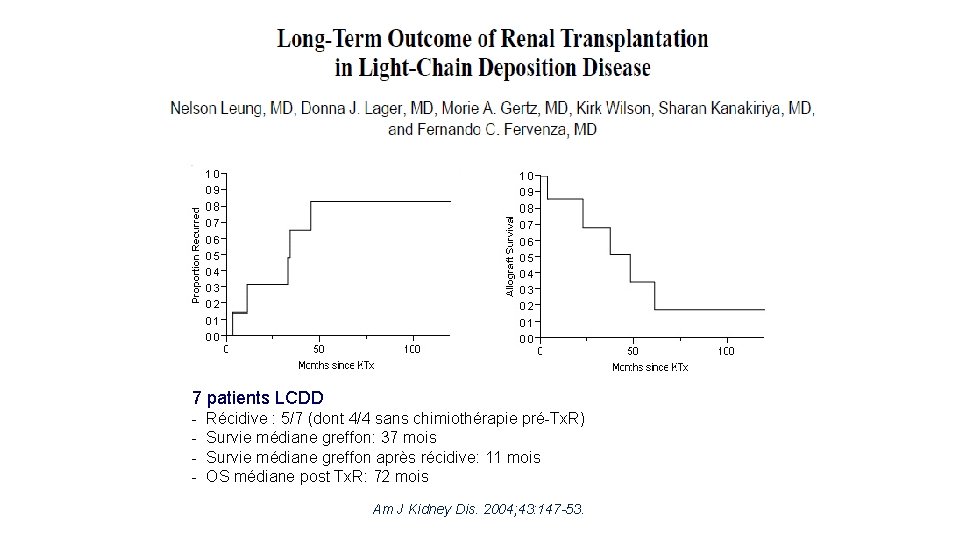
7 patients LCDD - Récidive : 5/7 (dont 4/4 sans chimiothérapie pré-Tx. R) Survie médiane greffon: 37 mois Survie médiane greffon après récidive: 11 mois OS médiane post Tx. R: 72 mois Am J Kidney Dis. 2004; 43: 147 -53. Am J Kidney Dis 2004; 43: 147 -153

Series of 26 patients transplanted for PGNMID: - Disease recurrence rate: 89% - Median time from transplant to diagnostic biopsy : 5. 5 months - Detection within 3 to 4 months post-transplant: 86% of patients - 11 of 25 patients lost their allograft due to PGNMID within mean of 36 months from diagnosis. Nasr et al. Clin J Am Soc Nephrol 2011; 6: 122 -32 Said SM, et al. Kidney Int 2018; 64: 159 -69

Greffe rénale et amylose AL/MG(C)RS: quels patients ? • Quel terrain ? – – Patients souvent âgés (> 60 ans) Co-morbidités fréquentes Durée passée en dialyse Intensité et complications de la chimiothérapie antérieure (infections) • Quel type de néphropathie ? – Diagnostic précis indispensable: vitesse de récidive variable selon le type de MGRS – Manifestations extra-rénales ? • Fréquentes si amylose AL, MIDD, cryoglobulinémie • Bilan d’extension: atteinte cardiaque, SNA/SNP, foie, tube digestif…. • Bilan cardiaque (echo-doppler cardiaque, IRM, holter ECG, suivi des marqueurs cardiaques), EMG, bilan hépatique, ferritinémie, endoscopies digestives….

Greffe rénale et amylose AL/MG(C)RS: quels patients ? • Quel statut hématologique ? – Nature du clone sous-jacent : • Plasmocytaire, lymphocytaire • Caractéristiques cytogénétiques • Eliminer hémopathie symptomatique Bilan hématologique prégreffe complet – Traitement hématologique : • • • Type de chimiothérapie, durée et nombre de lignes Qualité de la réponse hématologique Délai entre fin de la chimiothérapie et Tx. R Possibilité de chimiothérapie post-greffe ? Modalités de la greffe rénale ? ‒ Risque immunologique ‒ Qualité du greffon ? Donneur vivant ? ‒ Modalités du traitement immunosuppresseur : • Risque infectieux et néoplasique ? • Eviter CS et déplétion lymphocytaire ? Prise en charge multidisciplinaire

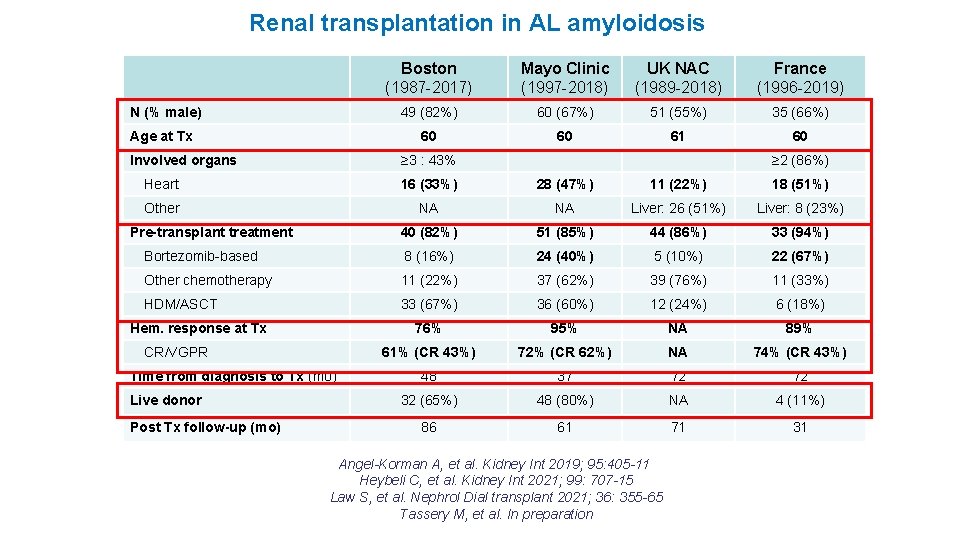
Renal transplantation in AL amyloidosis N (% male) Age at Tx Involved organs Boston (1987 -2017) Mayo Clinic (1997 -2018) UK NAC (1989 -2018) France (1996 -2019) 49 (82%) 60 (67%) 51 (55%) 35 (66%) 60 60 61 60 ≥ 3 : 43% ≥ 2 (86%) Heart 16 (33%) 28 (47%) 11 (22%) 18 (51%) Other NA NA Liver: 26 (51%) Liver: 8 (23%) 40 (82%) 51 (85%) 44 (86%) 33 (94%) Bortezomib-based 8 (16%) 24 (40%) 5 (10%) 22 (67%) Other chemotherapy 11 (22%) 37 (62%) 39 (76%) 11 (33%) HDM/ASCT 33 (67%) 36 (60%) 12 (24%) 6 (18%) 76% 95% NA 89% 61% (CR 43%) 72% (CR 62%) NA 74% (CR 43%) 48 37 72 72 32 (65%) 48 (80%) NA 4 (11%) 86 61 71 31 Pre-transplant treatment Hem. response at Tx CR/VGPR Time from diagnosis to Tx (mo) Live donor Post Tx follow-up (mo) Angel-Korman A, et al. Kidney Int 2019; 95: 405 -11 Heybeli C, et al. Kidney Int 2021; 99: 707 -15 Law S, et al. Nephrol Dial transplant 2021; 36: 355 -65 Tassery M, et al. In preparation

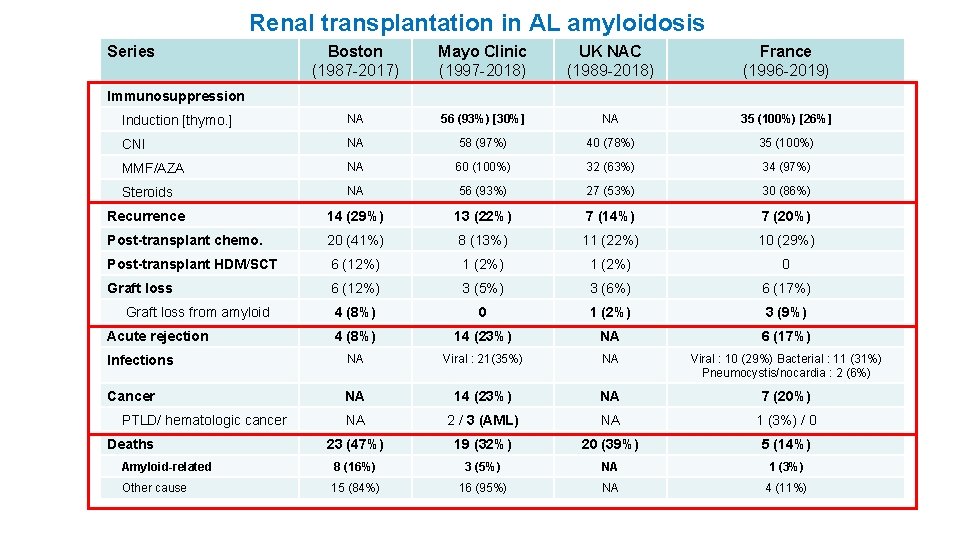
Renal transplantation in AL amyloidosis Series Boston (1987 -2017) Mayo Clinic (1997 -2018) UK NAC (1989 -2018) France (1996 -2019) Induction [thymo. ] NA 56 (93%) [30%] NA 35 (100%) [26%] CNI NA 58 (97%) 40 (78%) 35 (100%) MMF/AZA NA 60 (100%) 32 (63%) 34 (97%) Steroids NA 56 (93%) 27 (53%) 30 (86%) Recurrence 14 (29%) 13 (22%) 7 (14%) 7 (20%) Post-transplant chemo. 20 (41%) 8 (13%) 11 (22%) 10 (29%) Post-transplant HDM/SCT 6 (12%) 1 (2%) 0 Graft loss 6 (12%) 3 (5%) 3 (6%) 6 (17%) 4 (8%) 0 1 (2%) 3 (9%) 4 (8%) 14 (23%) NA 6 (17%) Infections NA Viral : 21(35%) NA Viral : 10 (29%) Bacterial : 11 (31%) Pneumocystis/nocardia : 2 (6%) Cancer NA 14 (23%) NA 7 (20%) NA 2 / 3 (AML) NA 1 (3%) / 0 23 (47%) 19 (32%) 20 (39%) 5 (14%) Amyloid-related 8 (16%) 3 (5%) NA 1 (3%) Other cause 15 (84%) 16 (95%) NA 4 (11%) Immunosuppression Graft loss from amyloid Acute rejection PTLD/ hematologic cancer Deaths

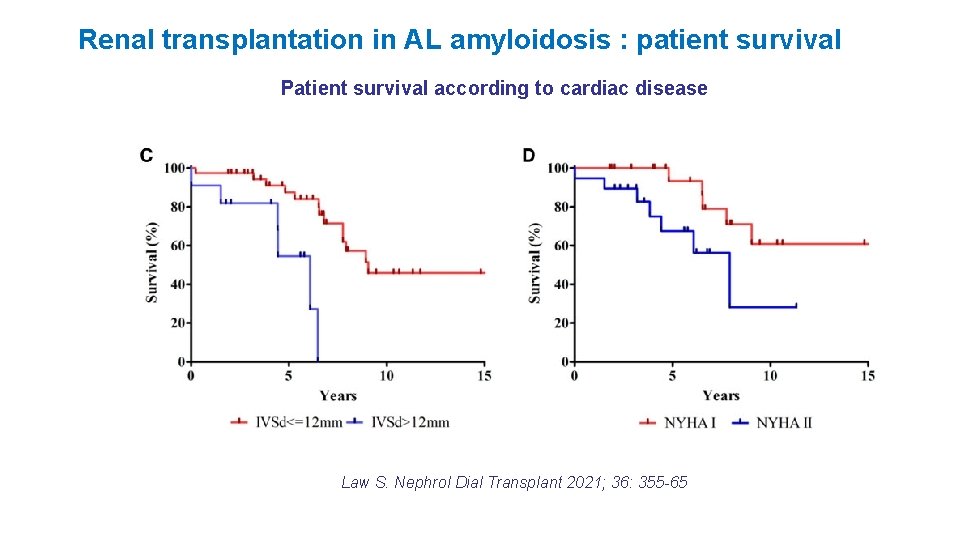
Renal transplantation in AL amyloidosis : patient survival Patient survival according to cardiac disease Law S. Nephrol Dial Transplant 2021; 36: 355 -65

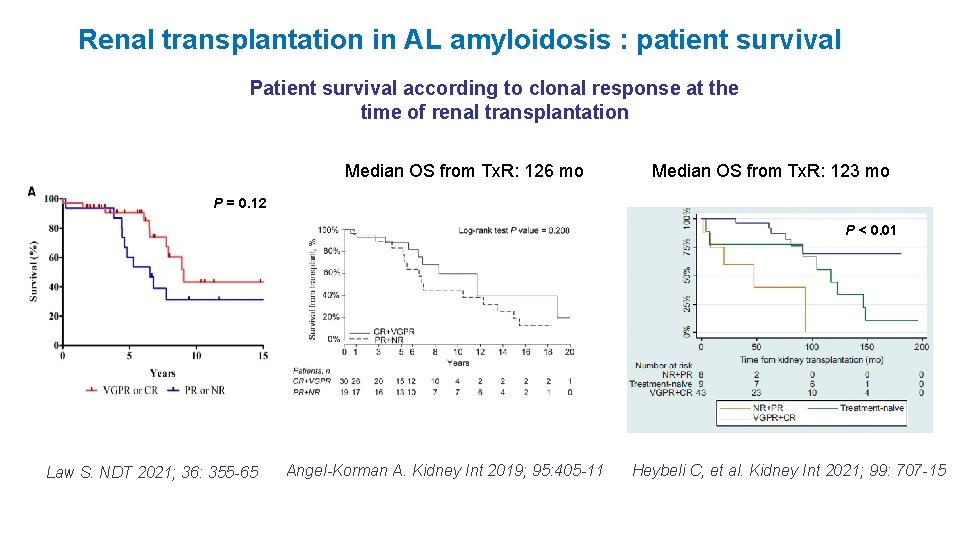
Renal transplantation in AL amyloidosis : patient survival Patient survival according to clonal response at the time of renal transplantation Median OS from Tx. R: 126 mo Median OS from Tx. R: 123 mo P = 0. 12 P < 0. 01 Law S. NDT 2021; 36: 355 -65 Angel-Korman A. Kidney Int 2019; 95: 405 -11 Heybeli C, et al. Kidney Int 2021; 99: 707 -15

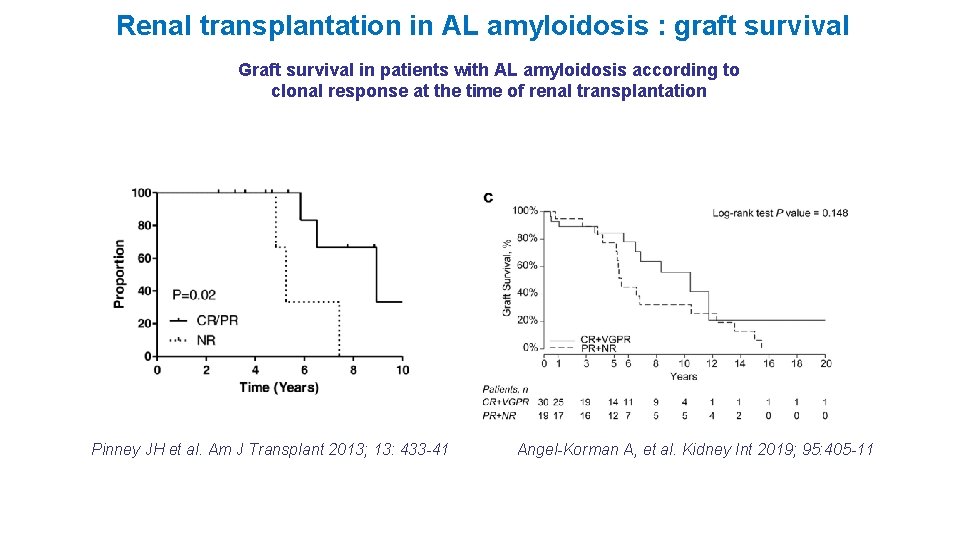
Renal transplantation in AL amyloidosis : graft survival Graft survival in patients with AL amyloidosis according to clonal response at the time of renal transplantation Pinney JH et al. Am J Transplant 2013; 13: 433 -41 Angel-Korman A, et al. Kidney Int 2019; 95: 405 -11

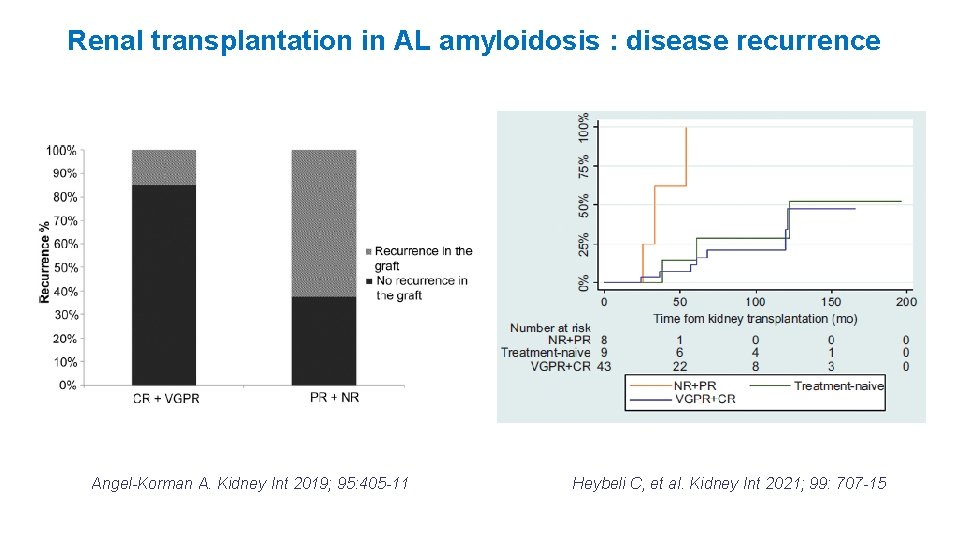
Renal transplantation in AL amyloidosis : disease recurrence Angel-Korman A. Kidney Int 2019; 95: 405 -11 Heybeli C, et al. Kidney Int 2021; 99: 707 -15

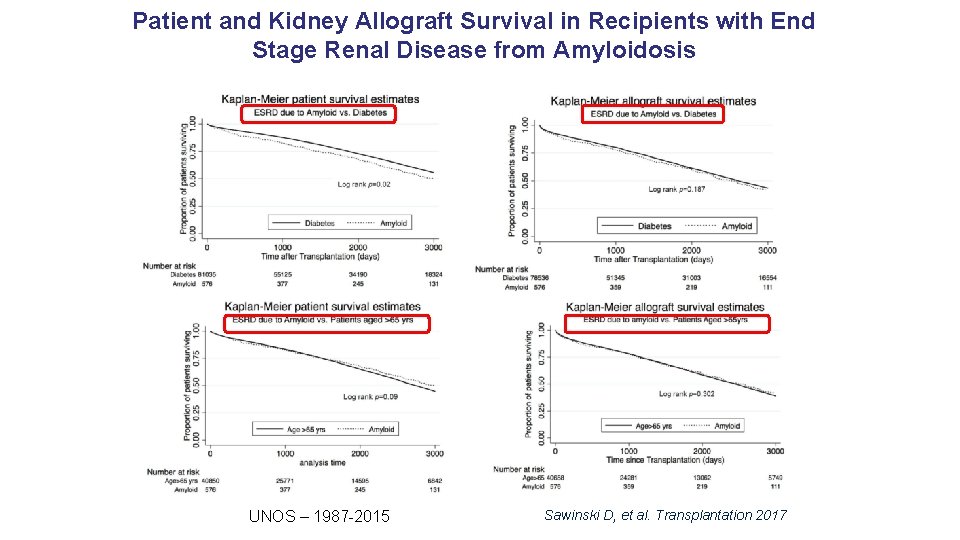
Patient and Kidney Allograft Survival in Recipients with End Stage Renal Disease from Amyloidosis UNOS – 1987 -2015 Sawinski D, et al. Transplantation 2017

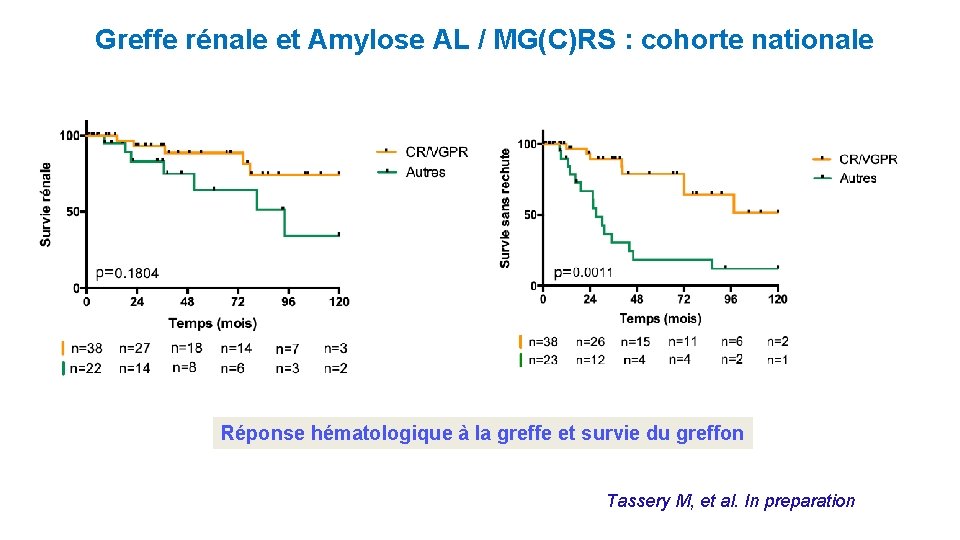
Greffe rénale et Amylose AL / MG(C)RS : cohorte nationale Réponse hématologique à la greffe et survie du greffon Tassery M, et al. In preparation

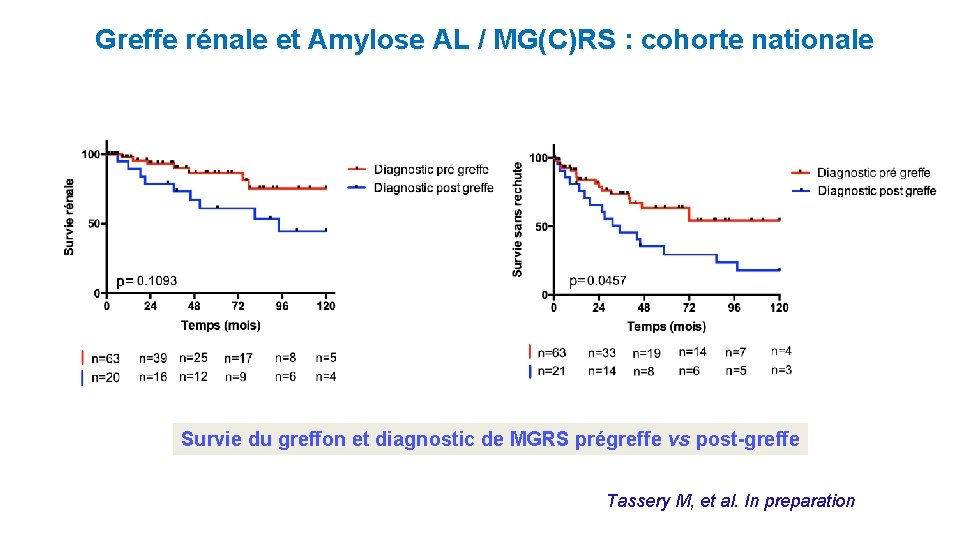
Greffe rénale et Amylose AL / MG(C)RS : cohorte nationale Survie du greffon et diagnostic de MGRS prégreffe vs post-greffe Tassery M, et al. In preparation

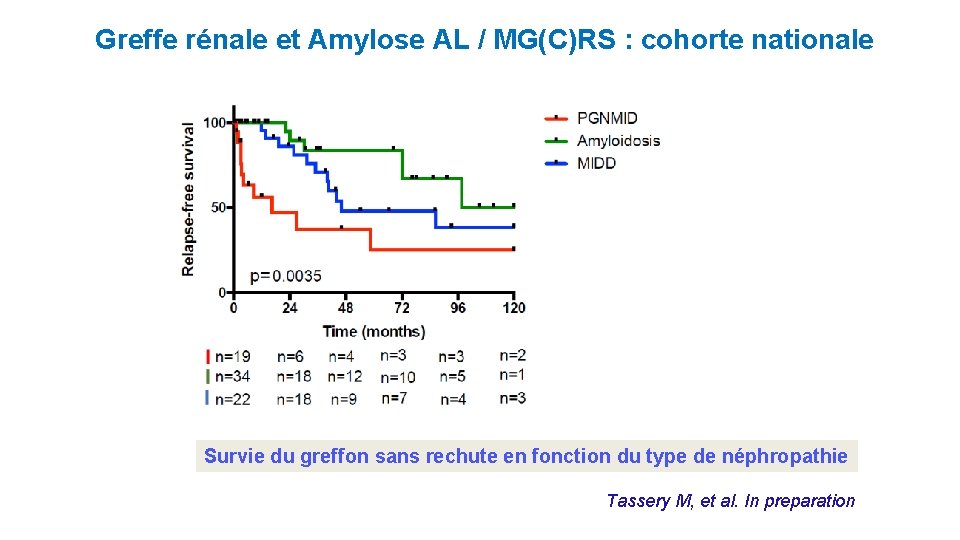
Greffe rénale et Amylose AL / MG(C)RS : cohorte nationale Survie du greffon sans rechute en fonction du type de néphropathie Tassery M, et al. In preparation

Greffe rénale et MG(C)RS : conclusions • Indications croissantes car augmentation de la survie globale • Groupe à risque – Taux élevé de complications infectieuses et néoplasiques (pas de traitement intensif systématique) – Risque de récidive et de progression systémique dépend de la qualité de la réponse hématologique à la greffe – Récidive variable selon le type de néphropathie – Risque de progression hématologique très faible • Pronostic défavorable si diagnostic sur récidive ‒ ‒ Importance du diagnostic histologique de la néphropathie initiale Bilan pré-greffe: immunofixation et FLCs systématiques • Résultats satisfaisants si: – Patients sélectionnés: Réponse hématologique stable à la Tx. R (≥ VGPR) Absence de manifestations extra-rénales sévères – Suivi rapproché post Tx. R et dépistage précoce des récidives hématologique et histologique

Remerciements Services de Néphrologie et Pathologie, CHU Poitiers Marc Bauwens, Simo Belmouaz, Estelle Desport, Laure Ecotière, Guillaume Goussard, Vincent Javaugue, Florent Joly, Audrey Sibille, Antoine Thierry, Guy Touchard Alexia Rinsant, Sihem Kaaki, Cécile Ory, Jean-Michel Goujon CRMR Amylose AL Poitiers-Limoges Arnaud Jaccard, David Lavergne, Elise Michelon, Patricia Allenou-Lemaire CNRS UMR 7276, Limoges Christophe Sirac, Sébastien Bender, Michel Cogné International Kidney and Monoclonal Gammopathy Research group (IKMG) Jean-Paul Fermand, Nelson Leung, Samih Nasr, Virginie Royal
 بحث حول accepter les autres
بحث حول accepter les autres Rnale
Rnale Lamylose
Lamylose La fiche de lecture de la ficelle
La fiche de lecture de la ficelle Ne fait pas aux autres ce que tu n'aimerais
Ne fait pas aux autres ce que tu n'aimerais Ne fait pas aux autres ce que tu n'aimerais
Ne fait pas aux autres ce que tu n'aimerais Bone marrow transplantation sri lanka
Bone marrow transplantation sri lanka Transplant
Transplant Law of transplantation
Law of transplantation Stem cell or bone marrow transplantation bangkok
Stem cell or bone marrow transplantation bangkok Patrick evrard mont godinne
Patrick evrard mont godinne Cultural transplantation examples
Cultural transplantation examples Nous sommes sœurs aussi fragiles que des ailes de papillon
Nous sommes sœurs aussi fragiles que des ailes de papillon Les professeurs 1 of 1 dans la salle de classe.
Les professeurs 1 of 1 dans la salle de classe. Remerciement rapport
Remerciement rapport Texte dopinion
Texte dopinion Guide de la parfaite épouse
Guide de la parfaite épouse Chapitre 49 dernier jour d un condamné
Chapitre 49 dernier jour d un condamné Carte enfer grec
Carte enfer grec Quel beau nom que celui d'emmanuel
Quel beau nom que celui d'emmanuel La situation initiale d'un conte
La situation initiale d'un conte Dans le ciel d abraham
Dans le ciel d abraham