TERMIKA n n Teplo je nejmn uspodan forma
























![HUSTOTA DIFUZNÍHO TOKU [J] dn 1 J = ------dt S S – celková plocha HUSTOTA DIFUZNÍHO TOKU [J] dn 1 J = ------dt S S – celková plocha](https://slidetodoc.com/presentation_image_h/06fd4497ea6066d56677a30efdb45172/image-26.jpg)




- Slides: 32

TERMIKA n n Teplo je nejméně uspořádaná forma energie Teplo je suma všech forem kinetických energií 1 J = 0, 2388 cal 1 cal = 4, 1868 J Teplota – míra střední kinetické energie všech částic Teplota – stavová veličina, kterou vnímáme

MĚŘENÍ TEPLOTY n n objemová roztažnost tekutin vodíkový teploměr kapalinové teploměry délková roztažnost pevných látek l = lo. (1 + α t) bimetalové teploměry keramické teploměry závislost elektrického odporu na teplotě vodičů R = Ro. (1 + α t. . ß t 2 + …) platinové teploměry polovodičů termistory R = A. e. B/T optické metody dotykové – kapalné krystaly

TERMOREGULACE ORGANIZMU n n n z hlediska výměny tepla s okolím je rozhodující velikost povrchu, nikoliv objemu nebo hmotnosti teplota má hlavní význam pro udržení činnosti enzymů zrcadlový efekt jater (při syntéze je minimální degradace a naopak)

Transport tepla v organizmu kondukcí (vedením) mezi orgány dt Q = λ. S. -----. τ dx λ koeficient přestupu tepla τ (tau) čas dt/dx gradient teploty podle vzdálenosti S plocha n

Transport tepla v organizmu n konvekcí (prouděním) krev – transport energie i hmoty Q = α. S. Δt. τ α koef. přestupu tepla přes rozhraní τ čas Δt gradient teploty S plocha

Produkce tepla, energie n n n stanovení přímé – kalorimetricky stanovení nepřímé – ze spotřeby O 2 spalná tepla fyzikální x fyziologická sacharidy a bílkoviny 17 MJ. kg-1 tuky 38 MJ. kg-1 fyziologická využitelnost energie bílkovin je snížena o energii nutnou k detoxikaci dusíkatých látek (močovina, kyselina močová, aminy atd. )

Produkce tepla a omezení transportu tepla do okolí n n n zvýšení bazálního metabolizmu svalový třes izolační vlastnosti pokryvu těla zmenšení povrchu vazokonstrikce

Výdej tepla n n n radiací (u člověka až 60 %) závislá na teplotě okolí a pokryvu těla Q ~ T 4 vedením - nejteplejší jsou játra vazodilatací prouděním evaporace závislá na vlhkosti vzduchu

TERMODYNAMIKA n n umožňuje předvídat, zda je za daných podmínek možný průběh určité reakce v organizmu umožňuje vypočítat energetické změny ve formě tepla nebo práce, které provázejí biochemické procesy

Základní pojmy n n n teplo – nejméně uspořádaná forma energie práce – uspořádaná makrofyzikální forma energie rovnovážný stav systému odpovídá nejpravděpodobnějšímu uspořádání izolovaného systému relaxační doba je mírou přiblížení (difuze plynu 10 -8 s, kapaliny hodiny)

Základní pojmy n n termodynamická pohyblivá rovnováha otevřených systémů - stav, v němž je působení systému na okolí a působení okolí na systém stejné a vzájemné působení dějů uvnitř systému je vyrovnáno termodynamický děj reversibilní prochází řadou na sebe navazujících rovnovážných stavů ireversibilní – všechny děje, které v přírodě probíhají samovolně

I. věta vnitřní energie U ΔU = Q – W n Entalpie H ΔH = ΔU + pΔV exotermická (samovolná) reakce entalpie klesá ΔH < 0 endotermická reakce entalpie roste ΔH > 0 hf 6 CO 2 + 6 H 2 O → C 6 H 12 O 6 + 6 O 2 n ΔH = + 2, 81. 103 k. J. mol-1 h Planckova konstanta f vlnočet

II. věta entropie S (entropo – udávati směr) míra neuspořádanosti systému, přeneseně též neorganizovanosti ΔS = Q / T n u ireversibilních dějů otevřených systémů entropie roste ΔS > 0 - transportem entropie z okolí a do okolí Se - přírůstkem entropie v uvažovaném systému Si n Prigoginova rovnice ΔS = ΔSe + ΔSi n ΔSe 0 ΔSi > 0 => ΔS > 0

Veličiny odvozené z II. termodynamické věty volná energie F (T = k V = k) ΔF = ΔU – T ΔS n volná (využitelná) entalpie – Gibbsova energie G (T = k p = k) ΔG = ΔH – T ΔS entropický člen – vázaná energie n U živého organizmu můžeme považovat T, V, p za přibližně konstantní, pak není významný rozdíl mezi G a F n

Termodynamika živých systémů n n Gibbsova energie představuje tu využitelnou část chemické energie, která může být v systému přeměněna na jiný druh energie nebo na práci. Účinnost živých systémů je až 40 %. Nevyužitá část energie je ve formě tepla vyloučena z organizmu. Tím se organizmus snaží snížit nárůst entropie.

Termodynamika ireverzibilních systémů n n n otevřené systémy směřují k pohyblivé rovnováze, která se vyznačuje minimální entropií přechod otevřeného systému k pohyblivé rovnováze může způsobit dočasný pokles entropie Obecně jsou pohyblivé rovnováhy stabilní. Proti každému pochodu, který je vyvolán vnější silou nebo způsobuje v systému jiný primární děj musí existovat procesy, které se snaží těmto změnám zabránit !

n Při všech ireversibilních procesech musí entropie vzrůstat. Organizmus se však „vyživuje“ komplexními organickými molekulami (z potravy) s vysokou hodnotou volné entalpie G. Při jejich rozkladu používá část volné entalpie G ke svému zachování a část k výstavbě vyšší organizace. Tím se živé organizmy snaží čelit nárustu entropie a samy sebe udržují ve stavu pohyblivé rovnováhy.

n n Z hlediska evoluce vznikem vyšší organizace a diferenciace nových tkání a vznikem nových druhů dochází ke snižování entropie. II. t. v. však neztrácí platnost, neboť platí pro „uzavřený systém“ konkrétního jedince s jeho průběžně voleným okolím. Nárůst entropie konkrétního organismu je představováno jeho stárnutím, které vede k termodynamické smrti. Posmrtný rozklad představuje snahu po dosažení rovnovážného stavu.

Energetické přeměny n n n hydrolýza u převažujících typů vazeb (glykosidická, peptidická, esterová) slabá exotermická reakce G do 12 k. J. mol-1 existují sloučeniny, kde se hydrolýzou získává Gibbsova energie 30 – 50 k. J. mol-1 vazby polyfosfátové, fosfosulfátové, acylfosfátové, thioesterové

Makroergické vazby, fosfáty n n ~ P nebo - P ve skutečnosti je energetický obsah každé sloučeniny dán jejím prostorovým uspořádáním uvolněná energie tedy pochází z celé sloučeniny, nikoliv ze samotné vazby představují zásobárnu energie – energetický „pool“

Energetické přeměny n n hydrolýza je řízena enzymy a díky tomu dochází k postupnému uvolňování energie potrava + O 2 + anorg. fosfáty → ATP → svalová práce, tělesné teplo, atd. nebo přenosové reakce ATP + specifické sloučeniny → specifické vysoce energetické sloučeniny glukóza + ATP → ADP + glukózo-6 -fosfát

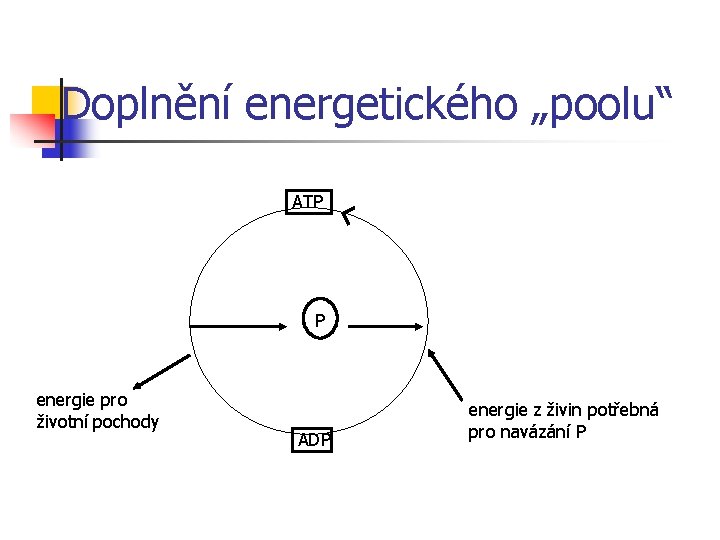
Doplnění energetického „poolu“ ATP P energie pro životní pochody ADP energie z živin potřebná pro navázání P

Doplnění energetického „poolu“ n n n aerobní proces – oxidativní fosforylace spřažená s dýchacím řetězcem anaerobní glykolýza Veškerá energie živin se nejprve převede na chemickou energii (makroergních fosfátů) a teprve pak může být postupně využita ve formě kaskády jednotlivých, enzymy řízených, reakcí.

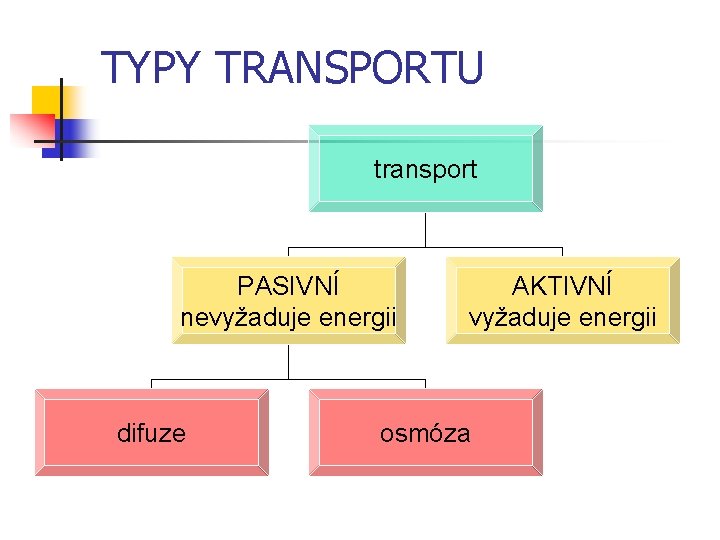
Transportní jevy n n n viskozita vedení tepla difuze, osmóza transport hybnosti transport energie transport hmoty Transp. vel. = - K. Plocha. Gradient

Transport hmoty DIFUZE n n n Rotpuštěná látka přechází z místa o vyšší koncentraci na místo o nižší koncentraci nevyžaduje energii (pasivní transport) cílem je dosažení rovnovážného stavu částice se pohybují neuspořádáným tepelným pohybem v plynech a kapalinách probíhá rychle v pevných látkách pomalu
![HUSTOTA DIFUZNÍHO TOKU J dn 1 J dt S S celková plocha HUSTOTA DIFUZNÍHO TOKU [J] dn 1 J = ------dt S S – celková plocha](https://slidetodoc.com/presentation_image_h/06fd4497ea6066d56677a30efdb45172/image-26.jpg)
HUSTOTA DIFUZNÍHO TOKU [J] dn 1 J = ------dt S S – celková plocha rozhraní J [mol. s-1. m-2] počet molů dn, které projdou za čas dt jednotkovou plochou S = množství látky, vyjádřené počtem molů dn, které projde za sekundu jednotkovou plochou rozhraní dt – časový interval, během kterého projde rozhraním množství látky dn

1. FICKŮV ZÁKON jednosměrná stacionární difuze dc J = - D. ------dx D – difuzní koeficient [m 2. s-1] c – koncentrace x – souřadnice polohy na ose x mínus – koncentrace ve směru osy x klesá vyrovnává zápornou hodnotu poklesu koncentrace na kladnou hodnotu látkového toku 1. Fickův zákon: Hustota difuzního toku J je přímo úměrná koncentračnímu gradientu dc/dx (platí pro jednosměrnou difuzi ve směru osy x; gradient se nemění v čase/iontová pumpa/) D nabývá hodnot od 1. 10 -9 po 1. 10 -12 mikromolekuly makromolekuly

Difuze transport molekul rozpuštěné látky přes buněčnou membránu - vstřebávání látek ve střevě - prostup dýchacích plynů n Pro prostup neelektrolytů platí: J = - P. S. (ce – ci) J látkový tok P permeabilita membrány ce – ci rozdíl extracelulární a intracelulární koncentrace S plocha n

Elektrické jevy na buněčné membráně n n n Orientovaná dvojvrsta lipidů (fosfolipidy, glykolipidy, cholesterol) a integrovaných proteinů Hydrofilní skupiny vně, hydrofobní dovnitř, což vyhovuje termodynamické rovnováze Periferní proteiny určují vlastnosti membrán Vodivost je závislá na fyziologické aktivitě Permitivita (dielektrické vl. ) je stálá εr ~ 10

TYPY TRANSPORTU transport PASIVNÍ nevyžaduje energii difuze AKTIVNÍ vyžaduje energii osmóza

Mechanismy transportu Difuze nespecifická (prostá) n Difuze selektivní (usnadněná) – specifické nosiče, iontové kanály Difuze je závislá na: 1. velikosti elektrochemického gradientu 2. permeabiltě membrány pro daný iont n Pinocytoza – strukturální změny n

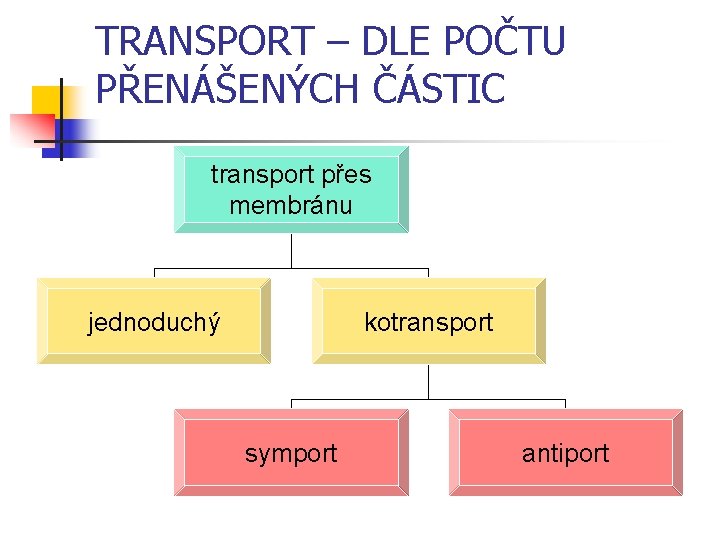
TRANSPORT – DLE POČTU PŘENÁŠENÝCH ČÁSTIC transport přes membránu jednoduchý kotransport symport antiport
 Nejmn
Nejmn Nejmn
Nejmn Teplo test
Teplo test Měrné skupenské teplo topenia tabulky
Měrné skupenské teplo topenia tabulky Skupenské teplo
Skupenské teplo Trojny bod
Trojny bod Ltky
Ltky Skupenské teplo
Skupenské teplo Teplo prezentace
Teplo prezentace Topenie a tuhnutie fyzika
Topenie a tuhnutie fyzika Humphry davy teplo
Humphry davy teplo Co je to teplo
Co je to teplo Joulov pokus
Joulov pokus Teplo je druh
Teplo je druh Fyzika teplo
Fyzika teplo Obloukový ohřev
Obloukový ohřev Co je to teplo
Co je to teplo Teplo a využiteľná energia
Teplo a využiteľná energia Teplota tání
Teplota tání Užitočné trenie
Užitočné trenie Stenotermní organismy
Stenotermní organismy Měrné skupenské teplo tání zlata
Měrné skupenské teplo tání zlata Forma interrogativa negativa francese
Forma interrogativa negativa francese Verbo inseguire forma passiva
Verbo inseguire forma passiva Pronomi personali e possessivi
Pronomi personali e possessivi Esercizi forma attiva e passiva
Esercizi forma attiva e passiva Dalla forma implicita alla forma esplicita
Dalla forma implicita alla forma esplicita Da forma algebrica a forma esponenziale
Da forma algebrica a forma esponenziale Felul adjectivelor prin care se exprima
Felul adjectivelor prin care se exprima Bacilli a forma di molla
Bacilli a forma di molla Malaria
Malaria Mla forma
Mla forma Comparativo di maggioranza latino
Comparativo di maggioranza latino