20 Zmny skupenstv ltek Petr Hladk 4 C

















- Slides: 21

20. Změny skupenství látek Petr Hladík, 4. C listopad 2007

Obsah Fáze Tání a tuhnutí Sublimace a desublimace Vypařování a var Kapalnění Sytá a přehřátá pára Kritický stav látky Fázový diagram

Skupenství je konkrétní forma látky, charakterizovaná především uspořádáním částic v látce a projevující se typickými vlastnostmi. Pro označení skupenství se používá pojem fáze, který je však obecnější než skupenství. Látka může existovat za různých tlaků a teplot v jednom skupenství, ale různých fázích, lišících se např. krystalovou stavbou.

Fáze 1/2 Pevná látka – vyznačuje se pevným, často pravidelným uspořádáním částic. Těleso z pevné látky drží svůj tvar, i když není uzavřeno do nějakého objemu. Podle uspořádání částic se pevné látky dělí na dvě skupiny – krystalické a amorfní. Kapalina – částice jsou relativně blízko sebe, ale nejsou vázány v pevných polohách a mohou se pohybovat v celém objemu. Kapaliny jsou těžko stlačitelné, nemají svůj tvar, mají vlastní objem, mají volný povrch, tvoří kapky. Plyn – částice jsou relativně daleko od sebe, pohybují se v celém objemu a působí na sebe pouze při vzájemných srážkách. Plyny jsou stlačitelné, nemají svůj tvar, objem ani volnou hladinu.

Fáze 2/2 Plazma – Chemie nedokáže popsat chování látek v něm. Z fyzikálního hlediska není jedno zda se jedná třeba o plazma vodíkové nebo heliové. Zda se jedná o plazma můžeme rozhodnout podle některých kolektivních procesů, např. : společné specifické reakce na el. mag. pole. 99 % veškere viditelné hmoty ve vesmíru je ve skupenství plazmatu.

Tání a tuhnutí Tání – přechod z pevné látky na kapalinu. Aby pevná látka začala tát, musíme ji zahřát na teplotu tání. Aby tato látka roztála, je třeba ji dodat skupenské teplo tání. Krystalické látky tají při jedné určité hodnotě teploty tání. Amorfní látka přechází do kapalného skupenství spojitě v určitém intervalu teplot. Nemá přesně daný bod tání, ale při zvyšování teploty postupně měkne. U amorfních látek tedy nelze určit přesnou hranici mezi tím, kdy je látka ve skupenství pevném, a kdy je ve skupenství kapalném. Tuhnutí – skupenská přeměna, při které se kapalina mění na pevnou látku. K tuhnutí dochází při ochlazení kapaliny na teplotu tuhnutí. velikost teploty tuhnutí je pro krystalické látky stejná jako teplota tání. Teplota tání závisí na druhu látky a na vnějším tlaku

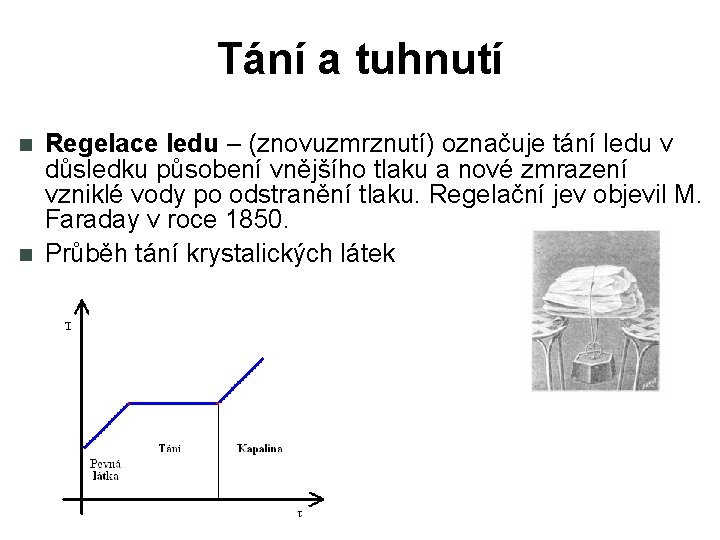
Tání a tuhnutí Regelace ledu – (znovuzmrznutí) označuje tání ledu v důsledku působení vnějšího tlaku a nové zmrazení vzniklé vody po odstranění tlaku. Regelační jev objevil M. Faraday v roce 1850. Průběh tání krystalických látek

Měrné skupenské teplo tání a tuhnutí Měrné skupenské teplo tuhnutí je teplo, které odevzdá 1 kilogram kapaliny, jestliže se za teploty tuhnutí celý přemění na pevnou látku téže teploty. Hodnota měrného skupenského tepla tuhnutí je u krystalických látek pro danou látku stejná jako hodnota měrného skupenského tepla tání. lt =[J·kg-1], m – hmotnost, Lt – skupenské teplo tání

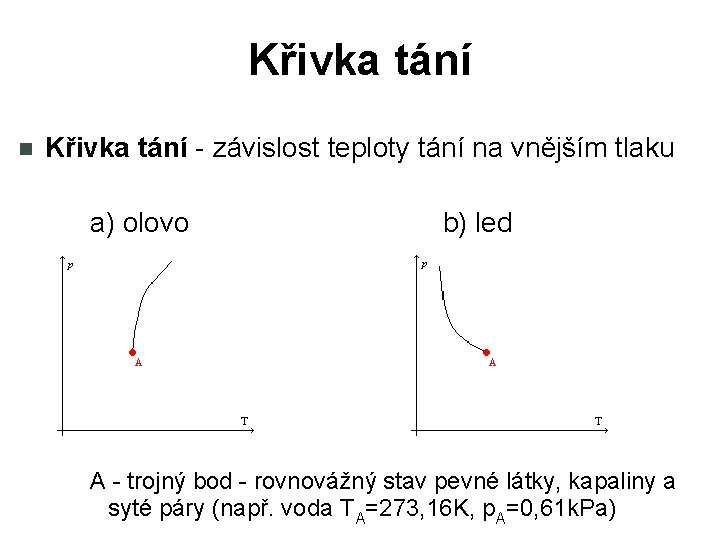
Křivka tání - závislost teploty tání na vnějším tlaku a) olovo b) led A - trojný bod - rovnovážný stav pevné látky, kapaliny a syté páry (např. voda TA=273, 16 K, p. A=0, 61 k. Pa)

Sublimace a desublimace Sublimace – přeměna pevné látky na plyn aniž by došlo k tání. Desublimace – plyn se mění přímo na pevnou látku. Při sublimaci je napětí nasycených par nad pevnou fází vždy nižší než jejich napětí nad kapalnou fází. Za normálního tlaku sublimují např. tyto látky: jód, led, naftalín, salmiak aj. Při dostatečně nízkém tlaku může sublimovat většina látek. Schopnost látky sublimovat zjistíme z jejího fázového diagramu.

Měrné skupenské teplo sublimace je teplo, které odevzdá 1 kilogram pevné látky při sublimaci. m – hmotnost, Ls – skupenské teplo sublimace ls =[J·kg-1] Ls=[J]

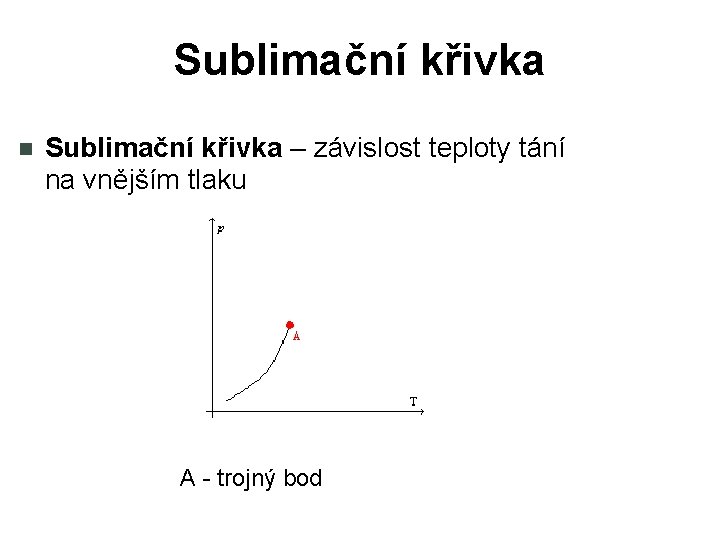
Sublimační křivka – závislost teploty tání na vnějším tlaku A - trojný bod

Vypařování a var Vypařování – dochází k přeměně kapaliny na plyn z volného povrchu kapaliny. Kapalina při vypařování odebírá teplo z okolí. Rychlost vypařování závisí na teplotě, velikosti povrchu. Kapaliny se vypařují za jakékoliv teploty. Var – dochází k přeměně kapaliny na plyn v celém objemu. K varu dochází při zahřátí kapaliny na teplotu varu. Teplota varu je různá pro různé kapaliny. Její velikost závisí také na tlaku nad kapalinou. S rostoucím tlakem stoupá teplota varu – toho se využívá u tlakového (Papinova) hrnce.

Kapalnění Kapalnění (kondenzace) – skupenská přeměna, kdy se mění plyn na kapalinu. Ke zkapalňování nasycené páry dochází snížením její teploty nebo zvýšením tlaku. Při zkapalňování se uvolňuje skupenské teplo kondenzační, jehož hodnota je rovna skupenskému teplu vypařování. Při snižování objemu se přehřátá pára mění v nasycenou a začíná kondenzovat na tzv. kondenzačních jádrech. Kondenzační jádra mohou být částice prachu, ionty apod. Pokud pára kondenzuje na kondenzačních jádrech, je kapalina v páře dispergována (rozptýlena) jako mlha. Nasycená pára je pak s kapalinou v rovnováze. Směs nasycené páry a kapalinové mlhy se nazývá mokrou parou.

Měrné skupenské teplo vypařování a varu Měrné skupenské teplo výparné je třeba určit ke každé teplotě zvlášť (vypařování může probíhat za libovolné teploty), zatímco měrné skupenské teplo varu se určuje k teplotě varu Měrné skupenské teplo varu je teplo, které přijme 1 kilogram kapaliny, jestliže se za teploty varu celý přemění na plyn téže teploty. lv =[J·kg-1], m – hmotnost, Lv – skupenské teplo varu

Měrné skupenské teplo kapalnění Kapalnění neboli kondenzace páry je děj obrácený k vypařování. Měrné skupenské teplo kondenzace má stejnou hodnotu jako lv a stejně se i označuje.

Sytá a přehřátá pára Sytá pára – pára, která je v termodynamické rovnováze s kapalinou o stejné teplotě a tlaku. Při této rovnováze je vypařená látka nahrazena zkondenzovanou (počet molekul opouštějících hladinu je roven počtu molekul, které se do kapaliny vrací). Přehřátá pára – má nižší tlak a hustotu, než sytá pára téže teploty. Přehřátá pára vzniká například zahříváním syté páry bez přítomnosti kapaliny. Přehřátá pára se svými vlastnostmi blíží spíše vlastnostem plynů, a to tím více, čím více se její stav liší od stavu syté páry. Pro přehřáté páry, jejichž stav je daleko od stavu sytých par platí přibližně stavová rovnice ideálního plynu.

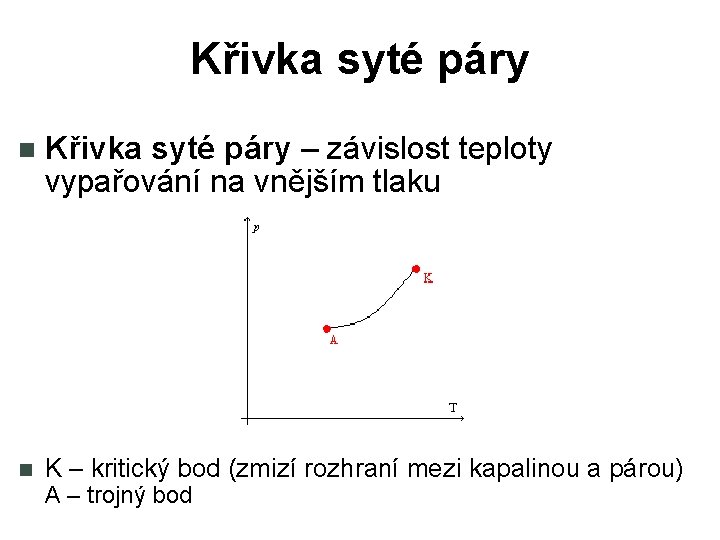
Křivka syté páry – závislost teploty vypařování na vnějším tlaku K – kritický bod (zmizí rozhraní mezi kapalinou a párou) A – trojný bod

Kritický stav látky Kritický bod je bod na fázovém diagramu, který zakončuje křivku vypařování (bod K na obrázku). Tento bod určuje kritický stav látky. Stavové veličiny pk, Tka Vk v tomto bodě se nazývají kritický tlak, kritická teplota a kritický objem. V kritickém stavu mizí rozdíl mezi kapalinou a její párou. Při teplotě vyšší než kritická teplota Tk nemůže látka existovat v kapalném skupenství. Plyn, který má teplotu vyšší než je kritická teplota, nelze žádným stlačováním zkapalnit. V oblasti sycení dochází k vypařování kapaliny (popř. kapalnění par). Nad kritickým bodem K však již oblast sycení neexistuje a k fázové změně tam tedy nemůže dojít.

Fázový diagram s - sublimační křivka p - křivka syté páry t - křivka tání I - pevná látka II - kapalina III - přehřátá pára (má nižší tlak a hustotu než sytá pára též teploty) IV - plyn A - trojný bod - rovnovážný stav pevné látky, kapaliny a syté páry (např. voda TA=273, 16 K, p. A=0, 61 k. Pa) libovolný bod roviny - stav látky za dané teploty a tlaku

Vlhkost vzduchu – udává množství vodní páry obsažené v daném množství vzduchu. Z pohledu meteorologie a klimatologie má množství vodních par zásadní význam, protože je od něho odvislé počasí a podnebí. Absolutní vlhkost vzduchu – vyjadřuje hmotnost vodní páry obsažené v jednotce objemu vzduchu. V meteorologii se vyjadřuje nejčastěji v gramech vodní páry na metr krychlový vzduchu. Relativní vlhkost vzduchu - udává poměr mezi okamžitým množstvím vodních par ve vzduchu a množstvím par, které by měl vzduch o stejném tlaku a teplotě při plném nasycení. Udává se v procentech (%). Φn – absolutní vlhkost vzduchu, m – hmotnost vodní páry, která je ve vzduchu obsažena, M – hmotnost páry při nasycení Vlhkoměr – měřicí přístroj ukazující relativní vlhkost vzduchu nebo jiné látky. Klasická konstrukce vlhkoměru je založena na hygroskopických vlastnostech lidských vlasů.