Teoria cinetica dei Gas Ideali Velocit quadratica media












- Slides: 13

Teoria cinetica dei Gas Ideali Velocità quadratica media Termodinamica dei gas ideali

Dalla meccanica alla termodinamica • In Meccanica: lo stato di una particella è definito quando siano note, posizione (x, y, z) e velocità (vx, vy, vz), quindi 6 diverse variabili per ogni punto in moto. • In termodinamica: il concetto di stato deve essere ridefinito. I sistemi termodinamici, generalmente costituiti da un gran numero di particelle, tipicamente N (numero di Avogadro, ~1023), non sarebbe possibile conoscere 6 N variabili. • In Termodinamica non si può parlare più di determinismo della fisica Lo studio delle proprietà collettive di un “grand ensemble” richiede qualche riflessione. • Le proprietà di un insieme numeroso di particelle non sono la semplice somma delle proprietà delle singole particelle. • Per comprendere le relazioni fra la fisica di una singola particella e la fisica dei sistemi collettivi dovremo conoscere un po’ di statistica

Definizione di Gas Perfetto Per avere un gas perfetto si devono soddisfare le seguenti condizioni: 1. Disporre di un gran numero di particelle (Grand Ensemble) 2. Le molecole del gas devono essere puntiformi ed identiche tra loro (non devono avere un volume proprio); 3. Le molecole si devono muovere in modo totalente caotico (tutte le direzioni devono essere equiprobabili); 4. Le molecole devono interagire tra loro e con le pareti del recipiente mediante urti perfettamente elastici (non vi deve essere dispersione di energia durante gli urti); 5. Le molecole di un gas perfetto devono obedire solo alle leggi di Newton (le traiettorie dopo ogni urto devono essere rettiline).

Gas Ideali • Si può osservare che qualunque tipo di gas, confinato in un recipiente a bassa densità, segue la legge dei gas perfetti: p. V = n. RT. n è il numero di moli R = 8, 31 [J/mol K] costante dei gas • L’equazione di stato dei gas si può esprimere anche in funzione del numero di molecole N e diventa: p. V = Nk. T • con k = R/NA ed NA= 6, 02 x 1023 (Numero di Avogadro) e T temperatura assoluta (T sempre positiva) • L’importanza dell’equazione dei gas ideali è legata alla sua semplicità e al fatto che per basse densità è valida per tutti i tipi di gas (indipendente dalla specie atomica). • Anche l’aria che respiriamo soddisfa le condizioni dei gas perfetti.

Pressione di un gas perfetto • La variazione della quantità di moto lungo l’asse x è: Dpx = (-mvx) – (mvx) = -2 mvx • il tempo necessario per andare e tornare fra due pareti opposte, è 2 L = D tvx quindi Dt = 2 L/vx • la forza trasferita sulla parete è: • Questa è la forza impressa da una particella su una parete di lato L. (ATTENZIONE: P rappresenta la pressione e la lettera px la quantità di moto). • n numero di particelle, vx 2 velocità quadratica media nella direzione x. • A causa del moto caotico, la velocità quadratica media è 1/3 di vx P = 1/3 (n. M/V) v 2 qm

Velocità quadratica media • dalla formula p = (n. Mv 2 qm)/3 V p. V = n. Mv 2 qm/3 si vede che il prodotto p. V, dipende dalla velocità v delle singole particelle • e ricordando l’equazione di stato dei gas perfetti si avrà: • La velocità quadratica media è molto alta e dipende: dalla radice della temperatura, espressa in Kelvin, e dall’inverso della massa molare. • Domanda: Perché, se la velocità molecolare a temperatura ambiente è così alta, il tempo necessario a sentire l’odore di un fiala di profumo è di qualche minuto?

Cammino libero medio • Il camino fra due urti successivi è il cammino libero. La somma dei cammini divisa per il numero delle collisioni da il cammino libero medio che risulta essere: d = diametro della particella V = volume del contenitore N = numero di Avogadro • Al livello del mare l’aria ha un cammino libero medio di 0, 1 mm. A 100 km l = 16 cm. A 300 km l = 20 km. Come si ricava questa formula?

Spiegazione cammino libero medio • Nel tempo Dt una particella percorrerà una distanza pari v. Dt (dove v è la velocità presunta, velocità di Maxwell) in un cilindro di sezione pd 2. Il volume del cilindro è (pd 2)(v. Dt) • Il numero delle collisioni sarà uguale al numero delle particelle nel cilindro. Infatti possiamo supporre che la particella che si muove ha diametro 2 d mentre le altre, ipotizzate ferme, siano senza diametro. Distanza percorsa Volume del cilindro A cui va aggiunto un fattore 1/√ 2 per tener conto della differenza fra la velocità vm media su tutto il contenitore e la velocità relativa alle altre particelle vrel = √ 2 vm

Energia cinetica • Con il solito modello, l’energia cinetica traslazionale media sarà uguale all’energia cinetica di una particella con velocità vqm • Sostituendo a vqm il valore funzione della temperatura e della massa: Dove k. B costante di Boltzmann (vale 1. 38 x 10 -23). Questa formula ci dice che l’Energia cinetica media di un gas non dipende dal tipo di gas esaminato, ma solo dalla sua temperatura.

Significato di energia interna • L’energia interna Eint di un gas è la somma delle energie cinetiche delle singole particelle e siccome ogni particella ha una Energia cinetica E =(3/2)k. BT l’energia totale di un gas dipenderà solo dalla temperatura. Supponendo un gas formato da n. NA molecole avremo che L’Energia interna media sarà: n = numero di moli NA = numero di Avogadro Nello stato di gas perfetto, l’Energia interna di un gas Eint dipende solo dalla sua temperatura. Quindi misurare la temperatura è come sapere quanto vale la sua Eint

Esperimento di Stern • Nel 1926 il fisico tedesco Otto Stern ebbe l'idea di verificare la teoria di Maxwell. • Riscaldando del mercurio in un forno ad alta temperatura, ottenne un fascio di molecole che veniva iniettato in una camera in alto vuoto. • Nella camera ruotavano due dischi D 1 e D 2 dotati di due fenditure e sfasate l'una rispetto all'altra di un angolo noto. • Misurando la velocità dei dischi che permettevano ad una molecola di attraversare entrambe le due fenditure si poteva risalire alla velocità delle molecole di mercurio. • Quindi, graficando il numero di particelle che raggiungono il rivelatore P in funzione delle velocità dei dischi si ottiene la distribuzione delle velocità delle molecole a temperature diverse, cioè la distribuzione di Maxwell

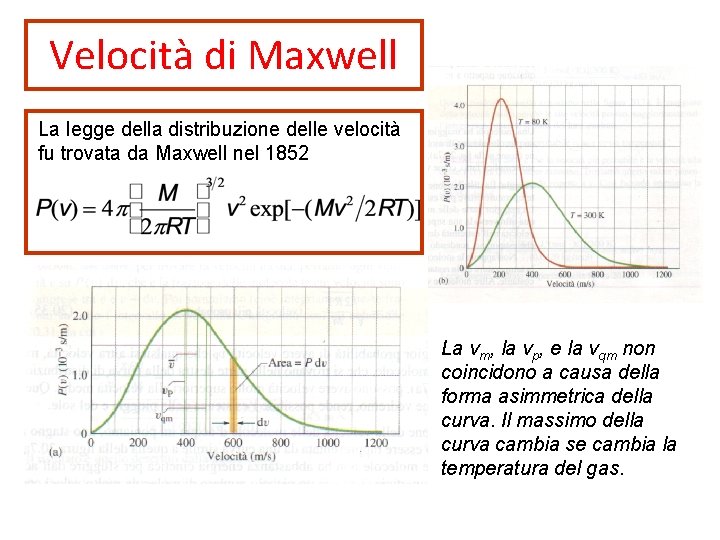
Velocità di Maxwell La legge della distribuzione delle velocità fu trovata da Maxwell nel 1852 La vm, la vp, e la vqm non coincidono a causa della forma asimmetrica della curva. Il massimo della curva cambia se cambia la temperatura del gas.

Distribuzione delle velocità • La curva ci da la probabilità di trovare un certo numero di particelle, P(v) dv, nell’intorno di una definita velocità. L’area sottesa dalla curva è il numero delle particelle costituenti il gas. Pertanto: • La velocità media sarà data dalla soluzione: • Allo stesso modo si può trovare la media della velocità quadratica • La velocità più probabile si trova ponendo uguale a zero la derivata di P(v)
 Teoria cinetico molecolare
Teoria cinetico molecolare Velocidade quadrática média
Velocidade quadrática média Velocità quadratica media formule
Velocità quadratica media formule Media aritmetica
Media aritmetica Media quadratica
Media quadratica Velocità quadratica media formula
Velocità quadratica media formula Cambio de energia interna
Cambio de energia interna Teoría cinetico molecular
Teoría cinetico molecular Que son los modelos en ciencias
Que son los modelos en ciencias Modelo corpuscular
Modelo corpuscular Teoria cinetica de los gases
Teoria cinetica de los gases Molarità chimica
Molarità chimica Distillazione azeotropica
Distillazione azeotropica Vak diodo
Vak diodo