Tema 9 Reaccions electroqumiques Electroqumica Part de la















- Slides: 16

Tema 9 Reaccions electroquímiques

Electroquímica Part de la química que estudia la interconversió entre l’energia elèctrica i l’energia química. Tracta de l’ús De les reaccions químiques per a produir electricitat (pila) De l’electricitat per a produir reaccions químiques (electròlisi)

CONTINGUT 1. - Reaccions redox. 2. - Termodinàmica de sistemes electroquímics. Piles galvàniques. 3. - Força electromotriu de les piles. Potencials d’elèctrode. 4. - Dependència de la fem amb les concentracions. Equació de Nernst. 5. - Corrosió.

1 REACCIONS REDOX. Reacció d’oxidació-reducció: Aquella reacció en què ocorre una transferència d’electrons. Zn + Cu 2+ « Zn 2+ + Cu Zn « Zn 2+ + 2 e- Semireacció d’oxidació Zn perd electrons: s’oxida; és l’agent reductor Cu 2+ + 2 e- « Cu Semireacció de reducció Cu 2+ guanya electrons: es redueix; és l’agent oxidant Intervenen dos parells redox conjugats Zn 2+/Zn Cu 2+/Cu

CO + ½ O 2 « CO 2 Com posar de manifest la transferència electrònica? Mitjançant els estats d’oxidació A cada element li assignem un estat d’oxidació: +2 -2 0 +4 -2 CO + ½ O 2 « CO 2 Una reacció serà redox si hi ha canvis en eixos estats. Avantatges Proporciona un mecanisme per reconéixer reaccions redox Ajuda a ajustar reaccions redox [Batxiller]

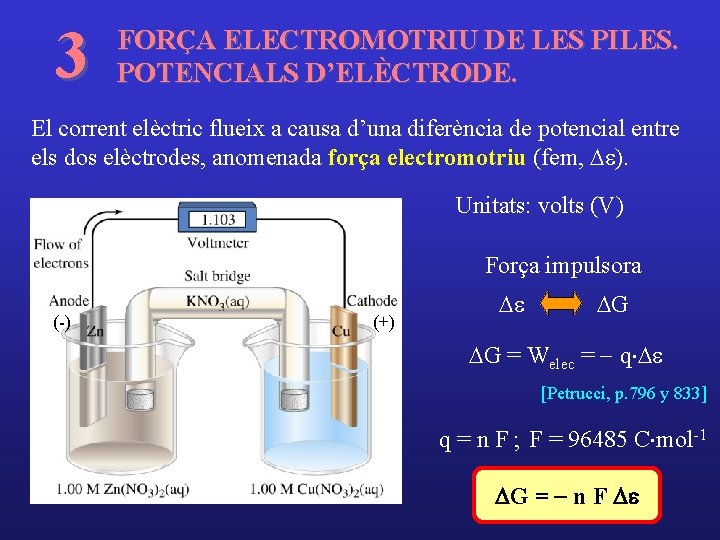
2 TERMODINÀMICA DE SISTEMES ELECTROQUÍMICS. PILES GALVÀNIQUES. Sistemes electroquímics: Aquells on ocorren reaccions de transferència d’electrons. Zn Cu Cu 2+ SO 42 - Zn 2+ Zn + Cu 2+ ® Zn 2+ + Cu Reacció per contacte directe. Així no és un dispositiu útil per generar corrent elèctric. Pila electroquímica: Dispositiu en el qual es produeix un corrent elèctric (flux d’e- a través d’un circuit) gràcies a una reacció espontània (pila galvànica o voltaica) o en el qual s’utilitza corrent elèctric per dur a terme una reacció química no espontània (cèl×lula electrolítica).

Luigi Galvani (1737 -1798) Alessandro Giuseppe Antonio Anastasio Volta (1745 -1827)

Pila Daniell (-) Zn ® Zn 2+ + 2 e. Oxidació (+) Cu 2+ + 2 e- ® Cu Reducció Zn (s) | Zn 2+ (1 M) || Cu 2+ (1 M) | Cu(s) John Frederic Daniell (1790 -1845)

3 FORÇA ELECTROMOTRIU DE LES PILES. POTENCIALS D’ELÈCTRODE. El corrent elèctric flueix a causa d’una diferència de potencial entre els dos elèctrodes, anomenada força electromotriu (fem, De). Unitats: volts (V) Força impulsora (-) (+) De DG DG = Welec = - q×De [Petrucci, p. 796 y 833] q = n F ; F = 96485 C×mol-1 DG = - n F De

DG = - n F De • Reacció espontània: DG < 0 Þ De > 0 • Reacció no espontània: DG > 0 Þ De < 0 (la reacció espontània serà l’inversa) • Equilibri: DG = 0 Þ De = 0 (no es produeix energia elèctrica; la pila s’ha esgotat) Michael Faraday (1791 -1867) En condicions estàndard: DGº = - n F Deº (Concentracions dels ions = 1 M) Deº és una propietat intensiva

En lloc de tabular valors de Deº de totes les piles, tabulem potencials d’elèctrode • S’escull un elèctrode de referència al qual per conveni se li assigna el valor de potencial zero: Elèctrode estàndard d’hidrogen. 2 H+ (aq) + 2 e- « H 2 (g) • Es construeixen piles amb un elèctrode d’hidrogen i amb un altre, el potencial del qual volem esbrinar, i es mesura la fem de la pila. • Eixa fem serà el potencial estàndard de l’altre elèctrode. eº = 0. 00 V

Es tabulen potencials estàndard (eº) de reducció ß Sèrie electroquímica A major eº, major tendència a reduir-se té l’espècie oxidada del parell redox (més oxidant és). p. ex. : Zn 2+ + 2 e- « Zn Cu 2+ + 2 e- « Cu eº = -0. 76 V eº = +0. 34 V Més tendència a reduir-se; més oxidant La fem d’una pila es calcula com: Deº = eº(càtode) - eº(ànode) p. ex. : 0. 34 – (-0. 76) = 1. 10 V [reducció] [oxidació] Perquè funcione la pila (reacció espontània): Deº > 0

4 DEPENDÈNCIA DE LA FEM AMB LES CONCENTRACIONS. EQUACIÓ DE NERNST. Si les condicions no són estàndard, quant val la fem? DG = DGº + RT ln Q DG = - n F De DGº = - n F Deº [Tema 4] - n F De = - n F Deº + RT ln Q Equació de Nernst A 25ºC :

1920 Premi Nobel de Química “En reconeixement al seu treball en termoquímica”. Walther Hermann Nernst (1864 -1941) [http: //nobelprize. org/chemistry/laureates/1920/index. html]

Altres aplicacions de l’equació de Nernst a) Obtenció de constants d’equilibri de reaccions redox En l’equilibri: De = 0 i Q = Keq b) Obtenció d’eº en condicions no estàndard

5 CORROSIÓ. En qué consisteix? Quines són les semireaccions implicades? Quines reaccions posteriors originen el rovell? Com afecta el p. H? Com es pot previndre? - Recobriments - Galvanizat - Protecció catòdica [Petrucci, tema 21, p. 849 -850]
 Igualar reaccions químiques
Igualar reaccions químiques Tipos de entrevista
Tipos de entrevista Aliran seni lukis tertua di dunia adalah
Aliran seni lukis tertua di dunia adalah Tema-tema teologi perjanjian lama
Tema-tema teologi perjanjian lama Ejemplo de delimitacion del problema
Ejemplo de delimitacion del problema Subtema
Subtema Part whole model subtraction
Part whole model subtraction Function of under bar
Function of under bar Unit ratio definition
Unit ratio definition The part of a shadow surrounding the darkest part
The part of a shadow surrounding the darkest part Part part whole
Part part whole 미니탭 gage r&r 해석
미니탭 gage r&r 해석 What is technical description
What is technical description Svyatoy nikolay
Svyatoy nikolay Essere unici
Essere unici Hal yang harus diperhatikan dalam menulis puisi yaitu
Hal yang harus diperhatikan dalam menulis puisi yaitu Tema el amor del padre
Tema el amor del padre