7 7 1 Reaccions qumiques Macroscpicament Una REACCI

















- Slides: 20

7

7. 1 |Reaccions químiques § Macroscòpicament: Una REACCIÓ QUÍMICA és un procés pel qual una o diverses substàncies inicials o REACTIUS, es transformen en una altra o unes altres substàncies finals o PRODUCTES, diferents de les inicials. REACTIUS → PRODUCTES § Microscòpicament: Reacció química: Reagrupació d’àtoms que, ordenant-se de manera diferent de com estaven inicialment, constitueixen noves substàncies pures. Això comporta el trencament d’enllaços en els reactius i la formació de nous enllaços en els productes. El nombre i la classe d’àtoms que formen les substàncies inicials i finals són els mateixos, però agrupats de manera diferent. Per tant, la massa total dels reactius ha de ser igual a la massa total dels productes (Llei de Lavoisier)

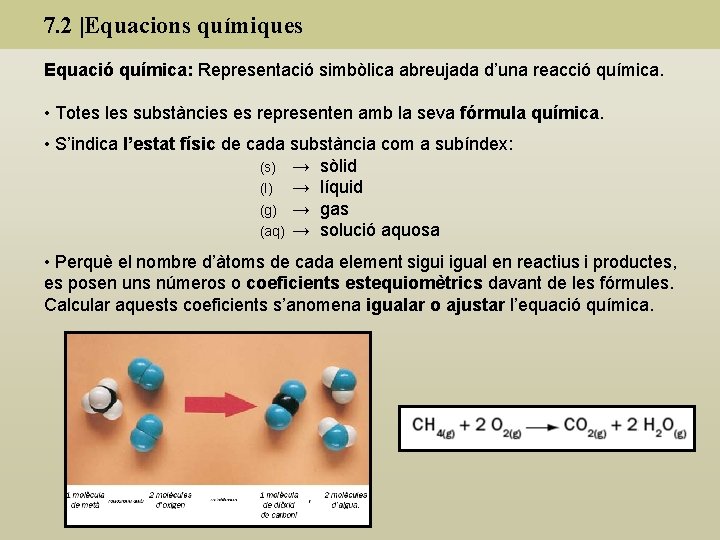
7. 2 |Equacions químiques Equació química: Representació simbòlica abreujada d’una reacció química. • Totes les substàncies es representen amb la seva fórmula química. • S’indica l’estat físic de cada substància com a subíndex: (s) → sòlid (l) → líquid (g) → gas (aq) → solució aquosa • Perquè el nombre d’àtoms de cada element sigui igual en reactius i productes, es posen uns números o coeficients estequiomètrics davant de les fórmules. Calcular aquests coeficients s’anomena igualar o ajustar l’equació química.

7. 3 |Mols i reacció química Els coeficients estequiomètrics d’una equació química indiquen en quina proporció intervenen les substàncies. Microscòpicament: Els coeficients expressen la relació en àtoms, molècules o ions. Macroscòpicament: Els coeficients expressen la relació en MOLS. En el cas de substàncies gasoses, en iguals condicions de P i T, els coeficients també expressen la relació dels gasos en volums: Exemple: 1 litre de metà reacciona amb 2 litres d’oxigen i s’obté 1 litre de diòxid de carboni i 2 litres d’aigua

7. 4 |Igualació d’equacions químiques senzilles • Les reaccions senzilles es poden igualar per tempteig. • Quan la reacció és més complicada, resulta útil seguir un ordre: 1 r. Igualar els àtoms d’elements metàl·lics. 2 n. Igualar els àtoms d’elements no metàl·lics (excepte H i O). 3 r. Igualar els àtoms d’hidrogen. 4 t. Igualar els àtoms d’oxigen. Exemple, cal igualar: Fe (s) + HCl (aq) → Fe. Cl 2 (aq) + H 2 (g) KCl. O 3 (s) → KCl (s) + O 2 (g) H 2 (g) + O 2 (g) ) → H 2 O (l) Ca. CO 3 (s) + HCl (aq) → Ca. Cl 2 (aq) + CO 2 (g) + H 2 O (l)

7. 4 |Igualació d’equacions químiques senzilles • En algunes reaccions és convenient conèixer el seu mecanisme: - Neutralització àcid-base: Exemple, cal igualar: ÀCID + BASE → SAL + AIGUA HCl (aq) + Na. OH (aq) → Na. Cl (aq) + H 2 O (l) H 2 SO 4 (aq) + KOH (aq) → K 2 SO 4 (aq) + H 2 O (l) HNO 3 (aq) + Al(OH)3 (aq) → Al(NO 3)3 (aq) + H 2 O (l) -Combustió: COMPOST ORGÀNIC + OXIGEN → DIÒXID DE CARBONI + AIGUA Exemple, cal igualar: C 6 H 6 (l) + O 2 (g) → CO 2 (g) + H 2 O (l) C 4 H 10 (g) + O 2 (g) → CO 2 (g) + H 2 O (l) C 2 H 5 OH (l) + O 2 (g) → CO 2 (g) + H 2 O (l) C 6 H 12 O 6 (s) + O 2 (g) → CO 2 (g) + H 2 O (l)

7. 5 |Càlculs estequiomètrics a) Càlculs senzills Recordar: els coeficients estequimètrics relacionen les substàncies de la reacció en MOLS. En el cas de gasos, a igual P i T, també en volums. Exemples 3 i 4 pàg. 200.

7. 5 |Càlculs estequiomètrics a) Càlculs senzills Més exemples: Extra 1: Per a la combustió de 200 g de butà, calcula: a) El nombre de molècules d’aigua que s’obtindran b) El volum de diòxid de carboni, mesurat a 25ºC i 90000 Pa, que s’obtindrà c) El volum d’aire, mesurat en c. n. , necessari per a la combustió del butà Dada: L’aire conté un 21 % en volum d’oxigen Extra 2: Es neutraliza hidròxid de sodi amb àcid sulfúric. Si es neutralitzen 50 g d’hidròxid de sodi, calcula: a) El volum de dissolució d’àcid sulfúric 12 M necessari per a la neutralització b) La massa d’aigua que s’obtindrà Extra 3: El zinc metàl·lic reacciona amb l’àcid clorhídric i s’obté clorur de zinc i hidrogen gasós. Si reaccionen 5 g de zinc, calcula: a) El volum d’hidrogen mesurat a 20ºC i 1’ 01· 105 Pa que s’obtindrà b) La massa de clorur d’hidrogen necessari Extra 4: L’hidrogen i l’oxigen reaccionen formant aigua. Si s’han format 240 g d’aigua, a) Quina és la massa d’hidrogen que ha reaccionat? b) Quin és el volum d’oxigen, mesurat en c. n. Que ha reaccionat?

7. 5 |Càlculs estequiomètrics b) Reactiu limitant Quan tenim dades dels diversos reactius d’una reacció química, cal determinar quin és el REACTIU LIMITANT. EL REACTIU LIMITANT ÉS EL QUE PRIMER S’ACABA. Quan ell s’ha acabat, per més que hi hagi d’altres reactius, la reacció ja no es pot produir i s’acaba. Per determinar quin és el reactiu limitant, es pot fer comparant en mols els diversos reactius. Això permet trobar el reactiu que s’acaba i els que hi són en excés. Tots els càlculs s’han de fer a partir del reactiu limitant (ja que ell segur que reacciona completament). Veure exemples: 7 pàg 203 i 8 pàg 204 Extra: Es neutralitzen 20 g d’hidròxid de sodi amb àcid sulfúric 0’ 2 M. Calcula la massa de sal que s’obtindrà.

7. 5 |Càlculs estequiomètrics c) Impureses dels reactius A vegades el reactiu no és totalment pur sinó que està en una mostra mesclat amb altres substàncies o amb impureses que no reaccionen. Normalment es dóna el % de puresa del reactiu que hi ha en la mostra. Situacions possibles en els exercicis: -Cal fer el càlcul del producte que s’obtindrà a partir d’una mostra: a l’inici, cal aplicar el % de puresa del reactiu en la mostra. (veure exercici 20 pàg 228). -A partir del producte obtingut es determina el reactiu pur que contenia la mostra i es calcula el % de puresa. (veure exemple 9 pàg 205).

7. 5 |Càlculs estequiomètrics d) Rendiment de la reacció Moltes vegades, en una reacció química s’obté una quantitat de producte menor del que caldria esperar teòricament. S’anomena rendiment de la reacció a la relació entre la quantitat de producte real que s’obté i el producte teòric. Normalment s’expressa en percentatge. (Veure exemple 10 pàg. 206) També: Per a la combustió de 200 g de benzè, amb excés d’oxigen, s’han obtingut 275 L de diòxid de carboni mesurats en c. n. Quin ha estat el rendiment de la reacció?

7. 5 |Càlculs estequiomètrics e) Reaccions simultànies -Quan diversos reactius reaccionen simultàniament amb un altre reactiu comú, SEMPRE cal plantejar cada reacció per separat i fer el càlcul per a cadascuna. (Veure exercici 16 pàg. 228) - Una aplicació possible és la determinació de composició de mescles: (Veure exemple 5 pàg. 201) També: Tenim una mescla gasosa de metà i butà. En la combustió de 20 L de mescla, mesurats en c. n. , s’han obtingut 44’ 196 g d’aigua. Determina la composició de la mescla en % en volum de cada gas.

7. 5 |Càlculs estequiomètrics f) Reaccions consecutives Són aquelles en què el producte d’una reacció és reactiu de la següent reacció. SEMPRE cal plantejar cada reacció per separat. En els càlculs, cal fer els de l’una i després encadenar els de la següent. Exemples: A) La pedra calcària està formada majoritàriament per carbonat de calci. En escalfar el carbonat de calci es descompon en diòxid de carboni i òxid de calci, anomenat vulgarment calç viva. L’òxid de calci reacciona amb l’aigua formant hidròxid de calci, que s’anomena calç apagada. Si es parteix de 20 kg de pedra calcària del 90 % de riquesa en carbonat de calci, quina serà la massa de calç apagada o hidròxid de calci que s’obtindrà si la primera reacció té un rendiment del 80 % i la segona un rendiment del 60 %? B) En reaccionar l’hidrogen i el nitrogen gasosos, s’obté amoníac. Posteriorment, l’amoníac obtingut reacciona amb clorur d’hidrogen i es forma clorur d’amoni. Si es parteix de 20 g d’hidrogen i 20 g de nitrogen, calcula la massa de clorur d’amoni s’obtindrà, sabent que la primera reacció té un rendiment del 70 % i la segona té un rendiment del 85 %.

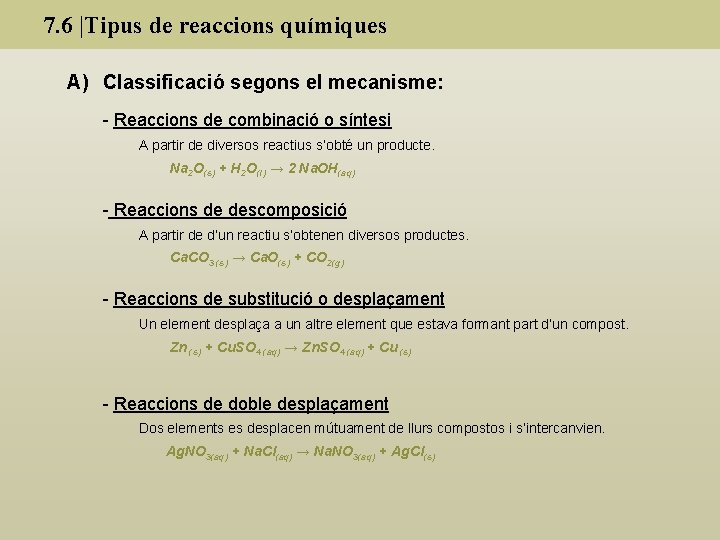
7. 6 |Tipus de reaccions químiques A) Classificació segons el mecanisme: - Reaccions de combinació o síntesi A partir de diversos reactius s’obté un producte. Na 2 O(s) + H 2 O(l) → 2 Na. OH(aq) - Reaccions de descomposició A partir de d’un reactiu s’obtenen diversos productes. Ca. CO 3 (s) → Ca. O(s) + CO 2(g) - Reaccions de substitució o desplaçament Un element desplaça a un altre element que estava formant part d’un compost. Zn (s) + Cu. SO 4 (aq) → Zn. SO 4 (aq) + Cu (s) - Reaccions de doble desplaçament Dos elements es desplacen mútuament de llurs compostos i s’intercanvien. Ag. NO 3(aq) + Na. Cl(aq) → Na. NO 3(aq) + Ag. Cl(s)

7. 6 |Tipus de reaccions químiques B) Classificació per la naturalesa de la reacció: B. 1. Reaccions àcid-base o de neutralització Àcid: Substància capaç d’alliberar ions H+ quan es troba en solució aquosa. Base: Substància que, en solució aquosa, allibera ions OH–. Reaccions de neutralització: Reaccions en les que es combinen els ions H+ de l’àcid amb els ions OH– de l’hidròxid o base. Àcid + Base → Sal + H 2 O p. H: Escala que mesura el grau d’acidesa o basicitat. Indicadors: substàncies que canvien de color segons l’acidesa del medi. En afegir unes gotes d’un indicador anomenat fenolftaleïna a una solució d’un hidròxid, apareix un color rosa violat característic. Paper indicador universal

7. 6 |Tipus de reaccions químiques B. 2. Reaccions de precipitació Reaccions en què s’obté un producte sòlid insoluble que s’anomena precipitat. Na. Cl(aq) + Ag. NO 3(aq) → Na. NO 3(aq) + Ag. Cl(s) ↓ El precipitat groc és de iodur de plata.

7. 6 |Tipus de reaccions químiques B. 3. Reaccions d’oxidació-reducció (redox) Oxidació: Procés en què una espècie química perd electrons. L’element que s’oxida augmenta el seu estat d’oxidació. Reducció: Procés en què una espècie química guanya electrons. L’element que es redueix disminueix el seu estat d’oxidació. Reductor: Espècie química que redueix a l’altra, ell s’oxida. Oxidant: Espècie química que oxida a l’altra, ell es redueix. Reaccions d’oxidació-reducció o reaccions redox: Reaccions de transferència d’electrons. Una espècie química cedeix un o més electrons a una altra espècie química que els capta. 2 Na(s) + S(s) → Na 2 S(s) El sofre reacciona amb el sodi i s’obté sulfur de sodi. En aquesta reacció, el sofre guanya electrons, és l’oxidant, i el sodi els perd, és el reductor.

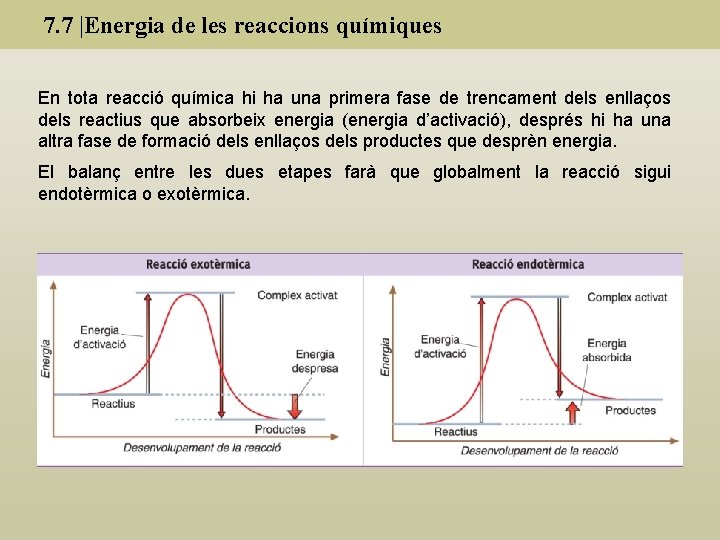
7. 7 |Energia de les reaccions químiques Reaccions exotèrmiques: Reaccions químiques que tenen lloc amb despreniment d’energia en forma de calor. Reaccions endotèrmiques: Reaccions químiques que tenen lloc amb absorció d’energia en forma de calor. En una reacció química es pot absorbir o emetre energia en formes que no són calor com en la fotosíntesi (absorció de llum) o en l’electròlisi (absorció d’energia elèctrica ) En reaccionar el magnesi amb el dioxigen, es desprèn majoritàriament energia lluminosa.

7. 7 |Energia de les reaccions químiques En tota reacció química hi ha una primera fase de trencament dels enllaços dels reactius que absorbeix energia (energia d’activació), després hi ha una altra fase de formació dels enllaços dels productes que desprèn energia. El balanç entre les dues etapes farà que globalment la reacció sigui endotèrmica o exotèrmica.

7. 8 |Velocitat de les reaccions químiques Velocitat d’una reacció: Quantitat de substància reaccionant que es transforma o desapareix en cada unitat de temps i per unitat de volum. Factors que influeixen en la velocitat d’una reacció: • Concentració de les solucions de les substàncies que reaccionen. • Estat de divisió en què es troben els reactius. • Temperatura. • Catalitzadors: Substàncies que augmenten la velocitat d’una reacció, sense que aparentment prenguin part en el procés, ja que al final de la reacció els trobem tal com estaven al començament. L’estat de divisió en que es troben els reactius influeix en la velocitat de la reacció, per això les branques petites cremen molt més ràpid que els troncs.
 Coeficients estequiomètrics
Coeficients estequiomètrics Los elementos de las ondas
Los elementos de las ondas Texto informal
Texto informal Una instruccion incrustada no puede ser una declaracion c#
Una instruccion incrustada no puede ser una declaracion c# A una piedra se le imprime una velocidad inicial de 20m/s
A una piedra se le imprime una velocidad inicial de 20m/s La hermana de mi madre es mi ____
La hermana de mi madre es mi ____ Ejemplo de una descripción de una persona
Ejemplo de una descripción de una persona Circunferencia con sus elementos
Circunferencia con sus elementos Ejemplos de variable discreta
Ejemplos de variable discreta Ejercicios de trabajo y potencia
Ejercicios de trabajo y potencia Diptongo de hoy
Diptongo de hoy Habia una vez una nina que se caperucita roja apex
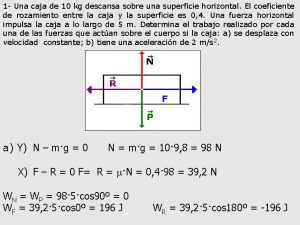
Habia una vez una nina que se caperucita roja apex Un cuerpo de 40 kg descansa sobre una mesa
Un cuerpo de 40 kg descansa sobre una mesa De devociones absurdas y santos amargados líbranos señor
De devociones absurdas y santos amargados líbranos señor Como se resuelve este ejercicio
Como se resuelve este ejercicio Misturas homogeneas
Misturas homogeneas Indica una breve pausa en la lectura
Indica una breve pausa en la lectura Es el rebote de una onda de sonido en una superficie dura
Es el rebote de una onda de sonido en una superficie dura Caras de un cono
Caras de un cono Proyecto de vida cristiana
Proyecto de vida cristiana Que rasgos distintivos permiten diferenciar una p de una b
Que rasgos distintivos permiten diferenciar una p de una b