Szervetlen kmia Nitrogncsoport VA oszlop Elektronszerkezet ns 2















- Slides: 17

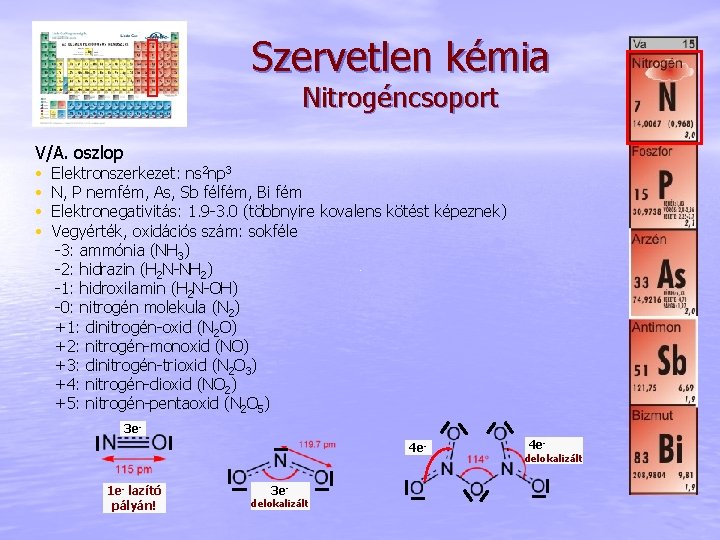
Szervetlen kémia Nitrogéncsoport V/A. oszlop • • Elektronszerkezet: ns 2 np 3 N, P nemfém, As, Sb félfém, Bi fém Elektronegativitás: 1. 9 -3. 0 (többnyire kovalens kötést képeznek) Vegyérték, oxidációs szám: sokféle -3: ammónia (NH 3) -2: hidrazin (H 2 N-NH 2) -1: hidroxilamin (H 2 N-OH) -0: nitrogén molekula (N 2) +1: dinitrogén-oxid (N 2 O) +2: nitrogén-monoxid (NO) +3: dinitrogén-trioxid (N 2 O 3) +4: nitrogén-dioxid (NO 2) +5: nitrogén-pentaoxid (N 2 O 5) 3 e 4 e 1 e- lazító pályán! 3 e- delokalizált 4 e- delokalizált

Szervetlen kémia Nitrogéncsoport Nitrogén (N) • Gáz, levegő 78%-a. N 2 nagyon stabil. • 3 p elektronnal kötés, negyediket datív módon (NH 4+) N fontosabb vegyületei: • Ammónia (NH 3): színtelen, szúrós szagú, nagy párolgáshő, vízben jól oldódik. Felhasználás: salétromsav és műtrágyagyártás, hűtőgép (helyette ma HCFC, HFC) • Ammónium-hidroxid (NH 4 OH) Csak vizes oldatban létezik, gyenge bázis: NH 3 + H 2 O NH 4 OH NH 3 vízben való oldódása exoterm: hevítés hatására NH 3 eltávozik. • Ammónium-klorid (NH 4 Cl) Kristályos, vízben jól oldódik, oldata kissé savas Hevítés hatására bomlik: NH 4 Cl → NH 3 + HCl Felhasználás: lágyforrasztáskor fémfelület tisztítására, HCl és NH 3 oldja a fém-oxidokat • Ammónium-nitrát (NH 4 NO 3) Kristályos, higroszkópos, könnyen bomlik (robbanásveszély) Felhasználás: mészkőporral keverve műtrágya

Szervetlen kémia Nitrogéncsoport • Nitrogén-dioxid (NO 2): vörösesbarna, párosítatlan elektron miatt paramágneses. Vízzel reagálva: 2 NO 2 + H 2 O = HNO 3 + HNO 2 Egyensúlyban van a dimerjével: 2 NO 2 N 2 O 4

Szervetlen kémia Nitrogéncsoport • Dinitrogén-tetroxid (N 2 O 4): könnyen cseppfolyósítható gáz. Felhasználás: kovalens vegyületek jó aprotonos oldószere. • Salétromsav (HNO 3): színtelen, szúrós szagú, erős sav Állás közben bomlik: 2 HNO 3 → 2 NO 2 + H 2 O + O Oxidálószer: N 5+ → N 4+-re redukálódik, ill. naszcens oxigén képződik Fémeket oldja (választóvíz: ezüst): 2 Ag + 2 HNO 3 = Ag 2 O + 2 NO 2 + H 2 O Ag 2 O + 2 HNO 3 = 2 Ag. NO 3 + H 2 O Királyvíz: cc. HNO 3 és cc. HCl 1: 3 arányú keveréke (aranyat is oldja) HNO 3 + 3 HCl = 2 H 2 O + NO + 3 Cl (atomos klór oxidál) HCl + 3 Cl + Au = H[Au. Cl 4] (hidrogén-tetrakloro-aurát) cc. HNO 3 a vasat és alumíniumot nem oldja, mert passzív oxidréteget csinál (de: a híg HNO 3 oldja őket!!

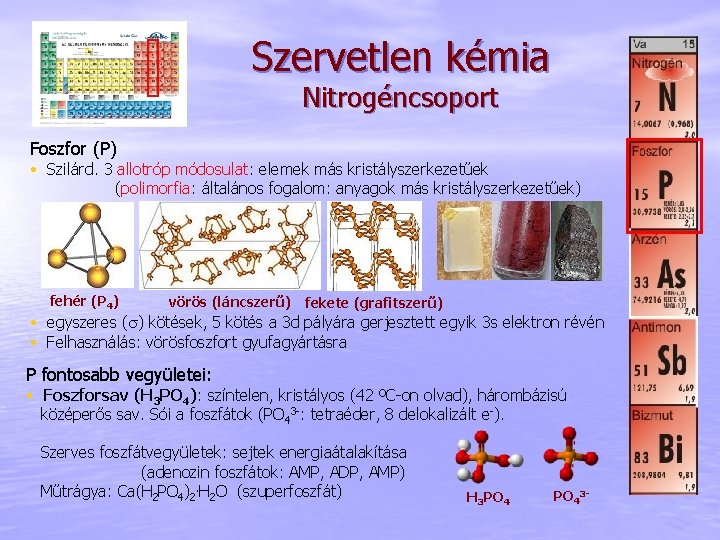
Szervetlen kémia Nitrogéncsoport Foszfor (P) • Szilárd. 3 allotróp módosulat: elemek más kristályszerkezetűek (polimorfia: általános fogalom: anyagok más kristályszerkezetűek) fehér (P 4) vörös (láncszerű) fekete (grafitszerű) • egyszeres (s) kötések, 5 kötés a 3 d pályára gerjesztett egyik 3 s elektron révén • Felhasználás: vörösfoszfort gyufagyártásra P fontosabb vegyületei: • Foszforsav (H 3 PO 4): színtelen, kristályos (42 ºC-on olvad), hárombázisú középerős sav. Sói a foszfátok (PO 43 -: tetraéder, 8 delokalizált e-). Szerves foszfátvegyületek: sejtek energiaátalakítása (adenozin foszfátok: AMP, ADP, AMP) Műtrágya: Ca(H 2 PO 4)2. H 2 O (szuperfoszfát) H 3 PO 43 -

Szervetlen kémia Oxigéncsoport VI/A. oszlop • • Elektronszerkezet: ns 2 np 4 O, S, Se nemfém, Te, Po félfém Elektronegativitás: 2. 0 -3. 5 (többnyire kovalens kötést képeznek) Vegyérték: 2, 4, 6 Oxigén (O) • • • 3. leggyakoribb elem a világegyetemben Leggyakoribb elem a Földön, a földkéreg súlyának fele oxigén. Gáz, levegő 20. 9 %-a. Cseppfolyós és szilárd halmazállapotban kék. Kétatomos molekula (O 2), kevésbé stabilabb mint N 2. Egy s kötés, és két azonos spinű magános p elektron (két fél p kötés) O O • Előállítás: cseppfolyós levegő frakcionált desztillációjával, ill. vízből elektrolízissel • Legjelentősebb allotróp módosulata az ózon (O 3): O O Fertőtlenítő hatású, légkörben UV védelem 4 e- O

Szervetlen kémia Oxigéncsoport Oxigén vegyületei Víz (H 2 O) • Erős hidrogénkötés, vízben legstabilabbak a négyes asszociátumok (H 8 O 4) • Jég: folyadéknál lazább szerkezete miatt sűrűsége kisebb mint a vízé (térfogata nagyobb 9%-al). Víz sűrűsége is +4 ºC-on a legnagyobb. Hidrogén-peroxid (H 2 O 2) • Színtelen, szagtalan, nem éghető folyadék • Erős hidrogénkötést képez, vízzel korlátlanul elegyedik • Peroxokötés gyenge, erősen bomlékony: H 2 O 2 = H 2 O + O A felszabaduló naszcensz (atomos) oxigén miatt erős oxidálószer. 2 HCl + H 2 O 2 = Cl 2 + H 2 O • Előállítása: Ba. O 2 + H 2 SO 4 = Ba. SO 4 + H 2 O 2 (Ba. O + O 2 = Ba. O 2 500 ºC-on) • Fontosabb alkalmazásai: fertőtlenítőszer, színtelenítőszer, rakéták üzemanyaga Bomlását nehézfémek és sóik katalizálják

Szervetlen kémia Oxigéncsoport Kén (S) • Sárga, szilárd, 8 -atomos molekulák (s-kötés) • Természetben elemi állapotban vulkángőzökben. • Kőolajfinomítás mellékterméke • Felhasználás: borászat (baktériumölő), kénsav előállítás Antal István: A kén Egy sárga úr vagyok, Megismerhetsz nyomban, Megtalálsz a hatodik főcsoportban. Távol áll tőlem bohém élet, pia, Jellemzőm az allotrópia. Egy lóugrás a szén, ki mindig , , kormos'', Iker vagyok, monoklin és rombos. Nem vagyok túl kemény, De mégis sármos, Egész testem molekularácsos. Testem látszik, nem poláros, Nyolc atomos gyűrű, apoláros. Ha oldani akarsz, vízzel ne próbálkozz, Erre inkább, szén-diszulfid, te ajánlkozz! Hevítgetnek gyakran, megolvadok, folyok, Sűrű, sötét gyűrű leszek, majd folyékony vagyok. Ha ilykor lehűtenek orvul, Nem érzem jól magam, csak amorful. Egyéb elemekkel reagálok sorba', Ekképp stabilizálódom három rácstípusba. Atom, molekula, s ionrács e három, Soulfour vagyok, magamat ajánlom.

Szervetlen kémia Oxigéncsoport Kén vegyületei: Hidrogén-szulfid (H 2 S, kén-hidrogén) • Előfordulás: vulkáni gázok, kénes ásványvizek, záptojás (fehérjék bomlásterméke) • Savas jellege miatt fémekkel reagál (pl. ezüst: fekete Ag 2 S) Kén-dioxid (SO 2) • Vulkáni tevékenységből, szén és kőolajszármazékok elégetésekor → savas esők • Redukálható (oxidáló tulajdonság): SO 2 + 2 H 2 S = 3 S + 2 H 2 O • Oxidálható (redukáló tulajdonság): 2 SO 2 + O 2 = 2 SO 3 Ezen reakció vanádium-pentoxid (V 2 O 5) katalizátorral a kénsavgyártás fő lépése. • Borászatban hasznos tulajdonságok: antioxidáns, antiszeptikus (mikroorganizmus ölő), íz, zamat és színalakító hatás Kén-trioxid (SO 3) O • S elektronszerkezete: 3 s 2 3 p 4 = csak 2 párosítatlan, kovalens 6 ekötést képző elektron S Promóció: a párosított elektronokból 1 -1 a 3 d pályára gerjesztődik (energia fedeződik az utána kialakuló kovalens O O kötés során felszabaduló energiából) Hibridizáció: pályák energiája kiegyenlítődik, hogy ekvivalens kötéseket alkothassanak: SO 3 -ban: 3 ekvivalens s-kötés + delokalizált p pályák

Szervetlen kémia Kén vegyületei Kénsav (H 2 SO 4) • Egyik legnagyobb mennyiségben előállított vegyszer (szinte minden vegyiipari ágazatban használt alapanyag) Max. 98 %-os vizes oldatát használják (efölött SO 3 párolog ki belőle). Akkumulátorban 33. 5 %-os van. • Kétértékű nagyon erős sav. Tömény H 2 SO 4 erősen vízelvonó, még szerves vegyületekből is elvonja a H és O-t → elszenesíti őket.

Szervetlen kémia Kén vegyületei Kénsav (H 2 SO 4) • Egyik legnagyobb mennyiségben előállított vegyszer (szinte minden vegyiipari ágazatban használt alapanyag) Max. 98 %-os vizes oldatát használják (efölött SO 3 párolog ki belőle). Akkumulátorban 33. 5 %-os van. • Kétértékű nagyon erős sav. Tömény H 2 SO 4 erősen vízelvonó, még szerves vegyületekből is elvonja a H és O-t → elszenesíti őket. • Tömény forró kénsav erős oxidálószer, de HNO 3 -nál gyengébb. • Autoprotolízis: 2 H 2 SO 4 H 3 SO 4+ + HSO 4 K=2. 7. 10 -4 (mol/dm 3)2 sokkal erősebb mint a vízben (10 -14), vezeti az áramot. • Vízben disszociációja: H 2 SO 4 + H 2 O = H 3 O+ + HSO 4 - (hidrogén-szulfátion) HSO 4 - + H 2 O = H 3 O+ + SO 42(szulfátion) • Szulfátok (SO 42 -) • Tetraéderes szerkezetű, de – a sok helyen látható ábrával ellentétben - a 4 oxigén ekvivalens, 8 e--ból álló delokalizált p-rendszer van a 4 s S-O kötés körül. • Fontosabb szulfátok: Pb. SO 4, Ca. SO 4, Mg. SO 4, Cu. SO 4. 5 H 2 O (növényvédőszer)

Szervetlen kémia Halogéncsoport VII/A. oszlop • • • Elektronszerkezet: ns 2 np 5 F, Cl, Br, I nemfém, At (mesterséges elem) félfém Elektronegativitás: 4. 0 -2. 2 Kis EN-ú elemekkel ionos, nagy EN-ú elemekkel kovalens kötésű vegyületeket alkotnak. Vegyérték: 1, 3, 5, 7 (oxidációs szám: -1, +3, +5, +7) kivéve a F, aminek oxidációs száma csak -1 lehet. Erős oxidálószerek (anionná redukálódnak) Kétatomos molekulákat képeznek. Színesek: molekuláik a látható fény hatására gerjesztődnek. Szobahőmérsékleten F, Cl gáz, Br folyékony, I szilárd. Előfordulás: tengervízben, ásványvizekben, többnyire Na-só formájában. Fluor (F) • Legerősebb oxidáló elem, nemesgázokkal is (Kr, Xe, Rn) reagál. • Megtámadja a legtöbb elemet: esetenként a fejlődő hő mellett fényeffektus.

Szervetlen kémia Halogéncsoport Fluor fontosabb vegyületei • Hidrogén-fluorid (HF): középerős sav, üvegmaratásra használják Si. O 2 + 4 HF = Si. F 4 + 2 H 2 O Erős hidrogénkötés: H 2 F 2, H 4 F 4, H 6 F 6 asszociátumokat képez • Nátrium-fluorid (Na. F): fogpasztában • Nátrium-[hexafluoro-aluminát] = kriolit (Na 3[Al. F 6]) Al gyártásban elektrolízisnél: 1000 ºC-os olvadéka oldja a timföldet (enélkül 2000 ºC kellene) Klór (Cl) • • Fojtó szagú gáz, elemi állapotban vulkáni gázokban Reaktivitása hasonló (csak gyengébb) a fluoréhoz Előállítás: Na. Cl vizes oldatának elektrolízise → Cl 2 + H 2 Felhasználás: fertőtlenítés (víz, gyógyászat) Cl 2 + H 2 O HCl + HCl. O → HCl + O Hidrogén-klorid (HCl) • Szúrós szagú gáz, vizes oldata a sósav (erős sav), kis koncentrációban gyomorban • Előállítás: Na. Cl + H 2 SO 4 = Na. HSO 4 + HCl • Felhasználás: PVC gyártás, gyógyszeripar + sok egyéb iparágban

Szervetlen kémia Halogéncsoport Bróm (Br) • Vörösbarna, rossz szagú folyadék (büzeny) • Klóréhoz hasonló jellegű reaktivitás (de gyengébb) • Felhasználás: KBr, Na. Br-t nyugtatóként a gyógyászatban Ag. Br-t a fényképészetben Jód (I) • Szürke kristály, sárgásbarna vizes oldat, lila gőz

Szervetlen kémia Halogéncsoport Jód (I) • Vízben rosszul oldódik, de KI-os oldatban már jól: I 2 + I- = I 3 - komplex ion • Oxidálószer (leggyengébb a halogének közül) • Fontos élettani szerep: pajzsmirigy által termelt tiroxin növekedési hormon Hiánya: pajzsmirigy megnagyobbodás (golyva), törpeség, szellemi visszamaradottság Napi szükséglet felnőttkorban: 0. 15 mg (jódozott só) De: 2 -3 g már halálos méreg • Előfordulás: tengervíz, édesvíz (század mg/dm 3), Na. IO 3 salétrombányákban • Radioaktív jód: 131 I (urán maghasadásakor), felezési ideje 8 nap Illékony, levegőben relatíve nagy koncentráció katasztrófa esetén. Pajzsmirigyben összegyűlik → daganatos betegség. Védekezés: napi 130 mg KI tabletta • Előállítás: Na. IO 3 + 3 Na. HSO 3 = Na. I + 3 Na. HSO 4 Na. IO 3 + 5 Na. I + 3 H 2 O = 3 I 2 + 6 Na. OH • Felhasználás: halogén izzólámpákban W szál párolgásának csökkentésére Ag. I felhőkbe porlasztása: eső indítás 3 %-os alkoholos—vizes oldatát fertőtlenítésre (oxidáló hatása miatt) analitikai laborokban: reagens

Szervetlen kémia Nemesgázok Általános tulajdonságok • Elektronszerkezet: ns 2 np 6 • Egyetlen elem, ami atomos állapotban természetben előfordul • A zárt elektronhéj miatt meglehetősen inertek, a magasabb rendszámúak laboratóriumi körülmények között reakcióba vihetők: Xe[Pt. F 6], Xe. F 2, Kr. F 4, Ba. Kr. O 4 • Szilárd halmazállapot: „molekularács” – diszperziós kölcsönhatásokkal • Legelterjedtebb felhasználás: fénycsövek, izzólámpák töltése - kisnyomású nemesgáz (általában keverék) + többnyire kevés Hg vagy fémsó - feszültség hatására elektromos kisülés → ionizálja a gázt - szabaddá váló elektronok gyorsulnak a feszültség hatására, ütköznek a gázfázisban levő atomokkal, ionokkal, ezzel gerjesztik elektronjaikat. A gerjesztett elektronok visszakerülve az alapállapotba UV és látható fotonokat sugároznak ki. Hélium (He) • • H után a leggyakoribb a világegyetemben, s legkönnyebb → léghajók, léggömbök Előállítás: földgáz cseppfolyósításakor gázfázisban marad, uránkőzetek hevítése Hűtőanyag szupravezető mágnesekben, kriogenikában He-Ne lézer különböző műszerekben

Szervetlen kémia Nemesgázok Argon (Ar) • • • Föld légkörének 0. 93 %-át alkotja Előállítás: cseppfolyós levegő frakcionált lepárlásával Védőgáz fémkohászatban, ívhegesztésnél Hőszigetelt üvegben az üveglapok között Élelmiszeriparban csomagológáz Kripton (Kr) • Előállítás: cseppfolyós levegő frakcionált lepárlásával • Izzólámpa töltőgáza (Bródy Imre, TUNGSRAM) Xenon (Xe) • • Elsőként előállított nemesgáz vegyület: Xe[Pt. F 6]. Előállítás: cseppfolyós levegő frakcionált lepárlásával Xeonlámpa töltőgáza (vakuk) Űreszközök ionhajtóművének hajtóanyaga (ionizációs kamrában ionozálják, majd az ionokat elektromos térben felgyorsítva kilövik. Kis, de hosszú ideig egyenletes hajtóerő: bolygóközi utazásra optimális. Radon (Rn) • Radioaktív háttérsugárzás 40 %-a, forrása a kőzetekben levő rádium. Összegyűlik a lakóhelyiségek légterében. Tüdőrák 2. leggyakoribb okozója.