Szervetlen kmia Szncsoport Elemei s vegyleteik IVA oszlop


















- Slides: 21

Szervetlen kémia Széncsoport Elemei és vegyületeik

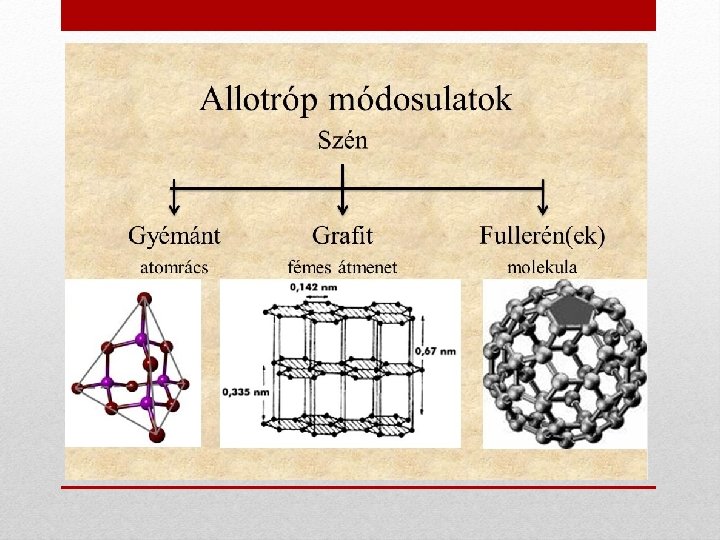
IV/A. oszlop • • Elektronszerkezet: ns 2 np 2 Vegyérték: C, Si, Ge - 4; Sn, Pb – 2 (ritkábban 4) C nemfém; Si, Ge félfém; Sn, Pb fém. Elektronegativitás: 2. 5 -1. 8 (C, Si, Ge kovalens kötések, Sn, Pb inkább ionos) Szén (C) módosulatai • Kristályos: gyémánt, grafit, fullerének • Ásványokban (70 -10%, amorf): antracit, kőszén, barnaszén, lignit, tőzeg • Mesterséges: faszén, vérszén, csontszén, korom, koksz (szénégetés, száraz lepárlás: ~500 ºC-on, O 2 kizárásával hevítve) Felhasználás: - gyémánt (legkeményebb ásvány): ékszeripar, üvegvágás, fúrófejek, vágóélek - grafit: elektródok, olvasztótégelyek (jó vezetőképesség), kenőanyagokban - ásványi szenek, koksz: tüzelés - faszén, vérszén, csontszén: sok apró pórus aktivált szén nagy fajlagos felület → adszorbens - korom: töltőanyag (pl. gumiban) molekulák


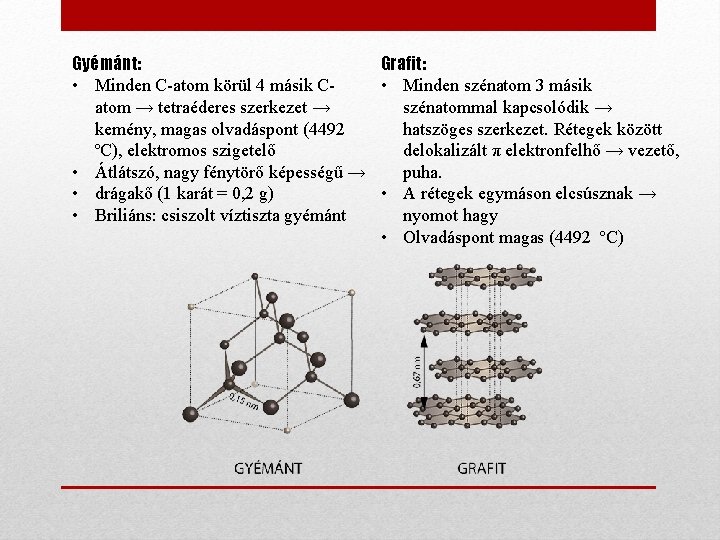
Gyémánt: Grafit: • Minden C-atom körül 4 másik C • Minden szénatom 3 másik atom → tetraéderes szerkezet → szénatommal kapcsolódik → kemény, magas olvadáspont (4492 hatszöges szerkezet. Rétegek között ºC), elektromos szigetelő delokalizált π elektronfelhő → vezető, • Átlátszó, nagy fénytörő képességű → puha. • drágakő (1 karát = 0, 2 g) • A rétegek egymáson elcsúsznak → • Briliáns: csiszolt víztiszta gyémánt nyomot hagy • Olvadáspont magas (4492 ºC)

Híres gyémántok:

Szervetlen kémia Széncsoport Fullerének: mesterséges szén módosulatok (XX. sz. vége) • páros számú (60, 72, 84 stb. ) szénatomból álló molekulák • Felfedezés: 1985 -ben Harold Kroto, Robert Curl, Richard Smalley 1996 -ban kémiai Nobel-díj. • A molekulákat kizárólag öt- és hattagú gyűrűk építik fel. • C atom három másik C atomhoz kapcsolódik (1 kettős, 2 egyes kötés). • Az ötszögek száma mindig 12. • A C 60 (backminsterfullerén) molekula futball-labda alakú. C 60 Felhasználás: szén nanocső: hengeres fullerén C 540 - jó kenési tulajdonságok (molekulák könnyű elmozdulása) - gyémántbevonat (160 atm, 25 ºC-on gyémánttá alakítható) - fénnyel besugározva vezetik az elektromosságot: optikai áramkörben - intersticiális C 60 Rb-só: 30 K alatt ellenállás nélkül vezeti az áramot (szupravezető) - nanocsövek: nagy szakítószilárdság, jó el. vezetés, kémiai inaktivitás (űrtechnológia)

Szénvegyületek Szerves vegyületek: 5 millió Fontosabb szervetlen vegyületek: • Szén-monoxid (CO): színtelen, szagtalan gáz, szén tökéletlen égésekor Vér hemoglobinja megköti: fejfájás, szédülés, fulladás (MÉRGEZŐ!) Szintézisgáz (CO + 3 H 2): metanol, műbenzin előállítása • Szén-dioxid (CO 2): színtelen szagtalan gáz, égést elfojtja (0. 035%) Folyadék: csak 5 barnál nagyobb nyomás alatt Szárazjég: szilárd CO 2 (folyékony CO 2 párolgása nagy hőelvonásal jár → megfagy) hűtésre használják • Szénsav (H 2 CO 3): instabil, vizes oldata kétbázisú gyenge sav H 2 CO 3 HCO 3 - + H+ (H 3 O+) K 1= 4. 3. 10 -7 mol/dm 3 CO 32 - + H+ (H 3 O+) K 2= 5. 6. 10 -11 mol/dm 3 • Szénsav sói, a karbonátok stabilak Karbonátion (CO 32 -): 6 delokalizált elektron

Széncsoport további elemei Szilícium (Si) • Föld szilárd kérgének 30 %-a. Kvarc és szilikátok a vulkáni kőzetek 98%-a. • Kvarc (Si. O 2): hegyikristály, ametiszt, füstkvarc, rózsakvarc Si + 4 OH- = Si. O 44 - + 2 H 2 3 K 2 Si. F 6 + 4 Al = 3 Si + KAl. F 4 + K 3 Al. F 6 Germánium (Ge): ritka elem, félvezető Ón (Sn): fehérbádog (ónbevonatú vas), bronz ötvözet (Cu+Sn) Ólom (Pb): csővezetékek (védő Pb. O 2 oxidréteg, híg sav nem oldja), akkumulátor, radioaktív sugárvédelem, ötvözetek (betűfém: Pb + Sn)

Széncsoport további elemei Szilícium, a szervetlen világ egyik legfontosabb alkotóeleme 1823 -ban fedezte fel Jöns Jakob Berzelius. Neve a kovakő latin nevéből (silex) származik. Vegyjele: Si, nyelvújítás kori neve kovany 3 stabil izotóp: 28 Si, 29 Si, 30 Si 5 radioaktív izotóp: 25 Si, 26 Si, 27 Si, 31 Si, 32 Si

Szilícium Fizikai tulajdonságok • sötétszürke, fémesen csillogó elem • szilárd halmazállapotú • olvadáspontja (1414 o. C) és forráspontja (3265 o. C) magas • Sűrűsége: 2, 33 g/cm 3 • alacsony hőmérsékleten szigetelő, • magasabb hőmérsékleten vezeti az áramot, félvezető. • csak egyetlen módosulata van, amely gyémántrácsú. • vízben nem oldódik

Szilícium Kémiai tulajdonságok • Nitrogénnel reagálva nitrid • Szénnel karbid • Oxigénnel szilícium- dioxid keletkezik Si + O 2 �Si. O 2 • vízzel, savval nem reagál, lúgokban jól oldódik • Halogénekkel csak magas hőmérsékleten reagál (kiv. fluor) • fémekkel szilicidet alkot Sav: kovasav (H 2 Si. O 3) Savmaradékion: Si. O 32 Sói: szilikátok Só: fémből vagy ammóniumionból (NH 4+) és savmaradékionból álló vegyület

Szilícium Előfordulása Világegyetemben: 7. Leggyakoribb elem (H, He, O, Ne, N, C, Si, Mg, …) Földön: • • , …) 2. Leggyakoribb elem (O, Si, Al, H, Na, Fe, Ca, Mg Napban, csillagokban és meteoritokban Leggyakoribb ásványa: kvarc Szépen színezett, átlátszó kvarckristályok: drágakövek, féldrágakövek élővilágban a kovaszivacsok, kovamoszatok, zsurlók, sások testfelépítésében játszik fontos szerepet

Szilícium előállítása • Vegyületeiből redukcióval például káliumszilikofluoridból alumíniummal: 3 K 2 Si. F 6 + 4 Al = 3 Si + 2 KAl. F 4 + 2 KAl. F 6 • Szilícium-dioxidból magnéziummal is redukálható. Az amorf szilícium barna por formájában keletkezik, amely könnyen megolvasztható, vagy elpárologtatható. Speciális eljárással egykristályokat készítenek belőle a félvezetőipar számára.

Szilícium felhasználása • Az elemi szilíciumot a fémkohászatban és a félvezetőtechnikában. • Az informatikai iparban a számítógépek processzorait (CPU) szilícium lapkák alkotják. • A kohászatban is fontos szerepet tölt be: korrózióálló acélok előállításához használják ötvözőanyagként. • A z elektronikai ipar talán legfőbb alapeleme a szilícium. • Napelemek gyártása • Üveggyártás

Üveggyártás alapanyaga: Az üveg olvasztással előállított, kristályosodás nélkül megdermedő, szilíciumdioxidot és fémoxidokat tartalmazó szervetlen anyag. Az üveg gyártása évezredes múltra tekint vissza. Egyes feljegyzések szerint a föníciaiak, más írások alapján az egyiptomiak készítették az első üveget. Az viszont bizonyított, hogy az egyiptomi üveg sokáig egyeduralkodó volt. Az egyiptomiaktól a rómaiak lesték el az üvegkészítés fortélyait és magas művészi fokra fejlesztették. A Római Birodalom bukása után Velence lett az üveg előállításának központja. Üvegfúvó mestereik - az üveggyártásáról ma is híres Murano szigetén dolgoztak. A XVI. és a XVII. században már egész Európában működtek üveghuták. Jó minőségű üveget készítettek Németországban és Csehországban. Magyarországon a Dunántúlon, Erdélyben és a Felvidéken több helyen gyártottak üveget. A XVIII. és a XIX. században nagyarányú fejlődés következett be az üveggyártásban. Tűzállóbb anyagból készítették a kemencéket, tisztább alapanyagokat használtak. Oroszországban Lomonoszov feltalálta a színes üveget, Angliában előállították az első ólomkristályt. A XX. század elején korszerű, nagy olvasztó kemencéket építettek, a gyártáshoz félautomata és automata gépsorokat fejlesztettek ki. Üveggyártás: https: //www. youtube. com/watch? v=xge 35 Jzeib 8

Széncsoport további elemei Germánium (Ge): ritka elem, félvezető Ón (Sn): fehérbádog (ónbevonatú vas), bronz ötvözet (Cu+Sn), lágyforrasz Ólom (Pb): csővezetékek (védő Pb. O 2 oxidréteg, híg sav nem oldja), akkumulátor, radioaktív sugárvédelem, ötvözetek (betűfém: Pb + Sn)

Fontosabb vegyületek Szén-monoxid (CO) • Szerkezete: • • a háromszoros kovalens kötés egyike datív (donor: O-atom) Színtelen, szagtalan gáz Különösen veszélyes, mérgező Legjellemzőbb reakciója az oxidáció: 2 CO + O 2 = 2 CO 2 Nagyon veszélyes méreg, bénulást, fulladásos halált okoz, mert a vérben az oxigén helyére kötődik!!!

Szén-dioxid (CO 2) • Szerkezete: • • a molekula lineáris felépítésű, apoláris Színtelen, szagtalan gáz A levegőnél nehezebb Az égést nem táplálja (tűzoltásra használják) Magasabb hőmérsékleten reakcióképes (fémekkel, fém-oxidokkal, fémhidroxidokkal reagál) Izzó szén-monoxiddá redukálja: CO 2 + C = 2 CO Kis koncentrációban szükséges a fotoszintézishez, nagy mennyiségben üvegházhatást eredményez és az emberi szervezetre is veszélyes Előállítása: szeszes erjedés során, szerves anyagok korhadásakor, mészkőből izzítással vagy sósavval Felhasználják: szárazjég alakban, üdítőitalok készítésére, tűzoltásra

Szénsav (H 2 CO 3) • Szerkezete: • Színtelen, szagtalan, folyadék • Csak vizes oldatban előforduló, bomlékony vegyület • Szén-dioxid és víz reakciójával képződik: CO 2 + H 2 O �H 2 CO 3 • Kétértékű, gyenge sav: H 2 CO 3 = H+ + HCO 3 - = H+ + CO 32 • Vizes oldata savas kémhatású • Sói a karbonátok (CO 32 -) • Szinte mindenütt előfordul: a természetes vizekben, az ásványvizekben, élő szervezetekben • Felhasználják üdítőitalok gyártására, gyógyászati célokra (szénsavfürdő)

Szilícium fontosabb vegyületei Szilikátok Láncszilikátok Rétegszilikátok pl. azbesztek (fehér és fekete) Rétegszilikátok pl. Agyagásványok (kaolinit), bentonit, csillámok, talkum Térhálós szilikátok pl zeolitok, ultramarinok Biológiai eredetű szilíciumtartalmú anyagok: kovaföld, diatomaföld, stb

Szilícium-dioxid (Si. O 2) • tetraéderes, térhálós szerkezetű atomrácsa van, melynek rácspontjaiban szilícium- és oxigénatomok vannak • különféle módosulatokban ismert (polimorf) o Kvarc: igen kemény, kémiailag ellenálló, tulajdonságai a gyémánthoz hasonlóak o Tűzkő: igen apró kristályok halmaza o Opál: víztartalmú, kristályszerkezettel nem rendelkező módosulat o Kovaföld: laza szerkezetű módosulat o Azbeszt
 Szóismétlés
Szóismétlés Dzsed oszlop
Dzsed oszlop Egy négyzetes oszlop éleinek mérete 3 3 és 4 egység
Egy négyzetes oszlop éleinek mérete 3 3 és 4 egység értéklánc elemei
értéklánc elemei Metonímia példa
Metonímia példa Egy reflexív elemei
Egy reflexív elemei önéletrajz tartalmi elemei
önéletrajz tartalmi elemei Crista biopsia
Crista biopsia Nullum tributum sine lege
Nullum tributum sine lege értéklánc elemei
értéklánc elemei Multimédia elemei
Multimédia elemei Játszma szerkezeti elemei
Játszma szerkezeti elemei Belső kontrollrendszer elemei
Belső kontrollrendszer elemei Elektronhéjak
Elektronhéjak Adótényállás elemei
Adótényállás elemei Reagls
Reagls Szóképek fajtái és jellemzőik
Szóképek fajtái és jellemzőik Porter féle értéklánc elemzés
Porter féle értéklánc elemzés üzleti kommunikáció fogalma
üzleti kommunikáció fogalma Adótényállás elemei
Adótényállás elemei Belső kontrollrendszer elemei
Belső kontrollrendszer elemei Adótényállás elemei
Adótényállás elemei