STRUCTURE DE LA MATIERE L atome et llment













- Slides: 26

STRUCTURE DE LA MATIERE

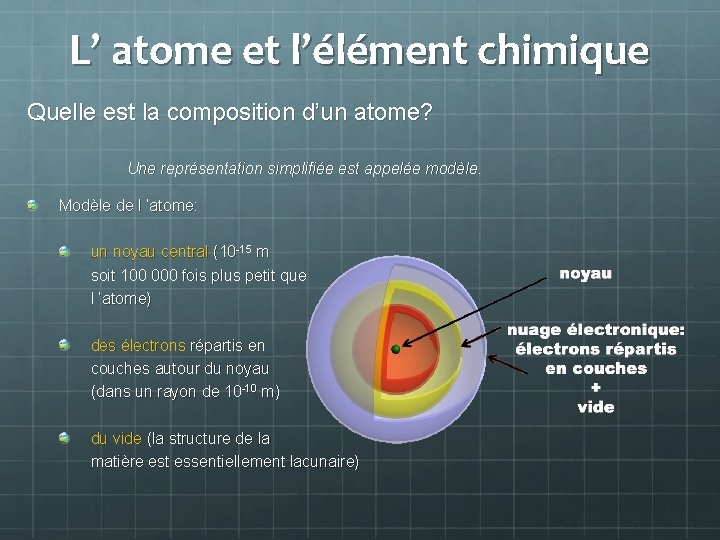
L’ atome et l’élément chimique Quelle est la composition d’un atome? Une représentation simplifiée est appelée modèle. Modèle de l ’atome: un noyau central (10 -15 m soit 100 000 fois plus petit que l ’atome) des électrons répartis en couches autour du noyau (dans un rayon de 10 -10 m) du vide (la structure de la matière est essentiellement lacunaire)

L’atome : son noyau et son nuage électronique Le noyau est 100 000 fois plus petit que l ’atome Masse de l’électron vaut 9, 1. 10 31 kg Masse du neutron vaut 1, 675. 10 27 kg Masse du proton vaut 1, 673. 10 27 kg mn mp = 1836 me

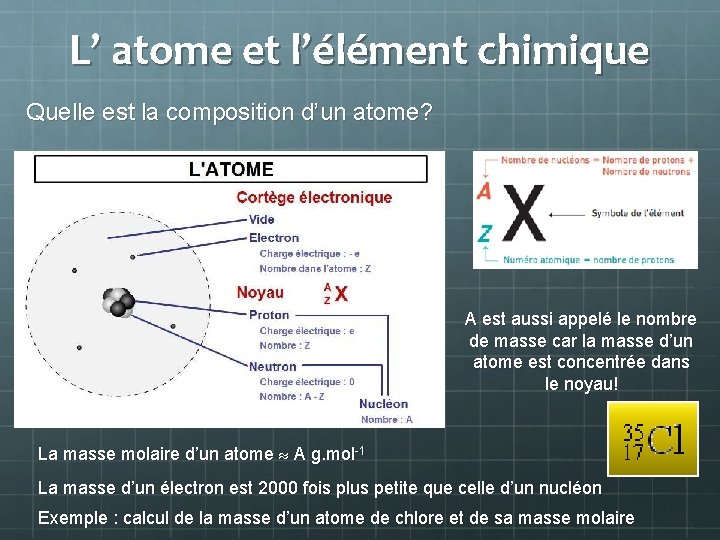
L’ atome et l’élément chimique Quelle est la composition d’un atome? A est aussi appelé le nombre de masse car la masse d’un atome est concentrée dans le noyau! La masse molaire d’un atome A g. mol-1 La masse d’un électron est 2000 fois plus petite que celle d’un nucléon Exemple : calcul de la masse d’un atome de chlore et de sa masse molaire

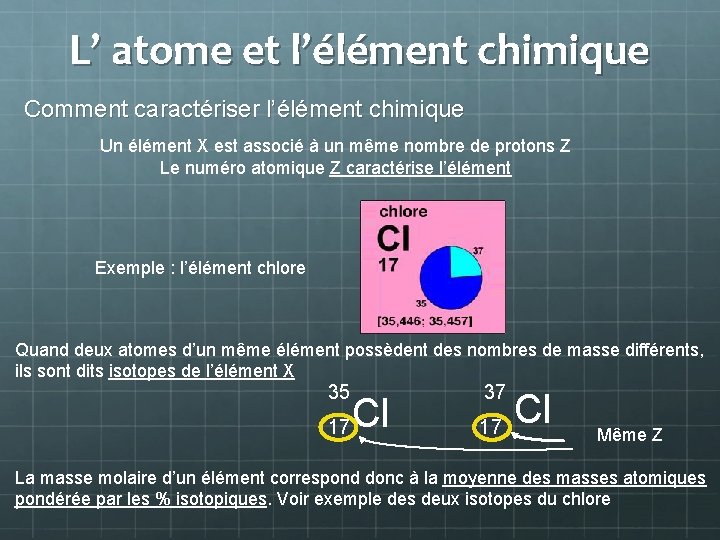
L’ atome et l’élément chimique Comment caractériser l’élément chimique Un élément X est associé à un même nombre de protons Z Le numéro atomique Z caractérise l’élément Exemple : l’élément chlore Quand deux atomes d’un même élément possèdent des nombres de masse différents, ils sont dits isotopes de l’élément X 35 17 Cl 37 17 Cl Même Z La masse molaire d’un élément correspond donc à la moyenne des masses atomiques pondérée par les % isotopiques. Voir exemple des deux isotopes du chlore

De la configuration électronique à la classification périodique des éléments La configuration électronique d’un atome En 1913, un scientifique danois, Neils Bohr interprète les spectres d’émissions en élaborant un modèle quantique : les orbites des électrons sont quantifiées (couches électroniques). Ces couches correspondaient au nombre quantique principal n. Couches K, L, M, N vue en 2 nd. Les électrons qui appartiennent à une même couche ont une énergie identique Couche M ( n = 3 ) Couche L ( n = 2 ) Couche K ( n = 1 )

La configuration électronique d’un atome Dans le modèle de Rutherford(1909) l’électron qui rayonne de l ’énergie finirait par s’écraser sur le noyau. Ainsi l’électron ne rayonne que lors d’un changement de couche. Par commodité on représente des cercles de diamètres quantifiés mais on ne peut prévoir ni la position ni la vitesse de l’électron! L’énergie d’un atome est la somme des énergies des électrons : elle est donc quantifiée! L’état d’un électron est donc totalement décrit par les 4 nombres quantiques suivants : quantiques suivants Le nombre quantique principal n avec n 1 ( la taille et l’énergie de l’orbitale) Le nombre quantique secondaire l avec 0 l n-1 ( forme de l’orbitale) Le nombre quantique magnétique ml avec -l ml +l (orientation dans l’espace) Le nombre quantique magnétique de spin ms avec ms = + ou – ½ (orientation du spin) Les électrons se répartissent sur des niveaux d’énergie, un niveau d’énergie (couche) est caractérisé par un couple ( n, l) (n, 0) couche ns 0 1 2 3 4 l (n, 1) couche np (n, 2) couche nd couche s p d f g (n, 3) couche nf

La configuration électronique d’un atome Etablir la configuration électronique d’un atome dans un état donné, c’est indiquer la répartition des électrons dans les orbitales ( 1 s, 2 p, 3 s…). Le nombre d’électrons étant noté en exposant. Exemple : 1 s 2 (deux électrons dans la couche 1 s) Pour ce faire 3 règles doivent s’appliquer: - Principe de Pauli : (n, l, ms) caractérisent un et un seul électron. Maximum de deux électrons par orbitales différenciés par leur spin Maximum de 2 n 2 électrons par couche n - Règle de Klechkowsky : les électrons se disposent autour du noyau de manière à ce que leur niveau d’énergie soit le plus bas. Remplissage en (n+l) croissant et en cas d’égalité en n croissant - Règle de Hund : l’état de plus basse énergie correspond au spin maximal. Les électrons occupent le maximun de cases quantiques.

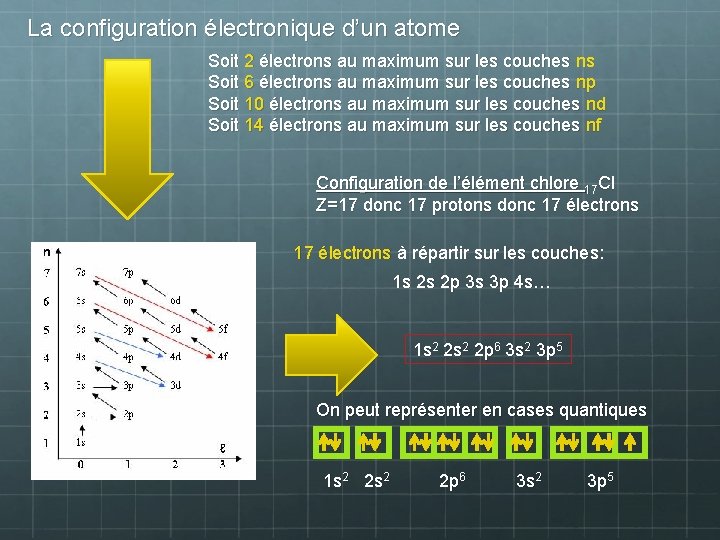
La configuration électronique d’un atome Soit 2 électrons au maximum sur les couches ns Soit 6 électrons au maximum sur les couches np Soit 10 électrons au maximum sur les couches nd Soit 14 électrons au maximum sur les couches nf Configuration de l’élément chlore 17 Cl Z=17 donc 17 protons donc 17 électrons à répartir sur les couches: 1 s 2 s 2 p 3 s 3 p 4 s… 1 s 2 2 p 6 3 s 2 3 p 5 On peut représenter en cases quantiques 1 s 2 2 s 2 2 p 6 3 s 2 3 p 5

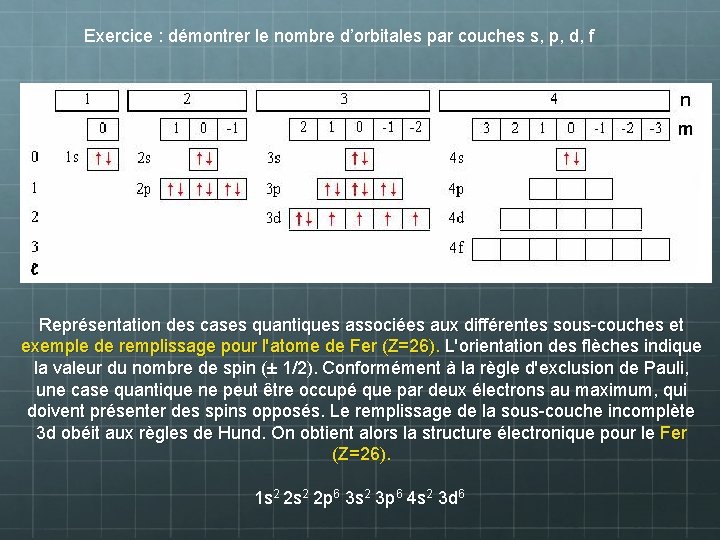
Exercice : démontrer le nombre d’orbitales par couches s, p, d, f Représentation des cases quantiques associées aux différentes sous-couches et exemple de remplissage pour l'atome de Fer (Z=26). L'orientation des flèches indique la valeur du nombre de spin (± 1/2). Conformément à la règle d'exclusion de Pauli, une case quantique ne peut être occupé que par deux électrons au maximum, qui doivent présenter des spins opposés. Le remplissage de la sous-couche incomplète 3 d obéit aux règles de Hund. On obtient alors la structure électronique pour le Fer (Z=26). 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 6

La configuration électronique d’un atome Électrons de cœur et électron de valence: Les électrons de cœur sont les électrons des couches profondes saturées ( près du noyau). Les électrons de valence sont les électrons des couches de n le plus élevé et ceux des sous-couches non remplies. Ils participent à la réactivité chimique de l’atome. 1 s 2 2 p 6 3 s 2 3 p 5 Cœur valence Attention certaines configurations électroniques de valence sont plus stable et ne respectent pas la règle de Klechkowski. Certains métaux de transition transfèrent des électrons de la sous-couche s pour remplir (ou à demi) leur sous-couche d. Cu (Z = 29) : la règle donne 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 9 or il est plus stable d'avoir 1 s 2 2 p 6 3 s 2 3 p 6 4 s 1 3 d 10 La configuration électronique est souvent simplifiée en ne gardant que les électrons excédentaires par rapport au gaz rare qui précède l'élément. Ainsi, comme le gaz rare qui précède le Cu c'est l'Ar (1 s 2 2 p 6 3 s 2 3 p 6), on écrira Cu : [Ar] 4 s 1 3 d 10

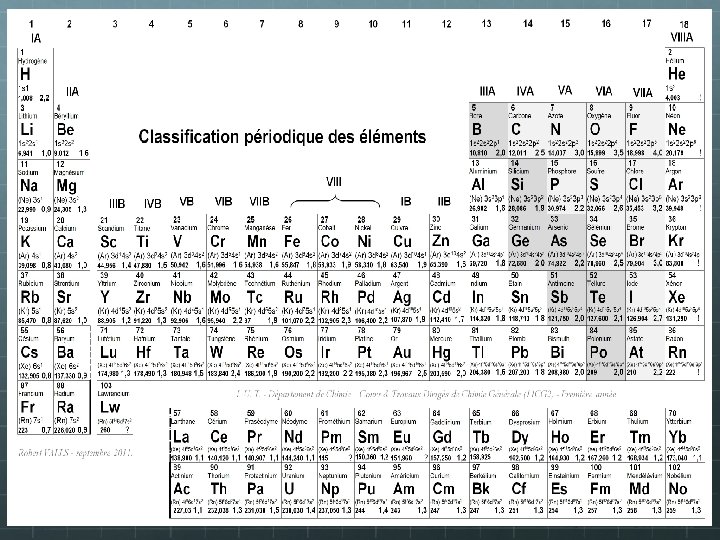
La classification périodique des éléments C’est en 1869 qu’un chimiste russe, Dimitri I. Mendeleïev eut l’idée de classer les éléments chimiques (au nombre de 63 connus à l’époque) en fonction de leurs propriétés physico-chimiques. Il observa une périodicité de ces propriétés lorsqu’il les classa suivant leur masse atomique croissante et entreprit alors de placer les éléments ayant des propriétés voisines sous forme de colonnes. Sa classification est validée par la découverte d’éléments dont il avait prédit la place et les propriétés chimiques! LES ELEMENTS CHIMIQUES - Découverte - Classification périodique. htm LE TABLEAU PERIODIQUE DES ELEMENTS 18 colonnes 18 familles d’éléments Les éléments d’une même colonne ont la même configuration électronique de valence même réactivité chimique 7 lignes ou périodes Même valeur de n pour la couche externe Remplissage par numéro Z croissant. Une nouvelle période est utilisée à chaque fois que la configuration fait intervenir un nouveau n


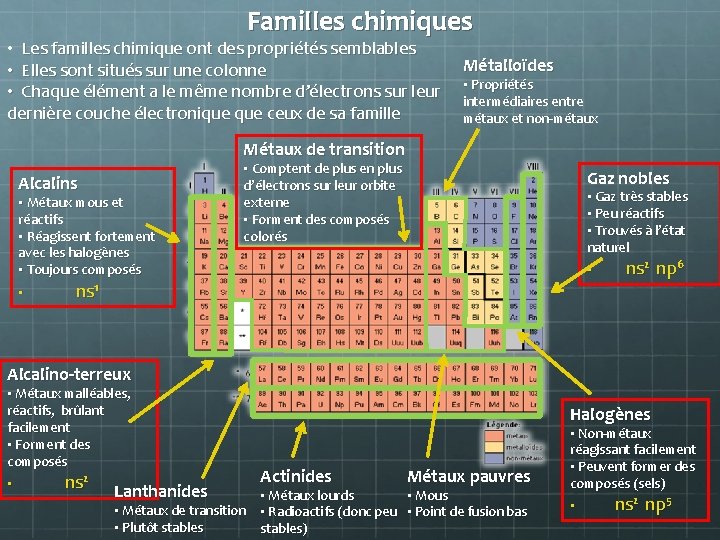
Familles chimiques • Les familles chimique ont des propriétés semblables • Elles sont situés sur une colonne • Chaque élément a le même nombre d’électrons sur leur dernière couche électronique ceux de sa famille Métalloïdes • Propriétés intermédiaires entre métaux et non-métaux Métaux de transition Alcalins • Métaux mous et réactifs • Réagissent fortement avec les halogènes • Toujours composés • • Comptent de plus en plus d’électrons sur leur orbite externe • Forment des composés colorés Gaz nobles • Gaz très stables • Peu réactifs • Trouvés à l’état naturel • ns 1 ns 2 np 6 Alcalino-terreux • Métaux malléables, réactifs, brûlant facilement • Forment des composés • ns 2 Lanthanides Halogènes Actinides Métaux pauvres • Métaux lourds • Mous • Métaux de transition • Radioactifs (donc peu • Point de fusion bas • Plutôt stables) • Non-métaux réagissant facilement • Peuvent former des composés (sels) • ns 2 np 5

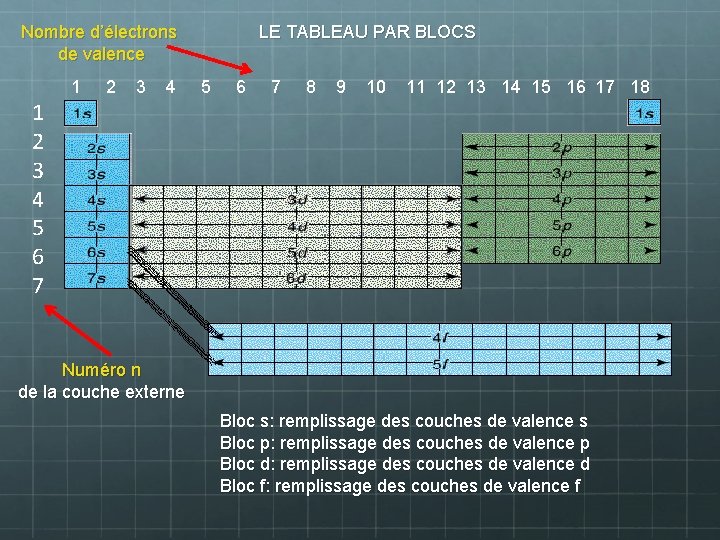
Nombre d’électrons de valence LE TABLEAU PAR BLOCS 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 1 2 3 4 5 6 7 Numéro n de la couche externe Bloc s: remplissage des couches de valence s Bloc p: remplissage des couches de valence p Bloc d: remplissage des couches de valence d Bloc f: remplissage des couches de valence f

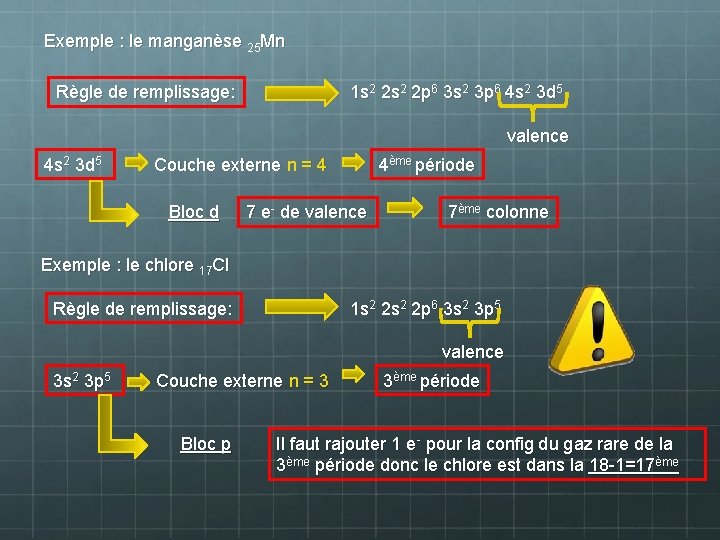
Exemple : le manganèse 25 Mn Règle de remplissage: 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 5 valence 4 s 2 3 d 5 Couche externe n = 4 Bloc d 4ème période 7 e- de valence 7ème colonne Exemple : le chlore 17 Cl Règle de remplissage: 1 s 2 2 p 6 3 s 2 3 p 5 valence 3 s 2 3 p 5 Couche externe n = 3 Bloc p 3ème période Il faut rajouter 1 e- pour la config du gaz rare de la 3ème période donc le chlore est dans la 18 -1=17ème

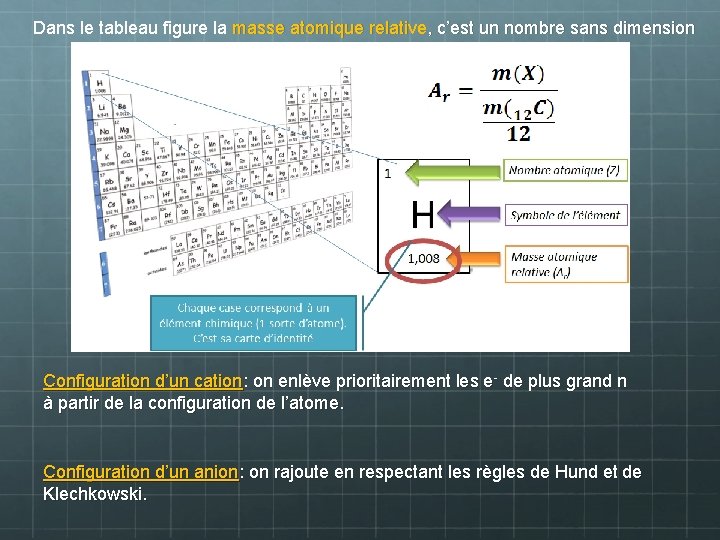
Dans le tableau figure la masse atomique relative, c’est un nombre sans dimension Configuration d’un cation: on enlève prioritairement les e- de plus grand n à partir de la configuration de l’atome. Configuration d’un anion: on rajoute en respectant les règles de Hund et de Klechkowski.

Les liaisons chimiques Les atomes se lient pour former un système plus stable en énergie. Electronégativité (notée EN) : elle rend compte de la tendance d'un élément, à la fois, à attirer et à retenir les électrons de liaison. Elle détermine le type de liaison.

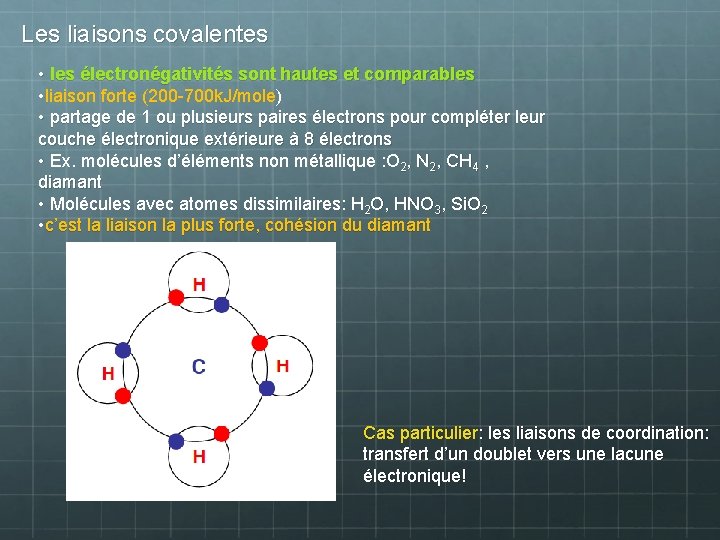
Les liaisons covalentes • les électronégativités sont hautes et comparables • liaison forte (200 -700 k. J/mole) • partage de 1 ou plusieurs paires électrons pour compléter leur couche électronique extérieure à 8 électrons • Ex. molécules d’éléments non métallique : O 2, N 2, CH 4 , diamant • Molécules avec atomes dissimilaires: H 2 O, HNO 3, Si. O 2 • c’est la liaison la plus forte, cohésion du diamant Cas particulier: les liaisons de coordination: transfert d’un doublet vers une lacune électronique!

Les liaisons ioniques • grande différence d’électronégativités • liaison forte dans le solide (600 -1500 k. J/mole), plus faible dans l’eau 41 k. J/mole • formée à partir d’un élément métallique et d’un non-métallique • Halogénures alcalins (Na. Cl, KCl, . . . ), oxydes (céramiques) Mg. O, Ca. O, … • • les forces électrostatiques assurent la cohésion • solubles dans l’eau, pt de fusion et d’ébullition élevés L’atome métallique donne son électron célibataire et le non-métallique l’accepte

Les liaisons métalliques • atomes d’électronégativités faibles possédant peu d’électrons sur la couche externe • énergie de liaison (70 -850 k. J/mole) • Les électrons périphériques ne sont plus attachés à un atome • Ils sont délocalisés dans le solide sous forme de nuage qui assure la cohésion

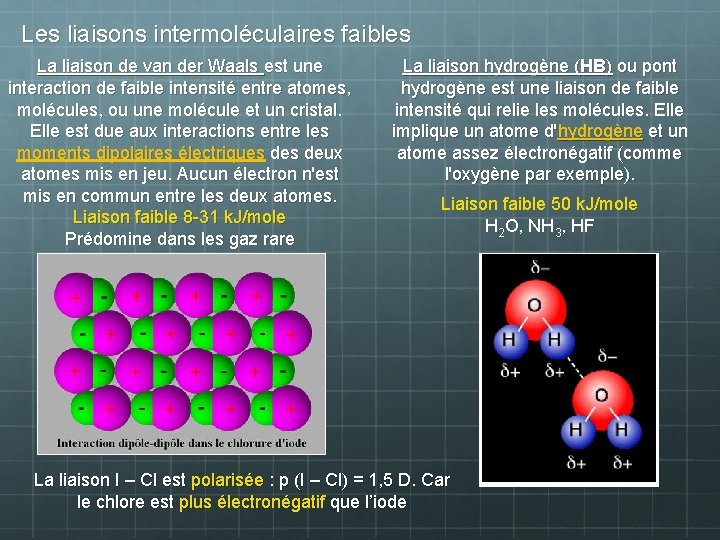
Les liaisons intermoléculaires faibles La liaison de van der Waals est une interaction de faible intensité entre atomes, molécules, ou une molécule et un cristal. Elle est due aux interactions entre les moments dipolaires électriques deux atomes mis en jeu. Aucun électron n'est mis en commun entre les deux atomes. Liaison faible 8 -31 k. J/mole Prédomine dans les gaz rare La liaison hydrogène (HB) ou pont hydrogène est une liaison de faible intensité qui relie les molécules. Elle implique un atome d'hydrogène et un atome assez électronégatif (comme l'oxygène par exemple). Liaison faible 50 k. J/mole H 2 O, NH 3, HF La liaison I – Cl est polarisée : p (I – Cl) = 1, 5 D. Car le chlore est plus électronégatif que l’iode

Dipôle électrostatique La nature des liaisons détermine en grande partie les propriétés des phases condensées (solide ou liquide) : ductilité des métaux, fragilité des céramiques, transparence, conductivité, comportements des polymère, etc. .

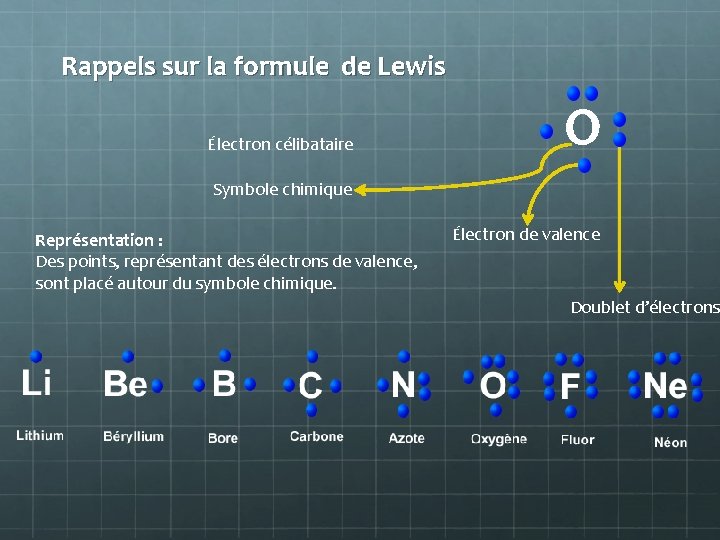
Rappels sur la formule de Lewis Électron célibataire O Symbole chimique Représentation : Des points, représentant des électrons de valence, sont placé autour du symbole chimique. Électron de valence Doublet d’électrons

HCl : chlorure d'hydrogène H : hydrogène (Z = 1) 1 s 1 Cl : chlore (Z = 17) 1 s 12 s 22 p 63 s 23 p 5 1 7 He : 1 s 2 Ar : 1 s 12 s 22 p 63 s 23 p 6 1 1 0 3 H Cl Modèle de Lewis de la molécule HCl

SOURCES ET REMERCIEMENTS : 1. Réaliser à partir du diaporama : Tableau périodique des éléments par Éric Boucher, Frédéric Lafrance, Olivier Rousseau, Francis Santerre. 2. Et du diaporama de Julien Geandrot : modèle d’une molécule. Modifier et compléter par Félix-emmanuel Roman.