Chapitre 2 Quest ce quun atome Vous devez

























- Slides: 29

Chapitre 2 : Qu’est ce qu’un atome ? • Vous devez d ’abord comprendre ce qui est écrit puis le recopier en respectant scrupuleusement le plan. • Vous rencontrerez certains exercices. Vous devez absolument les faire avant de poursuivre. • Pour vous déplacer, cliquez sur les boutons pour atteindre les paragraphes.

I – La composition de l’atome

1 - Représentation o Une représentation simplifiée est appelée modèle. Modèle de l ’atome: n un noyau central (10 -15 m soit 100 000 fois plus petit que l ’atome) n des électrons répartis en couches autour du noyau (10 -10 m) n du vide (la structure de la matière est essentiellement lacunaire)

2 – Le noyau est constitué o de protons particules chargées positivement o de neutrons Particules électriquement neutres. n L’ensemble s’appelle les nucléons

3 – Notation symbolique o Un atome est représenté par son symbole. Son symbole est une majuscule, éventuellement suivi d’une minuscule.

n Le nombre de charge ou numéro atomique Z d ’un atome est le nombre de protons qu’il contient. n Le nombre de nucléons d ’un noyau est représenté par la lettre A et est appelé nombre de masse. n Le nombre de neutrons N dans le noyau vaut donc : N = A - Z

Exercice 1 : o Compléter le tableau

II – Le cortège électronique

o L’ensemble des électrons d’un atome s’appelle le cortège électronique. o Les électrons tournent autour du noyau de façon désordonnée. Ils sont tous identiques. o Leur symbole est e-.

1 – Les couches électroniques o Les électrons se répartissent autour du noyau sur plusieurs couches, du centre vers l'extérieur. o La couche la plus éloignée du noyau qui contient des électrons est appelée couche externe (les autres couches sont des couches internes). o Les électrons de cette couche externe sont appelés électrons périphériques.

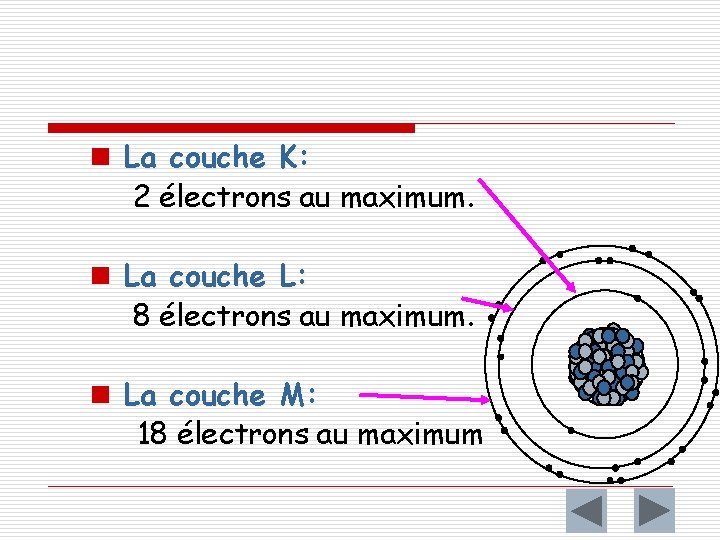
2 – Règles de remplissage des couches électroniques o o Première règle n Une couche électronique ne peut contenir qu'un nombre limité d'électrons. n La couche K (première couche, la plus proche du noyau) peut contenir un maximum de 2 électrons (c'est-à-dire qu'elle peut contenir 0; 1 ou 2 électrons). n La couche L (deuxième couche) peut contenir un maximum de 8 électrons (c'est-à-dire qu'elle peut contenir 0; 1; . . . ; 7 ou 8 électrons). n La couche M (troisième couche) peut contenir un maximum de 18 électrons Lorsqu'une couche est pleine on dit qu'elle est saturée.

n La couche K: 2 électrons au maximum. n La couche L: 8 électrons au maximum. n La couche M: 18 électrons au maximum

o Deuxième règle n Le remplissage des couches électroniques s'effectue en commençant par la couche K. Lorsqu'elle est saturée on remplit la couche L et ainsi de suite ; mais uniquement pour les 18 premiers éléments. o Le résultat de cette répartition des électrons se nomme la structure électronique de l’atome.

o Exemple: Pour un atome de carbone Z=6. Le noyau de cet atome possède donc 6 protons. Cet atome étant électriquement neutre, il possède 6 électrons qu'il faut répartir. En utilisant les règles précédentes, on établit la formule électronique du carbone. Soit: (K)2(L)4.

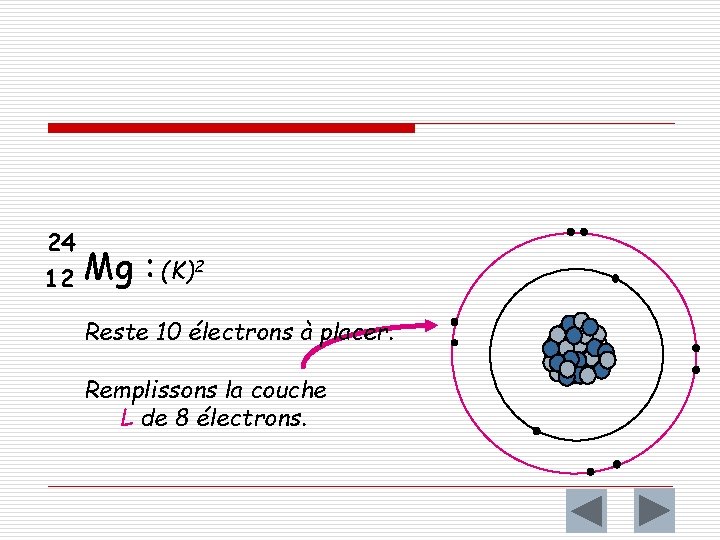
Exemple o Répartissons ensemble les électrons d ’un noyau de magnésium 12 Mg 24 Mg 12 : 12 électrons Plaçons d'abord 2 électrons sur la couche K celle qui est la plus près du noyau.

24 12 Mg : (K)2 Reste 10 électrons à placer. Remplissons la couche L de 8 électrons.

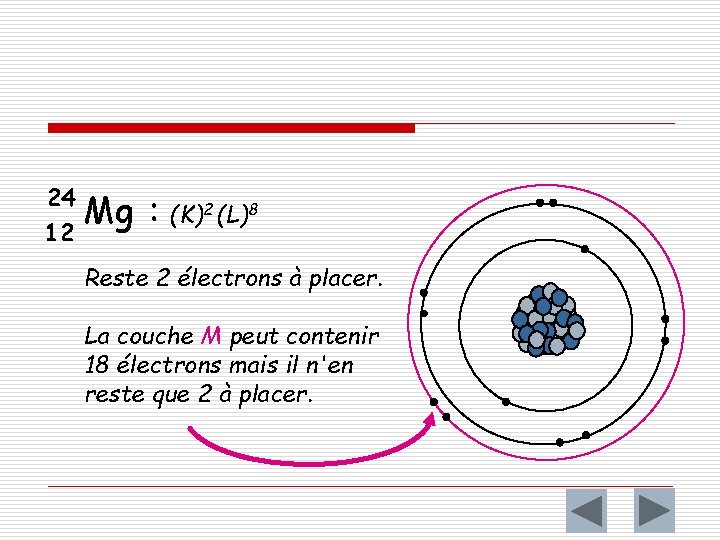
24 12 Mg : (K)2 (L)8 Reste 2 électrons à placer. La couche M peut contenir 18 électrons mais il n'en reste que 2 à placer.

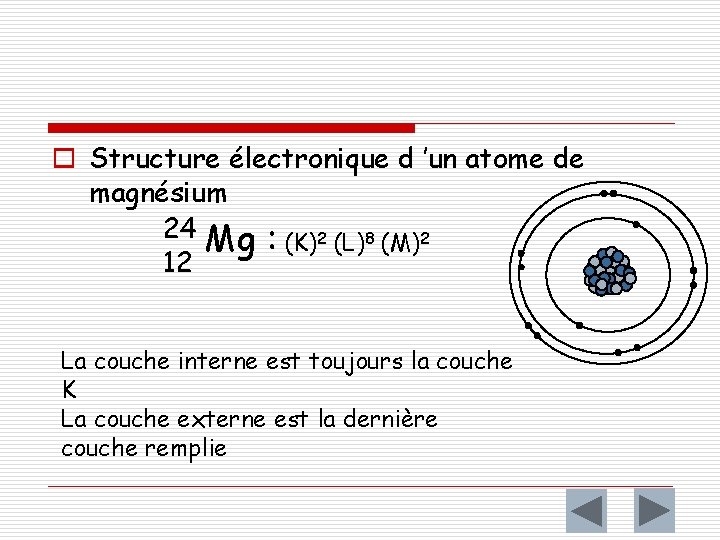
o Structure électronique d ’un atome de magnésium 24 Mg : (K)2 (L)8 (M)2 12 La couche interne est toujours la couche K La couche externe est la dernière couche remplie

Exercice 2 : o Donner la structure électronique : 40 de l ’argon: Ar 18 11 du bore: B 5

III – Les caractéristiques de l’atome

1 – La masse atomique o La masse d’un atome dépend de sa nature. o La masse de chaque électron vaut me = 9, 1. 10 -31 kg Tous les électrons ont la même masse qui est négligeable par rapport à celle du noyau de l’atome.

Exercice 3 : Calculer la masse des électrons présents dans un atome de mercure 202 Hg 80

o Dans un noyau chaque nucléon a une masse 2000 fois plus grande que celle d ’un électron c ’est à dire: mn = 1, 7. 10 -27 kg. kg

Exercice 4 : Calculer la masse d ’un noyau de mercure 202 Hg 80

Exercice 5 : A quoi est égale la masse d ’un atome de mercure?

La masse de l’atome est essentiellement concentrée dans son noyau. m(atome) = Z x m(proton) + N x m(neutron) + Z x m(électron) ≈ A x m(nucléon)

2 – La charge d’un atome o Un électron porte une charge négative. o L’atome étant électriquement neutre, le noyau porte une charge équivalente mais positive.

o Charge électrique du proton = + e = 1, 6. 10 -19 C o Charge électrique de l’électron : - e = - 1, 6. 10 -19 C o Charge électrique du neutron = 0 C Avec e est la charge électrique élémentaire

La charge totale d’un atome est nulle : un atome est électriquement neutre.