Chapitre 1 Le modle de l atome Vous

























- Slides: 29

Chapitre 1 : Le modèle de l ’atome • Vous devez d ’abord comprendre ce qui est écrit puis le recopier en respectant scrupuleusement le plan. • Vous rencontrerez certains exercices. Vous devez absolument les faire avant de poursuivre. • Pour vous déplacer, cliquez sur les boutons pour atteindre les paragraphes.

II – La composition de l’atome

1 - Représentation o Une représentation simplifiée est appelée modèle. Modèle de l ’atome: n n n un noyau central (10 -15 m soit 100 000 fois plus petit que l ’atome) des électrons répartis en couches autour du noyau (10 -10 m) du vide (la structure de la matière est essentiellement lacunaire)

2 – Le noyau est constitué o o n de protons particules chargées positivement de neutrons Particules électriquement neutres. L’ensemble s’appelle les nucléons

3 – Notation symbolique o Un atome est représenté par son symbole. Son symbole est une majuscule, éventuellement suivi d’une minuscule.

n n n Le nombre de charge ou numéro atomique Z d ’un atome est le nombre de protons qu’il contient. Le nombre de nucléons d ’un noyau est représenté par la lettre A et est appelé nombre de masse. Le nombre de neutrons N dans le noyau vaut donc : N = A - Z

Exercice 1 : o Compléter le tableau

III – Le cortège électronique

o o o L’ensemble des électrons d’un atome s’appelle le cortège électronique. Les électrons tournent autour du noyau de façon désordonnée. Ils sont tous identiques. Leur symbole est e-.

1 – Les couches électroniques o o o Les électrons se répartissent autour du noyau sur plusieurs couches, du centre vers l'extérieur. La couche la plus éloignée du noyau qui contient des électrons est appelée couche externe (les autres couches sont des couches internes). Les électrons de cette couche externe sont appelés électrons périphériques.

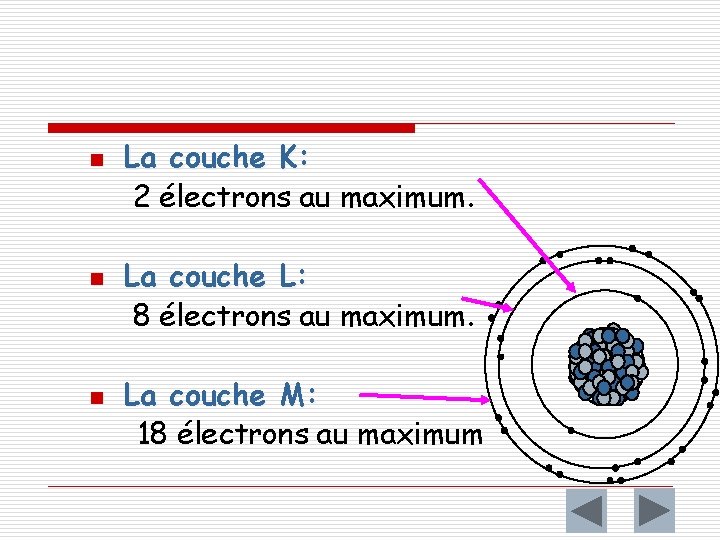
2 – Règles de remplissage des couches électroniques o Première règle n n o Une couche électronique ne peut contenir qu'un nombre limité d'électrons. La couche K (première couche, la plus proche du noyau) peut contenir un maximum de 2 électrons (c'est-à-dire qu'elle peut contenir 0; 1 ou 2 électrons). n La couche L (deuxième couche) peut contenir un maximum de 8 électrons (c'est-à-dire qu'elle peut contenir 0; 1; . . . ; 7 ou 8 électrons). n La couche M (troisième couche) peut contenir un maximum de 18 électrons Lorsqu'une couche est pleine on dit qu'elle est saturée.

n n n La couche K: 2 électrons au maximum. La couche L: 8 électrons au maximum. La couche M: 18 électrons au maximum

o Deuxième règle n o Le remplissage des couches électroniques s'effectue en commençant par la couche K. Lorsqu'elle est saturée on remplit la couche L et ainsi de suite ; mais uniquement pour les 18 premiers éléments. Le résultat de cette répartition des électrons se nomme la structure électronique de l’atome.

o Exemple: Pour un atome de carbone Z=6. Le noyau de cet atome possède donc 6 protons. Cet atome étant électriquement neutre, il possède 6 électrons qu'il faut répartir. En utilisant les règles précédentes, on établit la formule électronique du carbone. Soit: (K)2(L)4.

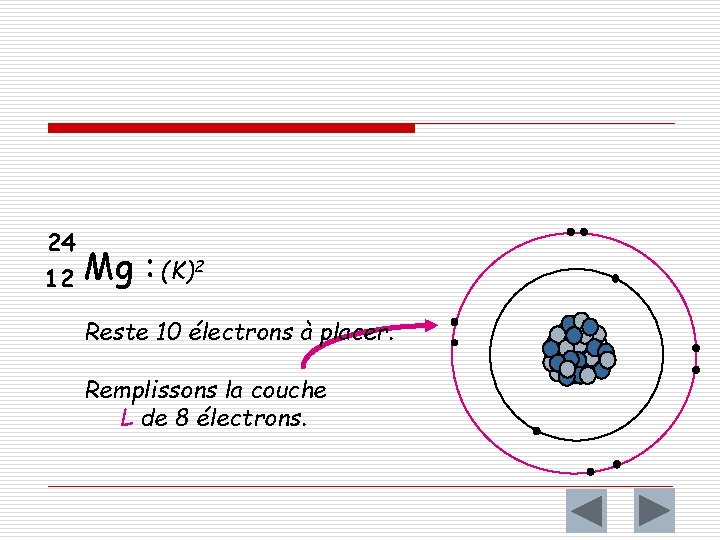
Exemple o Répartissons ensemble les électrons d ’un noyau de magnésium 12 Mg 24 Mg 12 : 12 électrons Plaçons d'abord 2 électrons sur la couche K celle qui est la plus près du noyau.

24 12 Mg : (K)2 Reste 10 électrons à placer. Remplissons la couche L de 8 électrons.

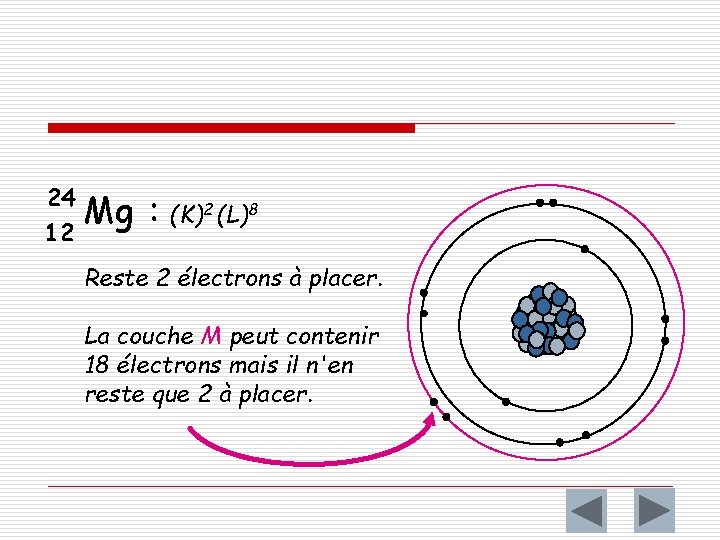
24 12 Mg : (K)2 (L)8 Reste 2 électrons à placer. La couche M peut contenir 18 électrons mais il n'en reste que 2 à placer.

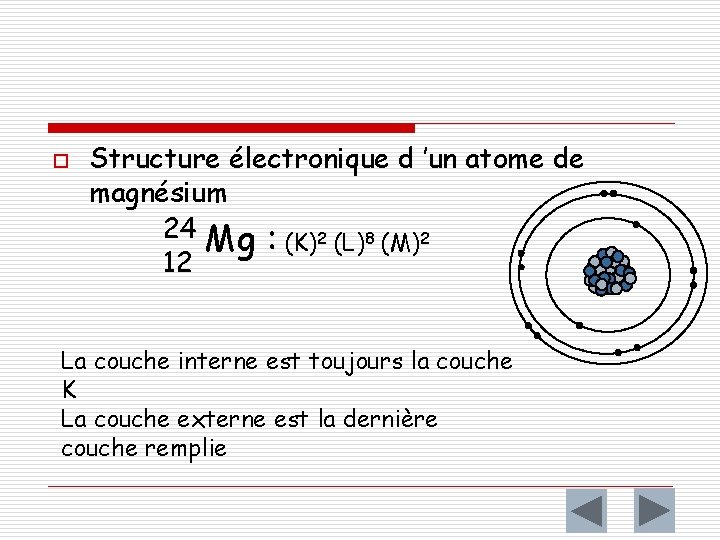
o Structure électronique d ’un atome de magnésium 24 Mg : (K)2 (L)8 (M)2 12 La couche interne est toujours la couche K La couche externe est la dernière couche remplie

Exercice 2 : o Donner la structure électronique : 40 de l ’argon: Ar 18 11 du bore: B 5

IV – Les caractéristiques de l’atome

1 – La masse atomique o o La masse d’un atome dépend de sa nature. La masse de chaque électron vaut me = 9, 1. 10 -31 kg Tous les électrons ont la même masse qui est négligeable par rapport à celle du noyau de l’atome.

Exercice 3 : Calculer la masse des électrons présents dans un atome de mercure 202 Hg 80

o Dans un noyau chaque nucléon a une masse 2000 fois plus grande que celle d ’un électron c ’est à dire: mn = 1, 7. 10 -27 kg. kg

Exercice 4 : Calculer la masse d ’un noyau de mercure 202 Hg 80

Exercice 5 : A quoi est égale la masse d ’un atome de mercure?

La masse de l’atome est essentiellement concentrée dans son noyau. m(atome) = Z x m(proton) + N x m(neutron) + Z x m(électron) ≈ A x m(nucléon)

2 – La charge d’un atome o o Un électron porte une charge négative. L’atome étant électriquement neutre, le noyau porte une charge équivalente mais positive.

o Charge électrique du proton = + e = 1, 6. 10 -19 C o Charge électrique de l’électron : - e = - 1, 6. 10 -19 C o Charge électrique du neutron = 0 C Avec e est la charge électrique élémentaire

La charge totale d’un atome est nulle : un atome est électriquement neutre.