Standar Kompetensi 1 Memahami struktur atom sifat sifat







- Slides: 11


Standar Kompetensi 1 Memahami struktur atom, sifat – sifat periodik unsur dan ikatan kimia.

Kompetensi Dasar 1. 1 Mamahami struktur atom berdasarkan teori atom Bohr, sifat – sifat unsur, massa atom relatif, dan sifat – sifat periodik unsur dalam tabel periodik serta menyadari keteraturannya, melalui pemahaman konfigurasi elektron.

Indikator Menentukan massa atom relatif dan massa molekul relatif berdasarkan tabel periodik.

Massa atom relatif ( Ar ) Massa 1 atom unsur Massa atom relatif ( Ar ) = ---------------Massa 1 atom standar Sebagai atom standar adalah karbon-12 Maka semua unsur diperbandingkan terhadap karbon-12. Sehingga: Massa rata – rata 1 atom unsur Ar unsur = -----------------------

Menurut perjanjian bahwa : Massa atom C-12 = 12 1/12 massa atom C-12 = 1 Sma, sehingga massa 1 atom C-12 = 12 Sma. Contoh : Massa 1 atom belerang Ar Belerang ( S ) = ---------------1/12 massa 1 atom C-12 = 32, 06 = 32

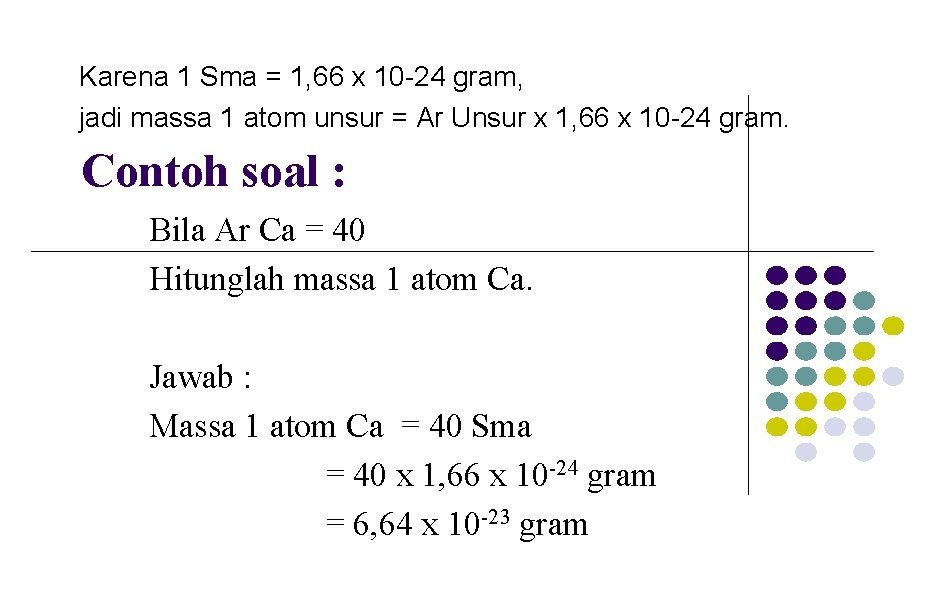
Mengubah satuan sma menjadi gram Massa 1 atom unsur Ar unsur = ----------------1/12 massa 1 atom C-12 Massa 1 atom Unsur = Ar UNSUR x 1/12 MASSA 1 ATOM C-12 = Ar UNSUR x 1 Sma. Karena 1 Sma = 1, 66 x 10 -24 gram, jadi massa 1 atom unsur = Ar Unsur x 1, 66 x 10 -24 gram.

Karena 1 Sma = 1, 66 x 10 -24 gram, jadi massa 1 atom unsur = Ar Unsur x 1, 66 x 10 -24 gram. Contoh soal : Bila Ar Ca = 40 Hitunglah massa 1 atom Ca. Jawab : Massa 1 atom Ca = 40 Sma = 40 x 1, 66 x 10 -24 gram = 6, 64 x 10 -23 gram

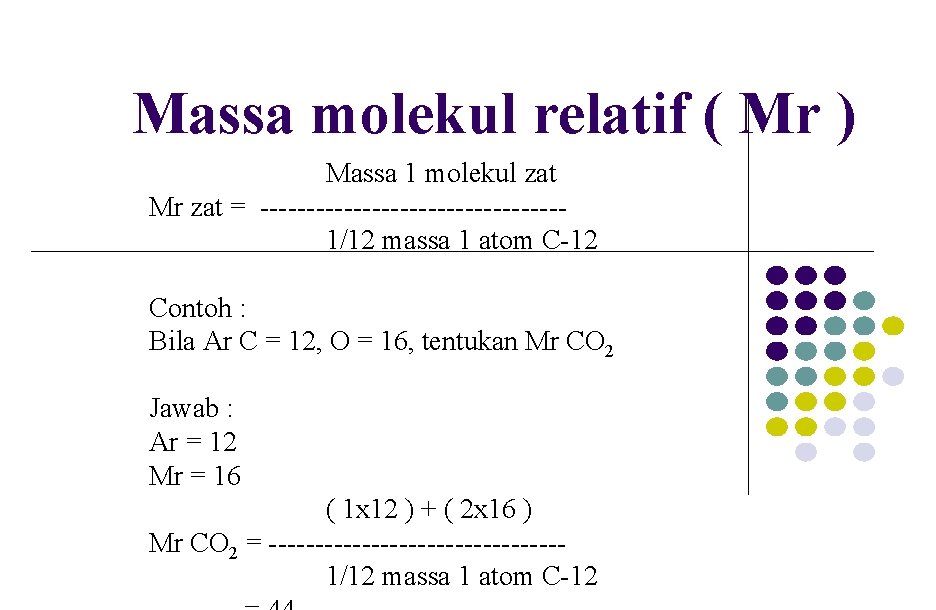
Massa molekul relatif ( Mr ) Massa 1 molekul zat Mr zat = ----------------1/12 massa 1 atom C-12 Contoh : Bila Ar C = 12, O = 16, tentukan Mr CO 2 Jawab : Ar = 12 Mr = 16 ( 1 x 12 ) + ( 2 x 16 ) Mr CO 2 = ----------------1/12 massa 1 atom C-12

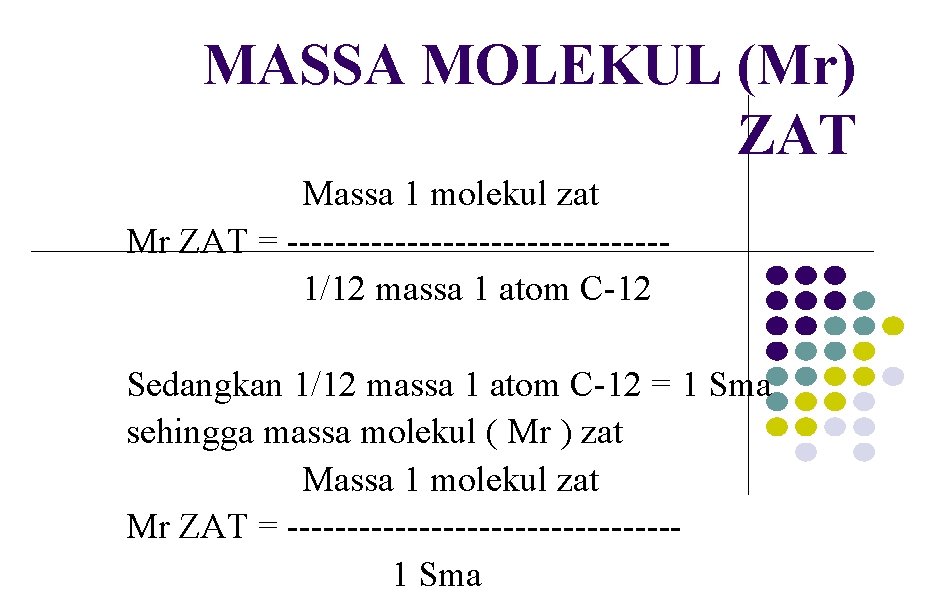
MASSA MOLEKUL (Mr) ZAT Massa 1 molekul zat Mr ZAT = ----------------1/12 massa 1 atom C-12 Sedangkan 1/12 massa 1 atom C-12 = 1 Sma sehingga massa molekul ( Mr ) zat Massa 1 molekul zat Mr ZAT = ----------------1 Sma

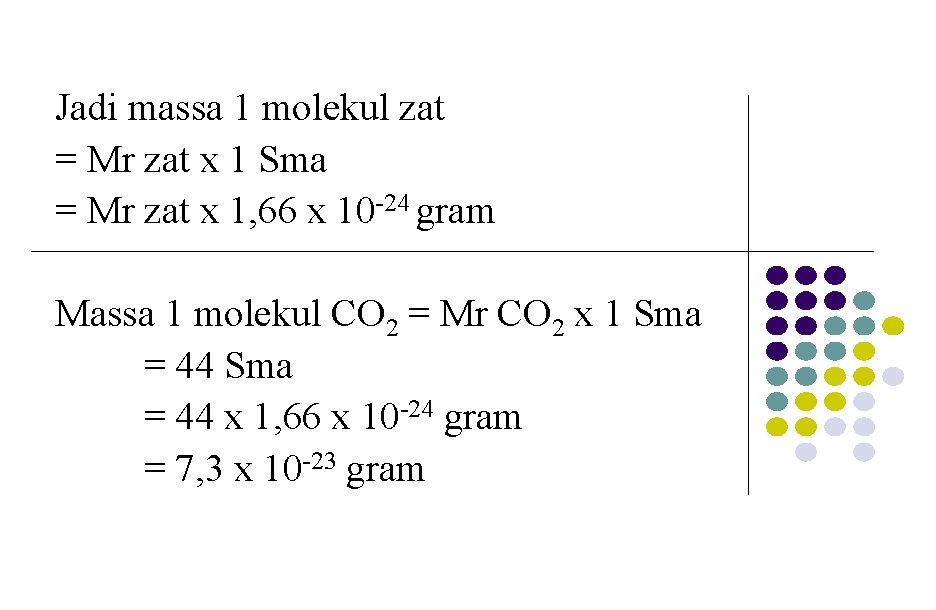
Jadi massa 1 molekul zat = Mr zat x 1 Sma = Mr zat x 1, 66 x 10 -24 gram Massa 1 molekul CO 2 = Mr CO 2 x 1 Sma = 44 x 1, 66 x 10 -24 gram = 7, 3 x 10 -23 gram
 Standar kompetensi dan kompetensi dasar mata pelajaran ips
Standar kompetensi dan kompetensi dasar mata pelajaran ips Jelaskan kompetensi berdasarkan strata kompetensi
Jelaskan kompetensi berdasarkan strata kompetensi Hubungan kompetensi inti kompetensi dasar dan indikator
Hubungan kompetensi inti kompetensi dasar dan indikator Pertanyaan tentang kompetensi inti dan kompetensi dasar
Pertanyaan tentang kompetensi inti dan kompetensi dasar Kompetensi inti dan kompetensi dasar
Kompetensi inti dan kompetensi dasar Standar kompetensi lulusan kurikulum 2013
Standar kompetensi lulusan kurikulum 2013 Contoh standar kompetensi
Contoh standar kompetensi Definisi fisioterapi
Definisi fisioterapi Task skill bidan adalah
Task skill bidan adalah Draf
Draf Standar kompetensi pranata laboratorium pendidikan
Standar kompetensi pranata laboratorium pendidikan Contoh iktisar
Contoh iktisar