STANDAR KOMPETENSI 1 l Memahami struktur atom sifat














- Slides: 17


STANDAR KOMPETENSI 1 l Memahami struktur atom, sifat – sifat periodik unsur dan ikatan kimia.

KOMPETENSI DASAR 1. 1 l Memahami struktur atom berdasarkan teori atom Bohr, sifat – sifat unsur, massa atom relatif, dan sifat – sifat periodik unsur dalam tabel periodik serta menyadari keteraturannya, melalui pemahaman konfigurasi elektron.

INDIKATOR l l l Menentukan partikel dasar proton, elektron dan neutron. Menentukan konfigurasi lektron dan elektron valensi. Menentukan hubungan konfigurasi elektron dengan letak unsur dalam tabel – tabel periodik. Menentukan massa atom relatif berdasarkan tabel periodik. Mengklasifikasikan unsur kedalam isotop, iosbar, dan isoton.

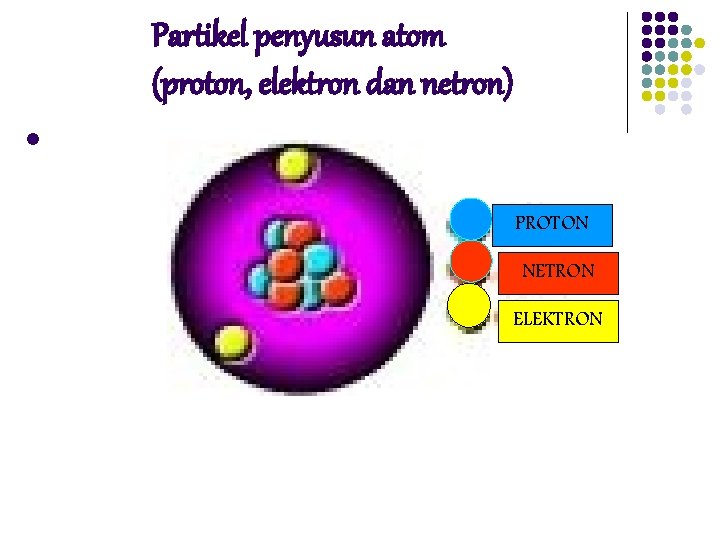
Partikel penyusun atom (proton, elektron dan netron) l l Konsep dari aturan inti yang dipopulerkan oleh Rutherford adalah inti mengandung sejumlah proton yang sama dengan nomor atomnya dan sejumlah partikel netral yang disebut netron Suatu atom terdiri dari proton dan netron yang terdapat dalam inti sedangkan elektron berada pada kulit mengelilingi inti, jumlah proton sama dengan elektron, sedangkan netron merupakan selisih dari nomor masa dengan proton

Partikel penyusun atom (proton, elektron dan netron) l PROTON NETRON ELEKTRON

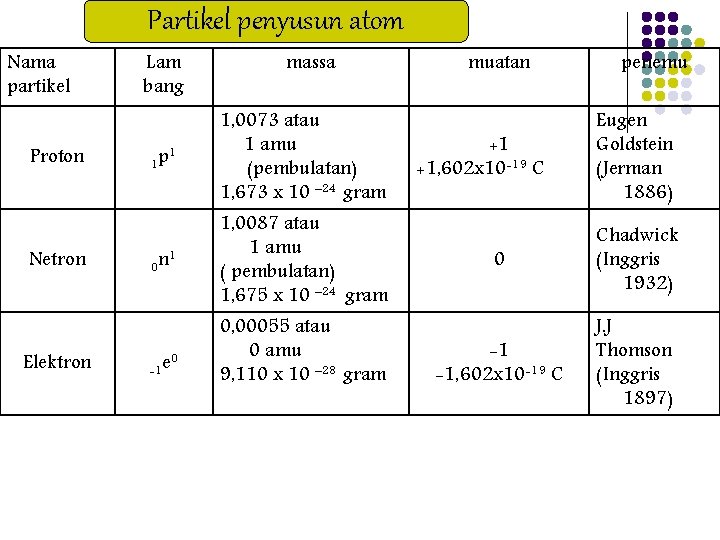
Partikel penyusun atom Nama partikel Proton Netron Elektron Lam bang massa 1 1 p 1, 0073 atau 1 amu (pembulatan) 1, 673 x 10 – 24 gram 0 n 1, 0087 atau 1 amu ( pembulatan) 1, 675 x 10 – 24 gram 1 0 -1 e 0, 00055 atau 0 amu 9, 110 x 10 – 28 gram muatan +1 +1, 602 x 10 -19 C penemu Eugen Goldstein (Jerman 1886) 0 Chadwick (Inggris 1932) -1 -1, 602 x 10 -19 C J. J Thomson (Inggris 1897)

Secara umum dapat dituliskan A X Z Keterangan: X = Lambang atom Z = Nomor atom = jumlah proton = jumlah elektron A = Nomor massa = jumlah proton + netron Contoh. Tentukan jumlah proton, elektron dan netron dari unsur K 39 Proton = nomor atom = 19 Elektron = proton = 19 Netron = massa – proton = 39 – 19 =20 19

39 +1 K 19

Tentukan proton, elektron dan netron

C. KONFIGURASI ELEKTRON (SUSUNAN ELEKTRON PADA KULIT) Nomor atom menunjukkan jumlah proton, untuk atom yang netral jumlah proton sama dengan jumlah elektron. Kembali perhatikan unsur Natrium : Na nomor atom 11 terletak pada periode 3 dan golongan IA Periode 1 ada 2 unsur = 2 elektron Periode 2 ada …………. unsur = ……… elektron Periode 3 ada …………. unsur = ……. . elektron Maka konfigurasi elektron unsur Na 2, 8, 1 Kulit elektron = K, L, M Jumlah kulit 3, artinya periode ke 3 Jumlah elektron valensi (elektron pada kulit terluar)= 1 artinya golongan IA ELEKTRON VALENSI MAX untuk golongan utama = 8

Dengan memperhatikan tabel periodik tentukan konfigurasi elektron dari: v. C, F, Mg, P, Ar, dan Ca. Secara umum konfigurasi elektron pada setiap kulit dengan rumus 2 n 2 kulit , maka pada : kulit K : n = 1 ada 2. 12 = 2 elektron Kulit L : n = 2 2. 22= 8 elektron Kulit M : …………………………. Kulit N : …………………………. Kulit O : …………………………. Kulit P : …………………………. Kulit Q : …………………………. Maka susunan elektron pada setiap kulit 2, 8, 18, 32, dst Ingat elektron valensi max ? n=

Contoh: konfigurasi elektron unsur As nomor atom 33. maka konfigurasi elektronnya adalah 2, 8, 18, 5 Kulit ………… elektron valensi ………… Masih ingat dengan periode dan golongan? Dari konfigurasi elektron tentunya dapat juga ditentukan periode dan golongan. 33 As terletak pada periode ………………. golongan ……………. Berdasarkan jumlah elektron pada setiap kulit tentukan konfigurasi elektron, periode dan golongan dari: 10 Ne, 13 Al, 16 S, 19 K, 31 Ga, 35 Br, 38 Sr, 53 I, 56 Ba

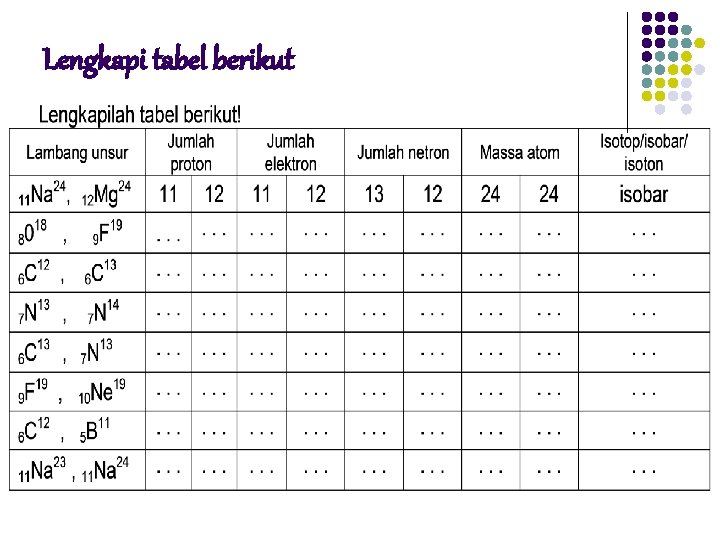
Isotop, isobar dan isoton l Isotop Penemuan dari J. J. Thomson bahwa dari atom yang sama dapat mempunyai massa berbeda, unsur yang mempunyai perbedaan massa ini disebut dengan isotop. Unsur yang ada dialam dengan nomor atom sama tapi nomor massanya berbeda disebut dengan isotop, seperti 10 Ne 20 , 21 22 Ne Ne 10 10

l l Isobar Unsur dengan nomor masa yang sama disebut isobar Contoh 6 C 13 , 7 N 13 (massa atom C=13 dan N = 13) Isoton jumlah netron sama Contoh 7 N 14 , 8 O 15 (netron N = 14 – 7 =7 dan O = 15 – 8 = 7) (nomor massa atau massa atom relatif yang ada dalam tabel periodik pada umumnya adalah massa atom yang stabil atau yang banyak terdapat dialam)

Lengkapi tabel berikut

Isoelektron Atom-atom yang mempunyai jumlah elektron sama karena pelepasan atau penangkapan elektron. 11 + Na = 9 F
 Kompetensi dasar ips
Kompetensi dasar ips Peta konsep sifat wajib allah
Peta konsep sifat wajib allah Sifat - sifat -sifat pemerintah reformasi di indonesia
Sifat - sifat -sifat pemerintah reformasi di indonesia Avl tree adalah
Avl tree adalah Sifat-sifat struktur data tree
Sifat-sifat struktur data tree Hubungan kompetensi inti kompetensi dasar dan indikator
Hubungan kompetensi inti kompetensi dasar dan indikator Pertanyaan tentang kompetensi inti dan kompetensi dasar
Pertanyaan tentang kompetensi inti dan kompetensi dasar Kompetensi inti dan kompetensi dasar
Kompetensi inti dan kompetensi dasar Jelaskan kompetensi berdasarkan strata kompetensi
Jelaskan kompetensi berdasarkan strata kompetensi Contoh iktisar
Contoh iktisar Contoh kompetensi bidan
Contoh kompetensi bidan Standar kompetensi pranata laboratorium pendidikan
Standar kompetensi pranata laboratorium pendidikan Kompetensi inti adalah
Kompetensi inti adalah Kompetensi inti bidan
Kompetensi inti bidan Contoh indikator pembelajaran
Contoh indikator pembelajaran Orientasi pada hasil level 1
Orientasi pada hasil level 1 Standar kompetensi lulusan kurikulum 2013
Standar kompetensi lulusan kurikulum 2013 Rumusan capaian pembelajaran
Rumusan capaian pembelajaran