Schema tipo di purificazione Lisi cellulare non necessaria












- Slides: 12

Schema tipo di purificazione • Lisi cellulare (non necessaria in caso di esoenzimi) • Passaggi di chiarificazione • Passaggi di arricchimento e purificazione preliminare a bassa efficienza • Passaggi di purificazione ad alta efficienza

Vantaggi e svantaggi • • Rese molto alte • Procedure operative non complesse • Strutture tecnologiche ed impiantistiche non costose Bassa eficienza di purificazione (incrementi di attività specifica medio-bassi)

Trattamenti preliminari (non prevedono la precipitazione delle proteine) • Frazionamento mediante filtrazione – Non richiedono la gestione di un precipitato solido, la sua separazione e risospensione – Sono applicabili quando il materiale da separare ha peso molecolare molto alto o molto basso, facilmente separabile dalla miscela di altri componenti

Trattamenti preliminari (precipitazioni delle proteine) • • • Variazioni del valore di p. H Riscaldamento della soluzione Precipitazione con sali inorganici Trattamento con solventi organici Precipitazione con PEG e altri polimeri miscibili con acqua

Criteri di scelta • Conoscenza delle caratteristiche chimico-fisiche dell’enzima da purificare – Termostabilità – Punto isoelettrico – Possibili effetti denaturanti ed inibitori derivanti dall’aumento della forza ionica e dal tipo di sali usati – Possibili effetti denaturanti ed inibitori derivanti dai solventi e dai polimeri utilizzati • Accurate prove preliminari

Variazione di p. H • Dipendenza della solubilità delle proteine dal valore di p. H (alterazioni delle interazioniche e legami idrogeno che permettono alla proteina di rimanere in soluzione con uno stato minimo di energia e conseguente diminuzione dell’acqua di solvatazione) • Effetto massimo al punto isoelettrico della proteina (assenza di fenomeni di repulsione e conseguente precipitazione) • Conoscenza del punto isoelettrico o almeno dell’intervallo di stabilità dell’enzima • Importanza dell’agitazione per evitare brusche variazioni di p. H locali

Riscaldamento della soluzione • Denaturazione di molecole termolabili, precipitazione, separazione meccanica ed eliminazione del precipitato

Precipitazione con sali inorganici • Salting in: aumento della solubilità delle proteine a basse concentrazioni di sali • Salting out: perturbazioni delle interazioni molecolari in soluzione (neutralizzazioni di cariche e sottrazione dell’acqua di solvatazione) ad alte concentrazioni saline conseguente precipitazione delle stesse senza alterarne l’attività • Sali tipicamente utilizzati: Na. Cl, solfato di sodio e di ammonio, sali di calcio e magnesio • Possibilità di eseguire precipitazioni frazionate con differenti concentrazioni in più passaggi

Precipitazione con solfato di ammonio • Economico, facilmente reperibile con un buon grado di purezza, molto solubile anche a basse temperature e a elevate molarità, stabilizza le proteine prevenendone la denaturazione, batteriostatico • Importanza della diluizione del materiale di partenza • Separazione meccanica del precipitato, risospensione del precipitato ed eliminazione mediante dialisi del sale • Svantaggi nell’uso su scala industriale: grandi quantità di sali necessari per volumi di soluzioni industriali, problemi di incrostazioni e di smaltimento del sale dopo la dialisi


Trattamento con solventi organici • le proteine sono macroioni la cui forza di attrazione è inversamente proporzionale alla costante dielettrica del mezzo disperdente • I solventi organici abbassano la costante dielettrica dell’acqua diminuendo la solubilità proteica • Solventi organici magiormente utilizzati: acetone, metanolo, rimossi dopo la precipitazione mediante evaporazione • Principali limiti: solventi spesso tossici, infiammabili, spesso anche agenti denaturanti delle proteine

Precipitazione con polietilenglicole (peg) e altri polimeri miscibili con acqua • Principio analogo alla floculazione e coagulazione • Polimeri non denaturanti per le proteine, facilmente reperibili, a peso molecolare variabile, facilmente eliminabili dopo la separazione meccanica del precipitato
 Tecniche di purificazione
Tecniche di purificazione Tecniche di purificazione
Tecniche di purificazione Meiosi
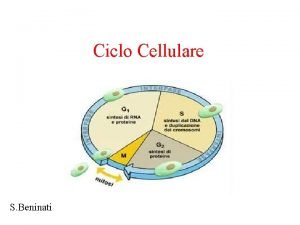
Meiosi Ciclo cellulare schema
Ciclo cellulare schema Mappa concettuale metabolismo cellulare
Mappa concettuale metabolismo cellulare Metabolismo cellulare mappa
Metabolismo cellulare mappa Vyparovanie a var
Vyparovanie a var čím se liší var vody od vypařování?
čím se liší var vody od vypařování? James lisi
James lisi Prchavé kvapaliny
Prchavé kvapaliny Dieu cherche encore des hommes forts lyrics
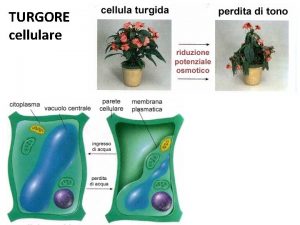
Dieu cherche encore des hommes forts lyrics Turgore della cellula
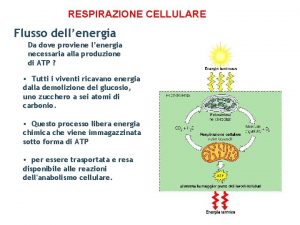
Turgore della cellula Formula respirazione cellulare
Formula respirazione cellulare