RULLY SUSILOWATI DEPT KIMIA FARMASI FFUA Copyright 1996






















- Slides: 26

RULLY SUSILOWATI DEPT. KIMIA FARMASI FFUA Copyright 1996 -2001 © Dale Carnegie & Associates, Inc.

ELEKTROKIMIA • merupakan cabang ilmu kimia yang mempelajari perubahan energi listrik dan energi kimia • prosesnya : redoks ( reduksi dan oksidasi ) • dari reaksi kimia spontan dapat dihasilkan energi yang dirubah menjadi energi listrik • Energi listrik digunakan untuk menghasilkan suatu reaksi kimia tidak spontan

Reaksi reduksi § R. pelepasan oksigen § R. pengikatan hidrogen § R. pengikatan elektron § R. penurunan bilangan oksidasi Contoh : C 6 H 5 NO 2 + 3 H 2 C 6 H 5 NH 2 + 2 H 2 O Fe(CN)63 - + e Fe(CN)64 - Ag+ + e Ag Pb 4+ + 2 e Pb 2+

Reaksi Oksidasi § R. pengikatan oksigen § R. pelepasan hidrogen § R. pelepasan elektron § R. peningkatan bilangan oksidasi Contoh : C 2 H 5 OH + O 2 C 6 H 18 O 6 Zn Mn. O 422 Cl- CH 3 COOH + H 2 O C 6 H 16 O 6 + H 2 Zn 2+ +2 e Mn. O 41 - + e Cl 2 + 2 e

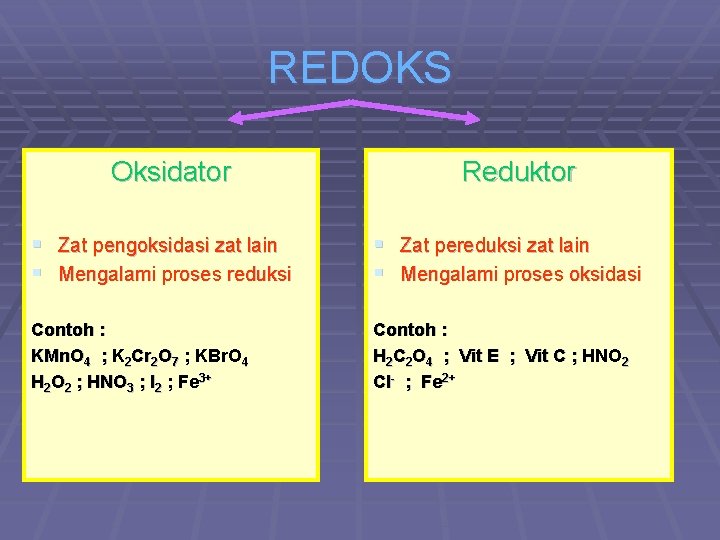
REDOKS Oksidator Reduktor § Zat pengoksidasi zat lain § Mengalami proses reduksi § Zat pereduksi zat lain § Mengalami proses oksidasi Contoh : KMn. O 4 ; K 2 Cr 2 O 7 ; KBr. O 4 H 2 O 2 ; HNO 3 ; I 2 ; Fe 3+ Contoh : H 2 C 2 O 4 ; Vit E ; Vit C ; HNO 2 Cl- ; Fe 2+

Redoks ( Reduksi – Oksidasi ) § Reaksi transfer elektron § Tidak dapat berlangsung sendiri-2 § Berjalan serempak / bersamaan Contoh : § 2 Fe 3+ + Sn 2+ § 5 H 2 O 2 + Mn. O 41 - + H+ § Br. O 3 - + 6 I- + 6 H+ 2 Fe 2+ + Sn 4+ 2 Mn 2+ + 5 O 2 + 8 H 2 O Br- + 3 I 2 + 3 H 2 O

Reaksi redoks tidak melibatkan elektron bebas 2 Fe 3+ + Sn 2+ 2 Fe 2+ + Sn 4+ 2 Fe 3+ + 2 e Sn 2+ 2 Fe 3+ + Sn 2+ 2 Fe 2+ ( reduksi ) Sn 4+ + 2 e ( oksidasi ) 2 Fe 2+ + Sn 4+ ( redoks ) Reaksi reduksi dan oksidasi masing-masing disebut : • Reaksi paruh • Setengah reaksi Reaksi redoks disebut : • Reaksi total

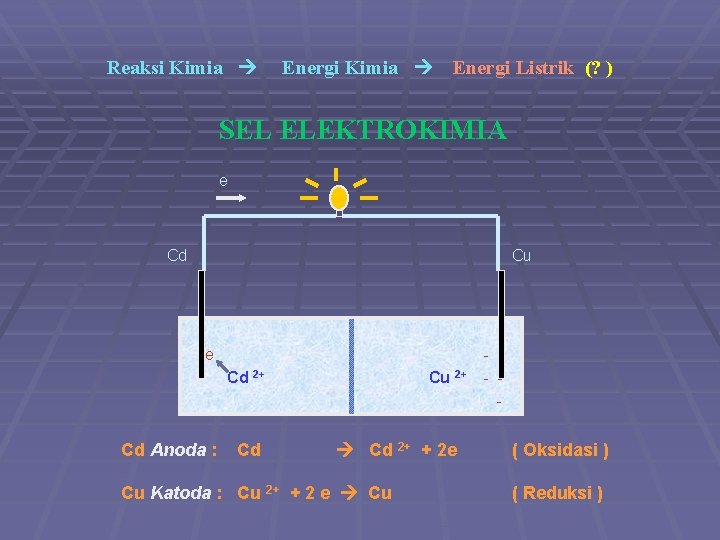
Reaksi Kimia Energi Listrik (? ) SEL ELEKTROKIMIA e Cd Cu e Cd 2+ Cd Anoda : Cd Cu 2+ Cd 2+ + 2 e Cu Katoda : Cu 2+ + 2 e Cu - - - ( Oksidasi ) ( Reduksi )

SEL ELEKTROKIMIA Terdiri dari : § Elektrolit § Elektroda : ● Anoda : Reaksi Oksidasi ● Katoda : Reaksi Reduksi

SEL ELEKTROKIMIA Sel Volta / Sel Galvani § Menghasilkan energi listrik § § § dari reaksi kimia/ energi kimia Anoda : kutub negatip Katoda : kutub positip Contoh : aki, baterai Sel Elektrolisis § Menghasilkan energi kimia § § § dari reaksi energi istrik Anoda : kutub positip Katoda : kutub negatip Contoh : alat penyepuh ( electroplating )

EMF ( Electromotive Force ) GGL ( Gaya Gerak Listrik ) adalah : Perbedaan potensial elektroda yang menyebabkan terjadinya arus listrik mengalir dari elektroda potensial tinggi ke elektroda potensial yang lebih rendah pada suatu sel elektrokimia. Satuan : Volt Alat untuk mengukur : Potensiometer Simbol : [ E ; ε ]

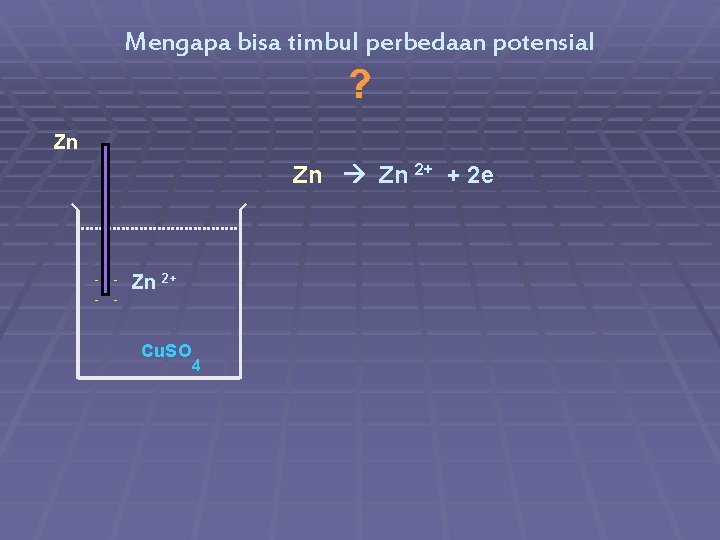
Mengapa bisa timbul perbedaan potensial ? Zn Zn 2+ + 2 e - - Zn 2+ Cu. SO 4

Penulisan Sel 1. Sel Galvani ditulis dengan setengah sel anoda (elektroda negatif) di sebelah kiri dan setengah sel katoda (elektroda positif ) di sebelah kanan. 2. Satu garis tegak/miring. Zn 2+ menunjukkan batas fasa, sedangkan 2 garis menunjukkan adanya jembartan garam. 3. Dua zat yang ada dalam fasa yang sama dipisahkan dengan tanda koma 4. Konsentrasi larutan dinyatakan dalam tanda kurung setelah rumus kimianya Contoh : Zn(s)/Zn 2+(1, 00 m) // Cu 2+(1, 00 m) /Cu (s) Zn(s)/ Zn 2+ (1, 00 m) / Cu 2+ (1, 00 m) /Cu (s) Pt/ Fe 2+, Fe 3+// H+/ H 2/ Pt

GGL & Reaksi Sel 1. GGL sel adalah jumlah potensial elektroda tunggal sesuai dengan reaksi yang terjadi di dalam sel/elektroda tersebut. 2. Apabila sel ditulis dengan elektroda negatif di sebelah kiri, maka elektron akan mengalir melalui rangkaian di luar sel dari KIRI ke KANAN , maka reaksi sel yang terjadi adalah SPONTAN dan GGL sel akan bertanda + 3. Reaksi yang terjadi pada elektroda sebelah kiri adalah oksidasi dan elektroda sebelah kana adalah reduksi Contoh : Zn(s)/Zn 2+ (1, 00 m)//Cu 2+ (1, 00 m)/Cu(s) Zn 2+(aq) + 2 e Cu 2+(aq) + 2 e Zn(s) + Cu 2+(aq) Cu(s) ( reaksi oksidasi ) + Zn 2+(aq) + Cu(s) ( reaksi reduksi ) ( reaksi sel )

PERHITUNGAN EMF E = E ANODA + E KATODA Redoks E = E ANODA - E KATODA Oksidasi E = E KATODA - E ANODA Reduksi

ELEKTRODA § Elektroda Standar : ● Elektroda Hidrogen Standar ( SHE ) § Elektroda Pembanding : ● Elektroda Kalomel ● Elektroda Ag/Ag. Cl § Elektroda p. H : • Elektroda Hidrogen • Elektroda Gelas

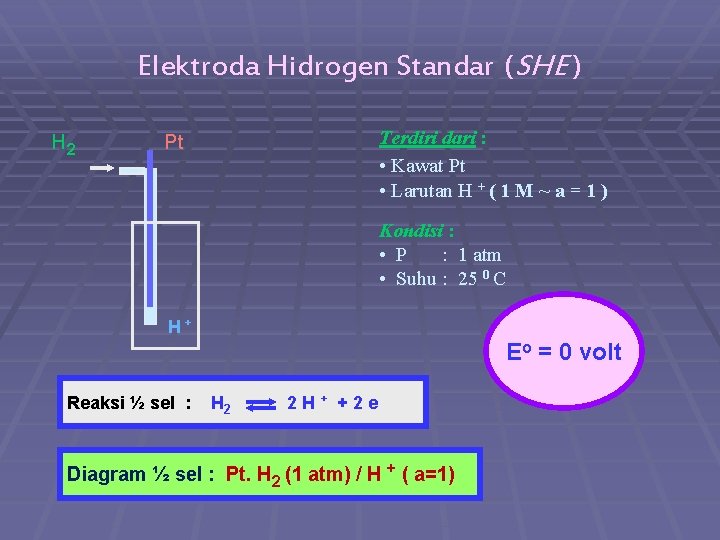
Elektroda Hidrogen Standar (SHE ) H 2 Terdiri dari : • Kawat Pt • Larutan H + ( 1 M ~ a = 1 ) Pt Kondisi : • P : 1 atm • Suhu : 25 0 C H+ Eo = 0 volt Reaksi ½ sel : H 2 2 H+ +2 e Diagram ½ sel : Pt. H 2 (1 atm) / H + ( a=1)

ELEKTRODA KALOMEL Reaksi : Hg 2 Cl 2(p) + 2 e 2 Hg (p) + 2 Cl. A. Kalomel 0, 1 N ( Kalomel desinormal ) Diagram : Hg/Hg 2 Cl 2(p), KCl (0, 1 N) Eo = 0, 3338 volt B. Kalomel 1 N ( Kalomel normal ) Diagram : Hg/Hg 2 Cl 2(p), KCl (1 N) Eo = 0, 2800 volt C. Kalomel JENUH ( saturated ) Diagram : Hg/Hg 2 Cl 2(p), KCl (Jenuh) Eo = 0, 2415 volt

HUKUM FARADAY • Jumlah zat yang dihasilkan pada reaksi elektroda adalah setara dengan jumlah listrik yang mengalir pada reaksi elektrolisis Dari percobaan : 1 Coulomb [ C ] ~ 0, 00111797 gram Ag BA Ag = 107, 870 gram 1 BE Ag membutuhkan = 107, 870/ 0, 00111797 C = 96. 487 C ~ 96. 500 C 1 F = 96. 500 C 1 e ~ 1, 602. 10 -19 C 1 F ~ 96. 500/1, 602. 10 -19 e ~ 6, 023. 10 23 e

COULOMETER § Alat / sel elektrolisis yang digunakan untuk mengukur jumlah listrik yang melewati suatu sirkuit / rangkaian dengan mengamati perubahan kimia yang terjadi § Rumus : Berat Zat = BA x i x t 96. 500 BA : berat atom zat i : arus listrik t : waktu Gram

Contoh Perhitungan potensial Elektroda 1. Sel Galvani dengan diagram sel : Cd/Cd 2+ ( a=1) // KCl (1 N), Hg 2 Cl 2(p)/Hg Eo sel = 0, 6830 volt ( 25 o. C, 1 atm ) Hitung Eo elektroda Cd, bila berfungsi sebagai kutub negatip. Jawab : Kutub neg ( anoda ~ oksidasi ) : Cd 2+ + 2 e Kutub pos ( katoda ~ reduksi ) : Hg 2 Cl 2(p) + 2 e 2 Hg (p) + 2 Cl Eo = + 0, 2800 volt Eo sel = Eo anoda + Eo katoda 0, 6830 = + 0, 2800 Eo Cd = 0, 4030 volt 2. Hg/ Hg 2 Cl 2(p), KCl (0, 1 N) / Cu 2+ ( a=1 ) / Cu Eo sel = 0, 0570 volt ( 25 o. C, 1 atm ) Elektroda kalomel kutub negatip Hitung Eo Cu

Contoh Perhitungan potensial sel 1. Cd/Cd 2+ ( a=1) // Cu 2+ ( a=1 ) / Cu ( 25 o. C, 1 atm ) Hitung Eo sel, bila sel berfungsi sebagai penghasil listrik Jawab : Asumsi : Kutub neg (anoda) adalah elektroda Cd Anoda : Cd 2+ + 2 e Eo Cd = 0, 4030 volt Katoda : Cu 2+ + 2 e Cu Eo Cu = 0, 3370 volt + Cd + Cu 2+ Cd 2+ + Cu Eo sel = 0, 7400 volt Eo sel > 0 Reaksi spontan Elektroda Cd anoda ( oksidasi ), kutub negatip Elektroda Cu katoda ( reduksi ), kutub posititip 2. Bagaimana bila elektroda Cu sebagai kutub negatip ?

Rumus a. A + b. B Nernst c. C + d. D ΔG = ΔG o + RT ln ac. C. ad. D a a A. ab B ΔG = – n F Eo + RT ln ac. C. ad. D a a A. ab B E = Eo – RT ln ac. C. ad. D n. F a a A. ab B E = Eo – 2, 3026 RT log ac. C. ad. D n. F a a A. ab B n = elektron yang terlibat dalam reaksi F = 96. 500 C R = konstanta gas Pada t = 25 o. C E = Eo – 0, 059 log ac. C. ad. D n aa A. ab B T = suhu

Contoh Berapa potensial elektroda Zn : Zn / Zn 2+ ( a = 0, 1 ) pada 25 o. C, 1 atm Oksidasi : Zn 2+ + 2 e E = Eo – 0, 059 log a Zn 2+ n a Zn = 0, 7618 – 0, 059 log 0, 1 2 1 = 0, 7914 volt Reduksi : Zn 2+ + 2 e Zn E = Eo – 0, 059 log a Zn 2+ n a Zn = – 0, 7618 – 0, 059 log 1 2 0, 1 = – 0, 7914 volt

Contoh Zn / Zn 2+ (0, 1) // Cl- (1 N), Hg 2 Cl 2/Hg Berapa E sel ? Jawab : Elektroda Zn : anoda ( oksidasi ) E Zn = 0, 7914 volt Elektroda kalomel normal : katoda ( reduksi ) E Kal = 0, 2800 volt E sel = E anoda + E katoda = 0, 7914 + 0, 2800 = 1, 0714 volt Berapa E sel bila pada elektroda kalomel a KCl = 0, 2 ?

EMF (E) dan Konstante kesetimbangan (K) a. A + b. B c. C + d. D K = a c. C. a d. D a a. A. a b. B Keadaan setimbang : ΔG = 0 ΔG = - n F E Pada 25 o. C : 0 = Eo – 0, 059 log ac. C. ad. D n a a A. ab B Eo = 0, 059 log K n E=0
 Rully
Rully Komite farmasi dan terapi
Komite farmasi dan terapi Struktur organisasi instalasi farmasi rumah sakit
Struktur organisasi instalasi farmasi rumah sakit Contoh sp psikotropika
Contoh sp psikotropika Definisi farmasi menurut undang-undang
Definisi farmasi menurut undang-undang Mata kuliah farmasi ugm
Mata kuliah farmasi ugm Kedudukan dan peran imunologi dalam ilmu kefarmasian
Kedudukan dan peran imunologi dalam ilmu kefarmasian Meso farmasi
Meso farmasi Perbedaan sediaan suspensi dan emulsi
Perbedaan sediaan suspensi dan emulsi Misce fac lege artis
Misce fac lege artis Desentralisasi farmasi adalah
Desentralisasi farmasi adalah Smk farmasi madiun
Smk farmasi madiun Pelayanan kefarmasian di rumah sakit
Pelayanan kefarmasian di rumah sakit Siklus logistik farmasi
Siklus logistik farmasi Validasi proses terhadap produk yang sudah berjalan adalah
Validasi proses terhadap produk yang sudah berjalan adalah Farmasi sosial
Farmasi sosial Meso farmasi
Meso farmasi Pengenalan kerjaya
Pengenalan kerjaya Edumanage usb login
Edumanage usb login Eso dalam farmasi
Eso dalam farmasi Pio pelayanan informasi obat
Pio pelayanan informasi obat Hubungan ilmu farmasi dengan ilmu fisika
Hubungan ilmu farmasi dengan ilmu fisika Bioteknologi farmasi
Bioteknologi farmasi Etiket obat
Etiket obat Materi farmasi rumah sakit
Materi farmasi rumah sakit Pft farmasi
Pft farmasi Master i farmasi
Master i farmasi














































