Reazioni dei Metalli e dei Non Metalli Per















- Slides: 16

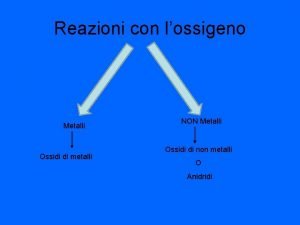
Reazioni dei Metalli e dei Non Metalli

Per differenziare il comportamento chimico dei Metalli dai Non Metalli … • È necessario fare loro le stesse reazioni, ad es. prima con ossigeno e poi con acqua • Osservare i reagenti, le reazioni e i prodotti • Valutare le differenze di comportamento • Un lavoro siffatto porta ad una prima classificazione delle sostanze chimiche Copy. Left M. Fruttero 2002

I Metalli • Sono lucenti, malleabili, duttili, buoni conduttori di corrente e di calore • Sono sistemati a sinistra e al centro della tavola periodica • Sono tutti solidi eccetto il mercurio • Nel nostro esperimento studieremo le reazioni del magnesio (Mg) • Quanto osserveremo per il magnesio si può estendere a tutti i metalli Copy. Left M. Fruttero 2002

Magnesio + Ossigeno 2 Mg + O 2 2 Mg. O Mg Mg + O O Mg O • Due atomi di magnesio reagiscono con una molecola biatomica di ossigeno per dare due molecole di ossido di magnesio Copy. Left M. Fruttero 2002

2 Mg + O 2 2 Mg. O Metallo + Ossigeno Ossido Basico • L’ossido basico è un composto binario, cioè formato da due tipi di atomo legati • La formula dell’ossido basico si ottiene scrivendo prima il simbolo del metallo poi quello dell’ossigeno Copy. Left M. Fruttero 2002

Ossido di Magnesio + Acqua Mg. O + Mg O + H 2 O H O H Mg(OH)2 Mg O H • Una molecola di ossido di magnesio reagisce con una molecola d’acqua per formare una molecola di idrossido di magnesio Copy. Left M. Fruttero 2002

Mg. O + H 2 O Mg(OH)2 Ossido Basico + Acqua Idrossido • L’idrossido è un composto ternario, cioè formato da tre tipi di atomo legati • È caratterizzato dalla presenza del gruppo OH (ossidrile), che è monovalente, legato al metallo Copy. Left M. Fruttero 2002

Mg. O + H 2 O Mg(OH)2 • La formula si ottiene scrivendo prima il simbolo del metallo poi quello del gruppo OH tante volte quanto è la valenza del metallo • Il gruppo OH liberato in soluzione dalla sostanza è il responsabile del suo carattere basico Copy. Left M. Fruttero 2002

I Non Metalli • Non sono lucenti, né malleabili e non conducono bene corrente e calore • Sono sistemati a destra della tavola periodica • Sono solidi (es. iodio), liquidi (es. bromo) e gassosi (es. cloro) • Nel nostro esperimento studieremo le reazioni dello zolfo (S) • Quanto osserveremo per lo zolfo si può estendere a tutti i non metalli Copy. Left M. Fruttero 2002

Zolfo + Ossigeno S + O 2 S + O O SO 2 O S O • Un atomo di zolfo reagisce con una molecola biatomica di ossigeno per formare una molecola di ossido di zolfo o anidride solforosa Copy. Left M. Fruttero 2002

S + O 2 SO 2 Non Metallo + Ossigeno Ossido Acido • L’ossido acido è un composto binario, cioè formato da due tipi di atomo legati • La formula dell’ossido acido si ottiene scrivendo prima il simbolo del non metallo poi quello dell’ossigeno Copy. Left M. Fruttero 2002

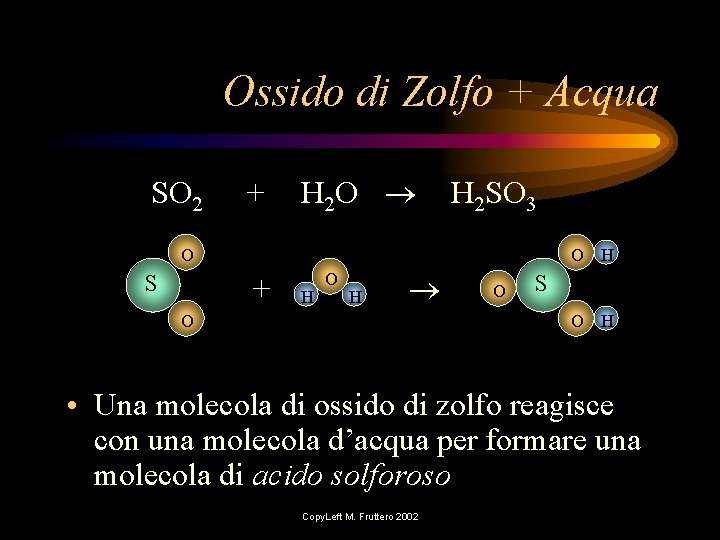
Ossido di Zolfo + Acqua SO 2 + H 2 O H 2 SO 3 O S O H + H O O S O H • Una molecola di ossido di zolfo reagisce con una molecola d’acqua per formare una molecola di acido solforoso Copy. Left M. Fruttero 2002

SO 2 + H 2 O H 2 SO 3 Ossido Acido + Acqua Ossiacido • L’ossiacido è un composto ternario, cioè formato da tre tipi di atomo legati • Contiene sempre uno o più ossigeni Copy. Left M. Fruttero 2002

SO 2 + H 2 O H 2 SO 3 • È caratterizzato dalla presenza di atomi di H che, liberati in soluzione dalla sostanza, sono responsabili del carattere acido • La formula si ottiene scrivendo prima il simbolo dell’idrogeno, poi quello del non metallo e infine quello dell’ossigeno Copy. Left M. Fruttero 2002

Ricapitolando… Metallo + Ossigeno Ossido Basico + Acqua Idrossido Non Metallo + Ossigeno Ossido Acido + Acqua Ossiacido Copy. Left M. Fruttero 2002

Fine Copy. Left M. Fruttero 2002
 Proprietà periodiche zanichelli
Proprietà periodiche zanichelli Metalli non metalli e semimetalli
Metalli non metalli e semimetalli Rappresentazione di lewis
Rappresentazione di lewis La moderna tavola periodica zanichelli
La moderna tavola periodica zanichelli Ossidi dei non metalli
Ossidi dei non metalli Nacl nomenclatura
Nacl nomenclatura Classificazione dei metalli
Classificazione dei metalli Incrudimento metalli
Incrudimento metalli Scale termometriche
Scale termometriche Età dei metalli
Età dei metalli Attacco dei metalli
Attacco dei metalli Fbpasi
Fbpasi Ossidazione e riduzione
Ossidazione e riduzione Bilanciamento reazioni redox
Bilanciamento reazioni redox Reazioni reversibili e irreversibili
Reazioni reversibili e irreversibili Reazioni di precipitazione
Reazioni di precipitazione Ossidazione perde elettroni
Ossidazione perde elettroni