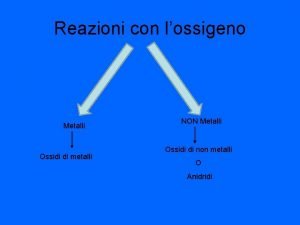
Attacco dei metalli La reazione di attacco dei













- Slides: 16

Attacco dei metalli La reazione di attacco dei metalli è: M Mz+ + ze- Qualunque ossidante con potenziale standard di riduzione maggiore del potenziale standard di riduzione del metallo è quindi capace di ossidare il metallo M + z. H+ z/2 H 2 +Mz+ Dato che E 0 H+/H 2 = 0, solo i metalli con potenziale standard di riduzione minore di zero sono attaccati dallo ione idrogeno


Attacco dei metalli Tutti le specie che hanno un potenziale di riduzione minore di zero vengono ossidate da ioni H+ Tutte le specie che hanno un potenziali di riduzione maggiore di zero NON vengono ossidate da H+ E = 0 – 0. 059 log 10 -7 = -0. 41 V Alla neutralità solo metalli con potenziale standard minore di -0. 41 V sono attaccati dall’H+ dell’acqua.

Attacco dei metalli I metalli con potenziale standard di riduzione maggiore di zero non sono attaccati dallo ione idrogeno ma solo da agenti ossidanti come acido nitrico e acido perclorico, acido solforico es: 3 Cu + 2 NO 3 - + 8 H+ 3 Ag + 2 NO 3 - + 4 H+ 3 Cu 2+ + 2 NO + 4 H 2 O 3 Ag+ + NO + 2 H 2 O Sono detti Metalli nobili = Au, Ag, Cu, Pt, Pd, Hg

Attacco dei metalli Si definiscono metalli nobili quelli che hanno un potenziali di riduzione >0 Essi non sono attaccati dagli acidi a meno che non si tratti di un ACIDO OSSIDANTE Au e Pt si attaccano solo mediante una azione combinata di un ossidante e di un complessante

Attacco dei metalli Pt + Br 2 Pt 2+ + 2 Br- E 0 (Br 2/Br-) = 1. 09 V E 0 (Pt/Pt 2+) = 1. 12 V Keq = 9. 8 x 10 -2 Aggiungo il complessante Br- (1 M) che reagisce con Pt 2+ + 4 Br- Pt. Br 42 - Kst = 1 x 1020

Attacco dei metalli Acqua regia: HCl e HNO 3 in rapporto 3: 1 Au + NO 3 - + 4 Cl- + 4 H+ Au. Cl 4 - + NO + 2 H 2 O I metalli sono ossidati anche dai cationi dei metalli che hanno un potenziale standard di riduzione maggiore, Es. pila Daniel, Cu + Ag+ Cu 2+ + 2 Ag

Corrosione dei metalli La corrosione dei metalli avviene per ossidazione superficiale da parte di agenti atmosferici, che sono in genere l’ossigeno (E 0 (O 2/H 2 O) = 1, 23 V) e lo ione H+ derivante da acidi (come la CO 2) La reazione di ossidazione è termodinamicamante favorita, quindi quasi tutti i metalli all’aria si dovrebbero ossidare ma in realtà questo non avviene in genere perche’ la reazione è molto lenta. Inoltre in certi casi i metalli si ricoprono di un strato di ossido che è impermeabile ad una ulteriore ossidazione da parte dell’O 2 e quindi si autoproteggono (passivazione)

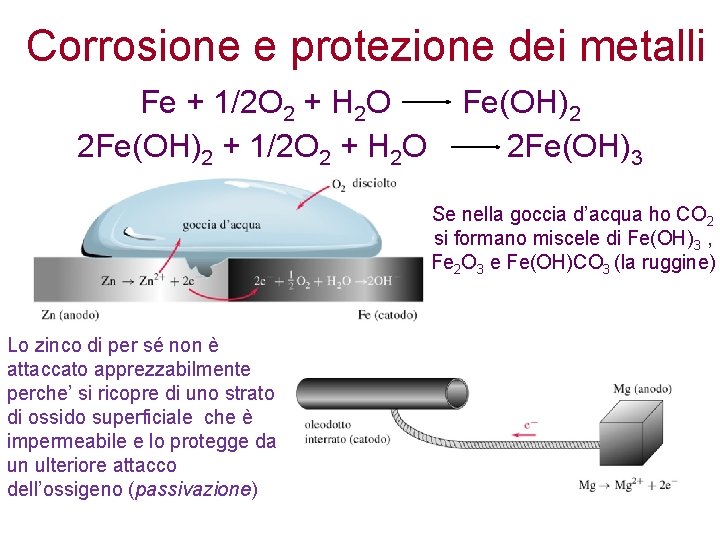
Corrosione e protezione dei metalli Fe + 1/2 O 2 + H 2 O 2 Fe(OH)2 + 1/2 O 2 + H 2 O Fe(OH)2 2 Fe(OH)3 Se nella goccia d’acqua ho CO 2 si formano miscele di Fe(OH)3 , Fe 2 O 3 e Fe(OH)CO 3 (la ruggine) Lo zinco di per sé non è attaccato apprezzabilmente perche’ si ricopre di uno strato di ossido superficiale che è impermeabile e lo protegge da un ulteriore attacco dell’ossigeno (passivazione)

Elettrodi standard alternativi ü Elettrodo a calomelano ü Elettrodo argento-argento cloruro

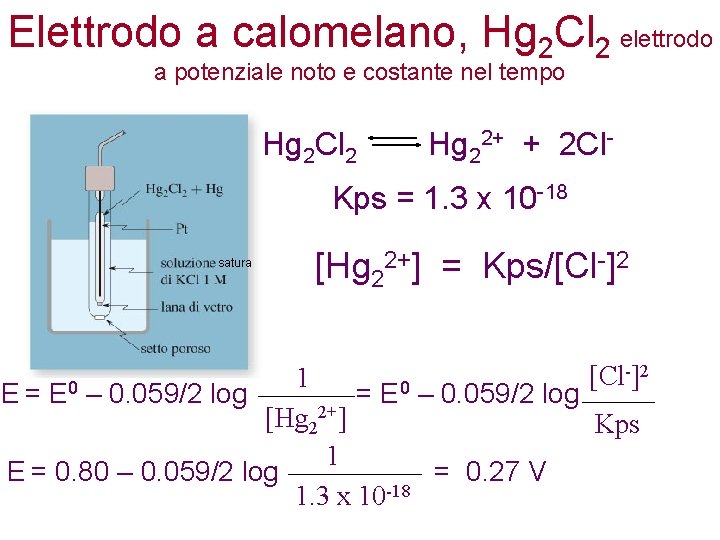
Elettrodo a calomelano, Hg 2 Cl 2 elettrodo a potenziale noto e costante nel tempo Hg 2 Cl 2 Hg 22+ + 2 Cl- Kps = 1. 3 x 10 -18 satura [Hg 22+] = Kps/[Cl-]2 -] 2 [Cl 1 E = E 0 – 0. 059/2 log [Hg 22+] Kps 1 E = 0. 80 – 0. 059/2 log = 0. 27 V 1. 3 x 10 -18

Elettrodo a calomelano, Hg 2 Cl 2 Questo elettrodo è usato al posto di quello a idrogeno per misure di potenziale. I potenziali di riduzione misurati con l’elettrodo standard a calomelano possono essere riportati a quelli relativi all’elettrodo standard a idrogeno aggiungendo il potenziale dell’elettrodo a calomelano, cioè 0. 27 V, al valore di potenziale misurato. E 0 (Hg 2 Cl 2/Hg) = 0. 27 V E 0 (H+/H 2) = 0 V E 0 = 0. 3 V rispetto a elettrodo a calomelano

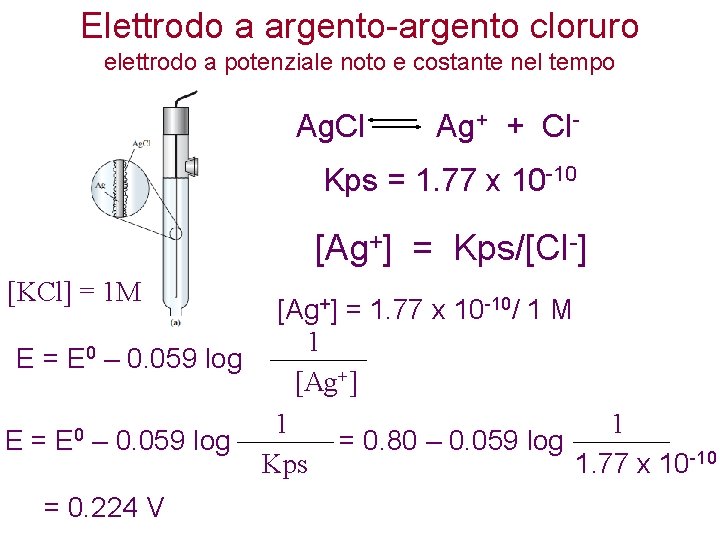
Elettrodo a argento-argento cloruro elettrodo a potenziale noto e costante nel tempo Ag. Cl Ag+ + Cl- Kps = 1. 77 x 10 -10 [Ag+] = Kps/[Cl-] [KCl] = 1 M [Ag+] = 1. 77 x 10 -10/ 1 M 1 0 E = E – 0. 059 log [Ag+] 1 1 0 E = E – 0. 059 log = 0. 80 – 0. 059 log Kps 1. 77 x 10 -10 = 0. 224 V

Esempi I 2 + 2 e. H 3 As. O 4 + 2 H+ + 2 e- 2 I- E 0 = 0. 54 V H 3 As. O 3 + H 2 O E 0 = 0. 56 V In ambiente molto acido [H+] > 1 M l’arsenico (V) ossida lo ioduro completamente mentre in ambiente neutro è lo iodio che ossida completamente l’arsenico(III) H 3 As. O 4 + 2 I- + 2 H+ H 3 As. O 3 + I 2 + H 2 O

Esempi: allontanamento di un prodotto dall’ambiente di reazione Mn. O 2 + 2 Cl- + 4 H+ Cl 2 + Mn 2+ + 2 H 2 O E 0 (Cl 2/Cl-) = 1. 36 V E 0 (Mn. O 2/Mn 2+) = 1. 22 V Potenziali vicini ma sfavorevoli rispetto alla reazione scritta ma riscaldando… Cr 2 O 72 - + 6 Cl- + 14 H+ 2 Cr 3+ + 3 Cl 2 + 7 H 2 O

Misure di potenziale permettono di ottenere i valori di Kps e Kinst Esempi…
 Attacco dei metalli
Attacco dei metalli Metalli e non metalli zanichelli
Metalli e non metalli zanichelli Tavola periodica metalli e non metalli zanichelli
Tavola periodica metalli e non metalli zanichelli Metalli non metalli e semimetalli
Metalli non metalli e semimetalli Raggio atomico
Raggio atomico Nacl nomenclatura
Nacl nomenclatura Incrudimento metalli
Incrudimento metalli Classificazione dei metalli
Classificazione dei metalli Dilatazione dei metalli
Dilatazione dei metalli Ossidi dei non metalli
Ossidi dei non metalli Età dei metalli
Età dei metalli Attacco acuto glaucoma
Attacco acuto glaucoma Paradigma psicometrico
Paradigma psicometrico Libraesva email archiver
Libraesva email archiver Triple post offense
Triple post offense Metalli alcalini tavola periodica
Metalli alcalini tavola periodica Prove meccaniche sui metalli
Prove meccaniche sui metalli