Propsito Introduccin Clculos de concentracin de disoluciones por













- Slides: 19

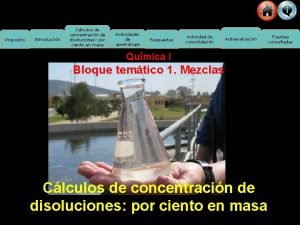
Propósito Introducción Cálculos de concentración de disoluciones: por ciento en volumen Actividades de aprendizaje Respuestas Actividad de consolidación Autoevaluación Química I Bloque temático 1. Mezclas Cálculos de concentración de disoluciones: por ciento en volumen Fuentes consultadas

Propósito Introducción ¿Qué vas a lograr? ¿Qué vas a aprender? ¿Cómo lo vas a lograr? ¿Para qué te va a servir? Cálculos de concentración de disoluciones: por ciento en volumen Actividades de aprendizaje Respuestas Actividad de consolidación Autoevaluación Fuentes consultadas Tendrás la capacidad de emitir opiniones personales o comunes de la naturaleza de las disoluciones, que involucran las de tipo gaseoso y acuoso por ser el aire y el agua los fluidos más abundantes en el planeta y porque debido a sus propiedades forma parte de la mayoría de las mezclas del entorno cotidiano. Aplicarás los conceptos de Concentración, Disolución, Soluto, Solvente y unidades de volumen en la solución de problemas en los que se involucra el Porcentaje en volumen. Plantearás las metodologías que te lleven a la solución de problemas. Para comprender entender y emitir juicios sobre situaciones del acontecer diario y relacionar las percepciones sobre ciencia, tecnología, sociedad y ambiente.

Propósito Introducción Cálculos de concentración de disoluciones: por ciento en volumen Actividades de aprendizaje Respuestas Actividad de consolidación Autoevaluación Fuentes consultadas Ø¿Sabes cómo se componen la mayor parte de las sustancias que nos rodean? Ø¿Conoces la composición del oxígeno en el agua y en el aire? Ø¿Te gustaría poder entender y aplicar los conceptos de porcentaje, composición y volumen en contextos cotidianos, tales como contaminación, alimentos, procesos, etc? Prácticamente todo lo que nos rodea son mezclas; están formadas por varias sustancias, es decir tienen cierta composición; por ejemplo en el agua potable puede haber 200 mg por litro de sodio o 0. 05 mg por litro de arsénico, en el aire 11 ppm de monóxido de carbono, en el vidrio debe haber más del 50% de óxido de silicio, en la sangre el nivel normal de hemoglobina es de 12 a 18 gramos por decilitro, en una gelatina más del 80% es proteína. Para ello tendrás que tener nociones de los temas que se te presentan como disolución, volumen, composición. Una vez que adquieras éstos conocimientos podrás comprender y opinar sobre temas de suma importancia que nos atañen a todos a nivel comunidad y mundial de tipo científico, social y ambiental.

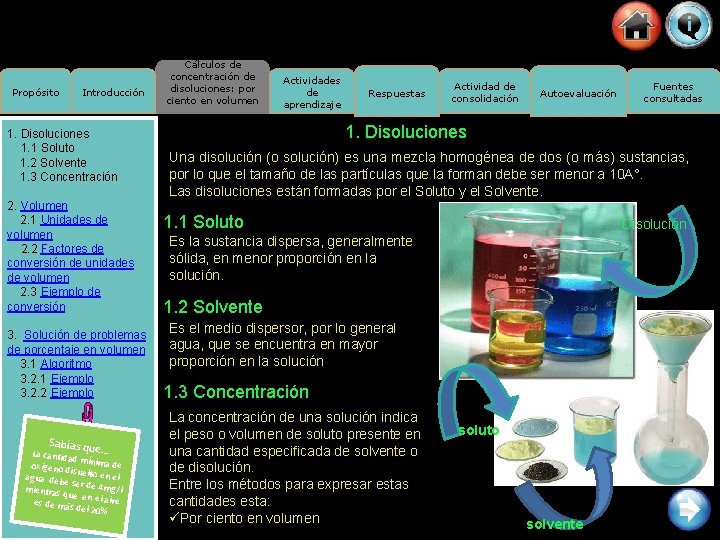
Propósito Introducción 1. Disoluciones 1. 1 Soluto 1. 2 Solvente 1. 3 Concentración 2. Volumen 2. 1 Unidades de volumen 2. 2 Factores de conversión de unidades de volumen 2. 3 Ejemplo de conversión 3. Solución de problemas de porcentaje en volumen 3. 1 Algoritmo 3. 2. 1 Ejemplo 3. 2. 2 Ejemplo Sabías qu e… La ca ntidad mín ima de oxígeno d isuelto en el agua deb e ser de 4 m g mientras /l que e es de más n el aire del 20% Cálculos de concentración de disoluciones: por ciento en volumen Actividades de aprendizaje Respuestas Actividad de consolidación Autoevaluación Fuentes consultadas 1. Disoluciones Una disolución (o solución) es una mezcla homogénea de dos (o más) sustancias, por lo que el tamaño de las partículas que la forman debe ser menor a 10 A°. Las disoluciones están formadas por el Soluto y el Solvente. 1. 1 Soluto Disolución Es la sustancia dispersa, generalmente sólida, en menor proporción en la solución. 1. 2 Solvente Es el medio dispersor, por lo general agua, que se encuentra en mayor proporción en la solución 1. 3 Concentración La concentración de una solución indica el peso o volumen de soluto presente en una cantidad especificada de solvente o de disolución. Entre los métodos para expresar estas cantidades esta: üPor ciento en volumen soluto solvente

Propósito Introducción Cálculos de concentración de disoluciones: por ciento en volumen Actividades de aprendizaje Respuestas Actividad de consolidación Autoevaluación Fuentes consultadas 2. Volumen 1. Disoluciones 1. 1 Soluto 1. 2 Solvente 1. 3 Concentración 2. Volumen 2. 1 Unidades de volumen 2. 2 Factores de conversión de unidades de volumen 2. 3 Ejemplo de conversión 3. Solución de problemas de porcentaje en volumen 3. 1 Algoritmo 3. 2. 1 Ejemplo 3. 2. 2 Ejemplo Es la medida en tres dimensiones del espacio que ocupa un cuerpo. 2. 1 Unidades de volumen ØEn el Sistema Internacional de medidas se emplea el metro cúbico, m 3. Además se emplea el litro y sus derivaciones. ØEn el sistema inglés el pie cúbico, ft 3 y el galón con sus derivaciones PROBETA MATRAZ BURETA MATRAZ ERLENMEYER VASO DE PRECIPITADOS PIPETA Sabía s que… Para med ir volume n emplea materiale mos s como p ro pipetas o vasos de p betas, recipitado s.

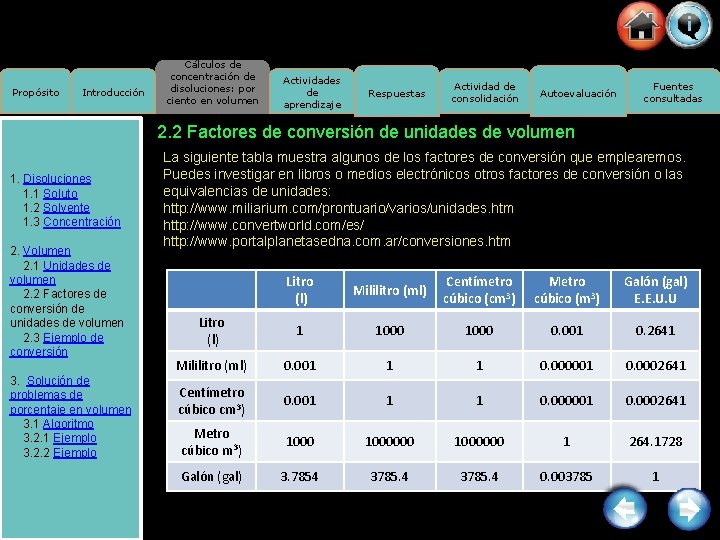
Propósito Introducción Cálculos de concentración de disoluciones: por ciento en volumen Actividades de aprendizaje Respuestas Actividad de consolidación Autoevaluación Fuentes consultadas 2. 2 Factores de conversión de unidades de volumen 1. Disoluciones 1. 1 Soluto 1. 2 Solvente 1. 3 Concentración 2. Volumen 2. 1 Unidades de volumen 2. 2 Factores de conversión de unidades de volumen 2. 3 Ejemplo de conversión 3. Solución de problemas de porcentaje en volumen 3. 1 Algoritmo 3. 2. 1 Ejemplo 3. 2. 2 Ejemplo La siguiente tabla muestra algunos de los factores de conversión que emplearemos. Puedes investigar en libros o medios electrónicos otros factores de conversión o las equivalencias de unidades: http: //www. miliarium. com/prontuario/varios/unidades. htm http: //www. convertworld. com/es/ http: //www. portalplanetasedna. com. ar/conversiones. htm Litro (l) Mililitro (ml) Centímetro cúbico (cm 3) Metro cúbico (m 3) Galón (gal) E. E. U. U Litro (l) 1 1000 0. 001 0. 2641 Mililitro (ml) 0. 001 1 1 0. 000001 0. 0002641 Centímetro cúbico cm 3) 0. 001 1 1 0. 000001 0. 0002641 Metro cúbico m 3) 1000000 1 264. 1728 Galón (gal) 3. 7854 3785. 4 0. 003785 1

Propósito Introducción Cálculos de concentración de disoluciones: por ciento en volumen Actividades de aprendizaje Respuestas Actividad de consolidación Autoevaluación 2. 3 Ejemplo de conversión 1. Disoluciones 1. 1 Soluto 1. 2 Solvente 1. 3 Concentración 2. Volumen 2. 1 Unidades de volumen 2. 2 Factores de conversión de unidades de volumen 2. 3 Ejemplo de conversión 3. Solución de problemas de porcentaje en volumen 3. 1 Algoritmo 3. 2. 1 Ejemplo 3. 2. 2 Ejemplo Si se tuviese 1. 2 gal de ácido clorhídrico en el laboratorio y se deseara trasvasarlo a otros recipientes. ¿Cuántos recipientes de 1 l se emplearían? ¿Cuántos mililitros quedarían sin trasvasar? üMultiplicamos la cantidad de galones que se tienen por el factor de conversión a litros (1. 2) (3. 7854) = 4. 5424 l Se emplearían 4 recipientes de 1 l y quedarían 0. 5424 l üMultiplicamos la cantidad de litros quedan por el factor de conversión a mililitros (0. 5424) (1000) = 542. 4 ml Quedarían sin trasvasar 542. 4 ml Sabía Fuentes consultadas s que… El ácido c lorhídrico con es uno de los más fu centrado ertes, su p es de 1. E H ste ácido s e en en el estó mago y es cuentra capaz de desintegra r to d o lo ingerimos como carn que e, hu plástico y los alimen eso, tos.

Propósito Introducción Cálculos de concentración de disoluciones: por ciento en volumen Actividades de aprendizaje Respuestas Actividad de consolidación Autoevaluación Fuentes consultadas 3. Solución de problemas de porcentaje en volumen 1. Disoluciones 1. 1 Soluto 1. 2 Solvente 1. 3 Concentración 2. Volumen 2. 1 Unidades de volumen 2. 2 Factores de conversión de unidades de volumen 2. 3 Ejemplo de conversión 3. Solución de problemas de porcentaje en volumen 3. 1 Algoritmo 3. 2. 1 Ejemplo 3. 2. 2 Ejemplo La fórmula que utilizaremos para la solución de problemas es: % en volumen= mililitros de soluto mililitros de solución (100) Considera que: mililitros de solución = mililitros de soluto + mililitros de solvente Muchas veces se necesita calcular la cantidad de soluto, por lo que se debe realizar el despeje de la fórmula, el cual queda: mililitros de soluto = (% en volumen) (mililitros de solución) 100 Recuerda que puedes consultar libros y medios electrónicos http: //www. pvivov. net/eso/temas/disoluciones/ejerciciosdisoluciones. pdf como:

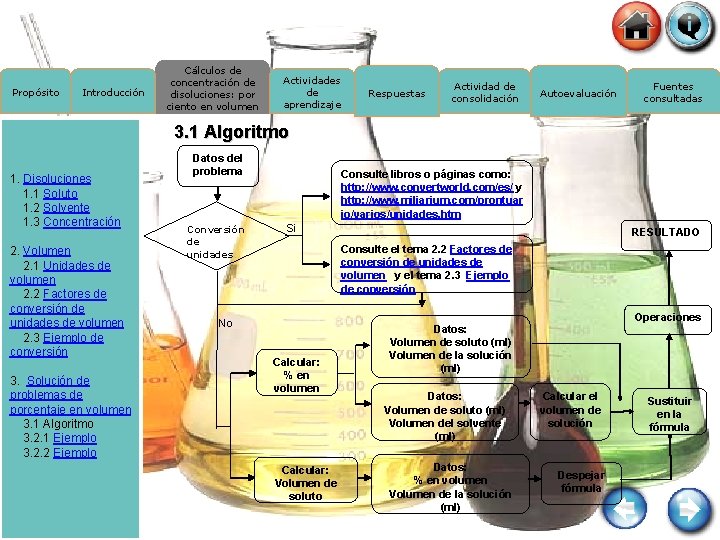
Propósito Introducción Cálculos de concentración de disoluciones: por ciento en volumen Actividades de aprendizaje Respuestas Actividad de consolidación Autoevaluación Fuentes consultadas 3. 1 Algoritmo 1. Disoluciones 1. 1 Soluto 1. 2 Solvente 1. 3 Concentración 2. Volumen 2. 1 Unidades de volumen 2. 2 Factores de conversión de unidades de volumen 2. 3 Ejemplo de conversión 3. Solución de problemas de porcentaje en volumen 3. 1 Algoritmo 3. 2. 1 Ejemplo 3. 2. 2 Ejemplo Datos del problema Conversión de unidades Consulte libros o páginas como: http: //www. convertworld. com/es/ y http: //www. miliarium. com/prontuar io/varios/unidades. htm Si RESULTADO Consulte el tema 2. 2 Factores de conversión de unidades de volumen y el tema 2. 3 Ejemplo de conversión No Calcular: % en volumen Calcular: Volumen de soluto Operaciones Datos: Volumen de soluto (ml) Volumen de la solución (ml) Datos: Volumen de soluto (ml) Volumen del solvente (ml) Datos: % en volumen Volumen de la solución (ml) Calcular el volumen de solución Despejar fórmula Sustituir en la fórmula

Propósito Introducción Cálculos de concentración de disoluciones: por ciento en volumen Actividades de aprendizaje Respuestas Actividad de consolidación Sabías q 3. 2. 1 Ejemplos 1. Disoluciones 1. 1 Soluto 1. 2 Solvente 1. 3 Concentración 2. Volumen 2. 1 Unidades de volumen 2. 2 Factores de conversión de unidades de volumen 2. 3 Ejemplo de conversión 3. Solución de problemas de porcentaje en volumen 3. 1 Algoritmo 3. 2. 1 Ejemplo 3. 2. 2 Ejemplo Fuentes consultadas Autoevaluación Calcula el porcentaje en volumen de una solución formada por 15 ml de ácido sulfúrico en 1. 3 l de agua 1. Datos Volumen de soluto= 15 ml Volumen de solvente= 1. 3 l ue… La reacció n entre el ácido sulfúrico y el agua es muy exotérmic a, es energía. P decir libera or eso en el laboratori o se tiene sumo cuidado a disolucion l preparar estas es, agrega nd al agua m uy lentam o el ácido e nte, nunc se agrega a el agua al ácido. 4. Sustituir en la fórmula 2. Conversión de unidades de volumen Multiplicar la cantidad en litros por el factor correspondiente (1. 3 l) (1000) Volumen de solvente= 1300 ml 3. Calcular el volumen de la disolución ml de = + disolución soluto solvente ml de = 15 ml + disolución % en volumen = mililitros de soluto mililitros de solución % en volumen = 15 ml 1315 ml 5. Operaciones % en volumen= (0. 01140) (100) 6. Resultado 1300 ml volumen de disolución = 1315 ml (100) % en volumen= 1. 14% (100)

Propósito Introducción 1. Disoluciones 1. 1 Soluto 1. 2 Solvente 1. 3 Concentración 2. Volumen 2. 1 Unidades de volumen 2. 2 Factores de conversión de unidades de volumen 2. 3 Ejemplo de conversión Cálculos de concentración de disoluciones: por ciento en volumen Actividades de aprendizaje Respuestas Actividad de consolidación Fuentes consultadas Autoevaluación 3. 2. 2 Ejemplos El nitrógeno presente en el aire, tiene un porcentaje en volumen de 78%, ¿cuántos litros de nitrógeno habría en 1 m 3? 1. Datos: % en volumen= 78% Volumen de solvente= 1 m 3 2. Conversión de unidades Factor de conversión: 1000 l entonces 1 m 3= 1000 l Volumen de solución= 1000 l 3. Solución de 3. Despejar fórmula problemas de porcentaje en volumen 3. 1 Algoritmo volumen de (%volumen) (volumen de solución) 3. 2. 1 Ejemplo soluto = 3. 2. 2 Ejemplo 100 4. Sustituir en la fórmula volumen de soluto= (78%) (1000 l) 100 5. Operaciones volumen de soluto= 78000 l 100 6. Resultado volumen de soluto= 780 l de Nitrógeno

Propósito Introducción Cálculos de concentración de disoluciones: por ciento en volumen Actividades de aprendizaje Respuestas Actividad de consolidación Autoevaluación Fuentes consultadas Actividad de Aprendizaje 1 Escribe en el paréntesis la letra que corresponda. ( ) Sustancia que se disuelve, se encuentra en menor proporción en la solución A) Equivalencia de 1 m 3 a litros ( ) Indica el peso o volumen de soluto presente en la solución B) (Di)solución ( ) Se calcula dividiendo los volúmenes de soluto y solución por cien C) Factor de conversión de cm 3 a ml ( D) Soluto ) 1000 ( ) Pipeta, bureta, probeta, matraz, vaso de precipitados E) Unidades de volumen ( ) Datos que se requieren para calcular el volumen de solución F) Volumen de soluto y volumen de solvente ( G) % en volumen )1 ( ) Es el medio dispersor, se encuentra en mayor proporción en la solución H) Instrumentos de medición de volumen ( ) Mezcla homogénea de dos o más sustancias I) Concentración ( ) m 3, ft 3, gal, ml, l J) Solvente

Propósito Introducción Cálculos de concentración de disoluciones: por ciento en volumen Actividades de aprendizaje Respuestas Actividad de consolidación Autoevaluación Actividad de Aprendizaje 2 Resuelve los siguientes problemas. 1. Determina la composición en volumen de la fragancia, del agua y del alcohol, de una solución preparada con 120 ml de agua, 10 ml de fragancia y 20 ml de alcohol. 2. ¿Cuántos mililitros de ácido acético emplearías para preparar 1 l de una disolución al 15% en volumen? 3. El porcentaje en volumen del oxígeno en el aire es de 20. 9% en volumen. ¿Qué cantidad de oxígeno en mililitros se tendría en 1 l de aire? 4. Determina el % de sulfatos en una muestra de 50 ml de agua, si en un análisis se determino que la muestra contenía 0. 03 ml de sulfatos. El límite máximo permisible en agua potable según normas oficiales, es de 0. 0004% en volumen. ¿La muestra es potable? 5. Calcula la concentración de una disolución preparada con 30 ml de amoníaco y 300 ml de agua. Fuentes consultadas

Propósito Introducción Cálculos de concentración de disoluciones: por ciento en volumen Actividades de aprendizaje Respuestas Actividad de consolidación Autoevaluación Fuentes consultadas Respuestas a la Actividad de Aprendizaje 1 A continuación se presentan las respuestas correctas para que verifiques tu aprendizaje D I G A H F C J B E

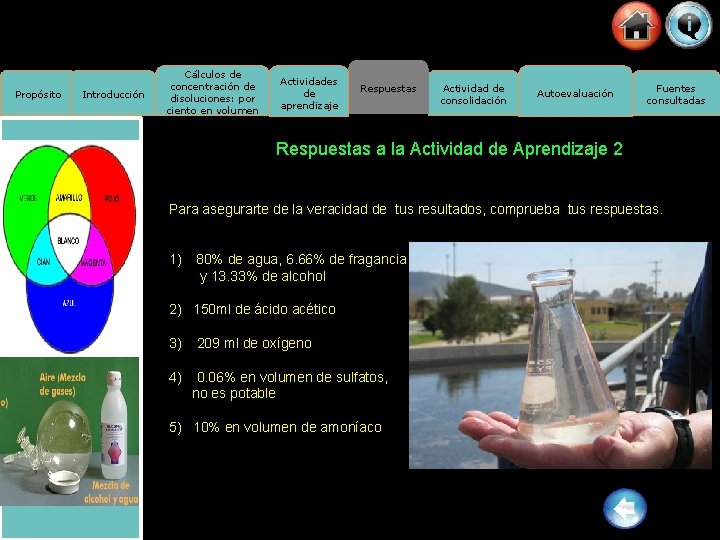
Propósito Introducción Cálculos de concentración de disoluciones: por ciento en volumen Actividades de aprendizaje Respuestas Actividad de consolidación Autoevaluación Fuentes consultadas Respuestas a la Actividad de Aprendizaje 2 Para asegurarte de la veracidad de tus resultados, comprueba tus respuestas. 1) 80% de agua, 6. 66% de fragancia y 13. 33% de alcohol 2) 150 ml de ácido acético 3) 4) 209 ml de oxígeno 0. 06% en volumen de sulfatos, no es potable 5) 10% en volumen de amoníaco

Propósito Introducción Cálculos de concentración de disoluciones: por ciento en volumen Actividades de aprendizaje Respuestas Actividad de consolidación Autoevaluación Fuentes consultadas Realiza tu autoevaluación Las repuestas a las que debiste haber llegado son las siguientes: 1. 2. 3. 4. 5. 0. 032% en volumen No rebasa los 100 puntos IMECA 3. Dióxido de carbono 0. 0013 ml como máximo La composición máxima de dióxido de azufre, 0. 00000013, por los mililitros de solución, 1000, 000 ml 6. Agua 7. El ozono no rebasa los 100 puntos IMECA 8. 0. 00000020% en volumen 9. Mililitros de soluto, 0. 0021 ml de bióxido de nitrógeno, entre mililitros de solución, 1000, 000 ml 10. La muestra de agua con todos lo solutos presentes

Propósito Introducción Cálculos de concentración de disoluciones: por ciento en volumen Actividades de aprendizaje Respuestas Actividad de consolidación Autoevaluación Fuentes consultadas Lista de cotejo Llena la lista de cotejo y al terminar identifica tus deficiencias y corrígelas. SI 1. Tengo errores al realizar el cálculo 2. Puedo comparar el resultado para responder el cuestionamiento 3. Aprendí a diferenciar el soluto en una disolución 4. Logro aplicar el resultado para compararlo con la información que me dan 5. Identifico las operaciones matemáticas que debo realizar 6. Reconozco el solvente en una disolución 7. Aplico el resultado en una problemática real 8. Realizo el cálculo de concentración sin dificultad 9. Realizo las operaciones matemáticas correctamente 10. Distingo los componentes de una disolución NO

Propósito Introducción Cálculos de concentración de disoluciones: por ciento en volumen Actividades de aprendizaje Respuestas Actividad de consolidación Autoevaluación Fuentes consultadas o. CHANG, RAYMOND. (2011). Fundamentos de Química. Mc. Graw-Hill/Interamericana Editores, S. A. de C. V. México. o. CHOPIN, GREGORY. (1985). Química. Publicaciones cultural, S. A. de C. V. México. o. GARRITZ, RUIZ ANDONI. (2001). Tú y la Química. Pearson Educación de México, S. A. de C. V. México. o. KEENAN, CHARLES. (1976). Química general universitaria. Compañía editorial continental, S. A. México. o. PEÑA, ROJAS ESTELA. (2007). Química I. Pearson Educación de México, S. A. de C. V. México. o. COLEGIO DE BACHILLERES. Programas de estudio. Química I, Recursos naturales. Cuarto Semestre. México, 2011. ohttp: //3. bp. blogspot. com/_Hv. A 3 QIt 2 Le. U/S 1 WI 1 C-_8 UI/AAAAA 8/j 8 h. Div 4 SH 4 s/s 400/ruben ohttp: //3. bp. blogspot. com/_zj. JBboz 0 VSQ/S 5 ur. Ij. BP 73 I/AAAAAM/h. Wo. Lo 4 ak 5 E 8/s 320/mezclas+homogenia s. gif

I. Q. Maricela Aguilar Saldo Autor (a) D. R. ©Colegio de Bachilleres, 2011 Departamento de Diseño de Materiales Educativos
 Clculos
Clculos Clculos
Clculos Introduccin
Introduccin Introduccin
Introduccin Introduccin
Introduccin Induccin
Induccin Las 4 etapas de la filosofía
Las 4 etapas de la filosofía Introducción de enzimas
Introducción de enzimas Propsito
Propsito Una vida con proposito dia 14
Una vida con proposito dia 14 Propsito
Propsito Propsito
Propsito Reconoce tus debilidades físicas y espirituales
Reconoce tus debilidades físicas y espirituales Propsito
Propsito Propsito
Propsito Propsito
Propsito Disoluciones ejemplos
Disoluciones ejemplos Porcentaje masa volumen
Porcentaje masa volumen Solucion
Solucion Clasificacion de las disoluciones
Clasificacion de las disoluciones