PRO TOL YTIC K R EAK CE Protolytick











![v čisté vodě jsou koncentrace obou iontů stejné [H 3 O+] = [OH- ] v čisté vodě jsou koncentrace obou iontů stejné [H 3 O+] = [OH- ]](https://slidetodoc.com/presentation_image_h2/5cc38d081cf0b41c9bbbff40db5f0046/image-13.jpg)









- Slides: 24

PRO TOL YTIC KÉ R EAK CE

Protolytické reakce = jsou děje, při nichž dochází k přenosu H+ (reakce mezi kyselinami a zásadami) Teorie kyselin a zásad Arrhenius (švédský chemik): Kyseliny jsou látky, které v roztocích disociují na vodíkové kationty a příslušné anionty HCl H+ + Cl- nebo H 2 SO 4 2 H+ + SO 42 Zásady jsou látky, které v roztocích disociují na hydroxidové anionty a příslušné kationty Na. OH Na+ + OH- Ca(OH)2 Ca 2+ + 2 OH-

Později se zjistilo: • Kationty H+ se v roztocích prakticky nevyskytují, ale jsou vázány na nějaké jiné částice • kyselé roztoky tvoří i částice , které Arh. teorii neodpovídají , obdobně je to i se zásaditými roztoky

Brönsted (dánský chemik): ( Kyselina = látka odštěpující proton H+ (hydron) – donor protonu Zásada = látka přijímající proton H+ – akceptor protonu Protolytická reakce je založena na výměně protonu H+ mezi kyselinou a zásadou, přitom vzniká nová kyselina a zásada. HA + B A- + HB+ kyselina zásada kyselina anion A- je zase možnou zásadou a vzniklý HB+ je možnou kyselinou HA … A- B… HB+ tvoří: konjugované páry

S. A. Arrhenius, 1924 Johannes Nicolaus Brønsted 22. února 1879, Varde, Dánsko 17. prosince 1947, Kodan, Dánsko

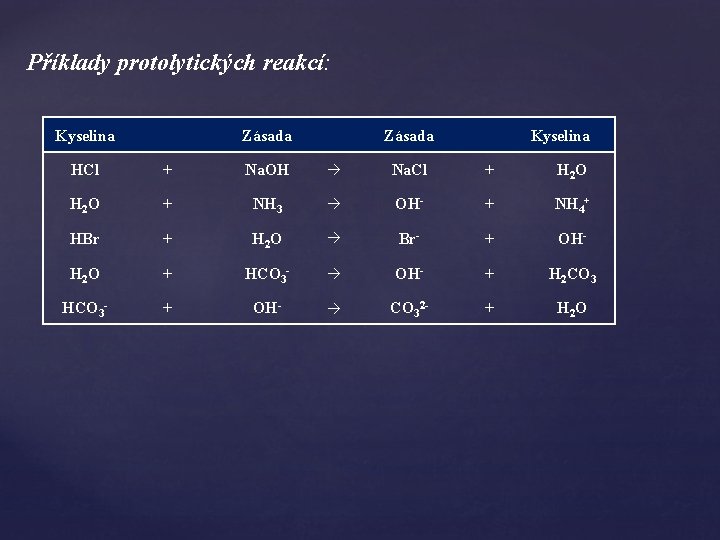
Příklady protolytických reakcí: Kyselina Zásada Kyselina HCl + Na. OH → Na. Cl + H 2 O + NH 3 → OH- + NH 4+ HBr + H 2 O → Br- + OH- H 2 O + HCO 3 - → OH- + H 2 CO 3 HCO 3 - + OH- → CO 32 - + H 2 O

Některé látky mohou reagovat jako kyseliny i zásady, tyto látky mají amfiprotní charakter záleží , jaký a jak silný je jejich partner, dělení na kyseliny a zásady je relativní Ke srovnání obvykle používáme vodu. Látky aprotní – nepřijímají ani neodevzdávají protony – např. benzen, CCl 4

Významné protolytické reakce 1. Disociace kyselin a zásad = protolytická reakce kyseliny nebo zásady s vodou za vzniku iontů, ustaví se rychle disociační rovnováha Disociace kyselin ve vodě + HA + H 2 O AH 3 O+ Rovnovážná konstanta : K = [H 3 O+]. [A- ] [HA] [H 2 O] Pokud roztok není příliš koncentrovaný, je voda v nadbytku, její koncentraci můžeme považovat za konstantní a zahrnout ji do konstanty, dostáváme tzv. disociační konstantu KA : K. /H 2 O/ = [H 3 O+]. [A- ] [HA] KA = [H 3 O+]. [A-] [HA]

Disociace vícesytných kyselin probíhá jako postupné odštěpování protonů z molekuly kyseliny, o rovnovážných koncentracích rozhoduje disociace kyseliny do 1. stupně, platí: KA 1 >> KA 2 >> KA 3 znázorněte pro k. sírovou a k. fosforečnou !

silné kyseliny: KA > 10 -2 ve vodě jsou úplně disociovány na oxoniové ionty a příslušné anionty příklady: HCl. O 4, HCl, H 2 SO 4, HNO 3, HI, HBr středně silné kyseliny: KA = 10 -4 - 10 -2 ve vodných roztocích jsou koncentrace nedisociovaných molekul a disociací vzniklých iontů srovnatelné příklady: HF, H 3 PO 4, HNO 2 slabé kyseliny: KA < 10 -4 ve vodě jsou disociovány velmi málo, převažují nedisociované molekuly příklady: H 2 CO 3, H 2 S, HCN, HOCl, H 3 BO 3

Disociace zásad ve vodě B + H 2 O HB+ + OHDisociační konstanta KB : obdobně jako pro kyseliny KB = [HB+]. [OH-] [B] silné zásady KB > 10 -2 ve vodě jsou úplně disociovány příklady: hydroxidy, sulfidy a hydridy alkalických kovů alkalických zemin středně silné zásady KB= 10 -4 - 10 -2 ve vodě jsou částečně disociovány příklady: fosforečnany a uhličitany alkalických kovů slabé zásady KB < 10 -4 ve vodě jsou nepatrně disociovány příklady: NH 3, siřičitany, hydrogenuhličitany,

2. Autoprotolýza = vzájemná reakce 2 molekul téže látky amfiprotního charakteru, jedna molekula reaguje jako kyselina, druhá jako zásada autoprotolýza vody: H 2 O + H 2 O Z ustaví se autoprotolytická rovnováha: K H 3 O+ + K OHZ K = [H 3 O+]. [ OH- ] [H 2 O]2 disociuje jen nepatrná část vody, koncentrace vody je v přebytku, může být považována prakticky za konstantní K. [H 2 O] 2 = [H 3 O+]. [OH -] KV = [H 3 O+]. [OH -]…iontový součin vody při 25°C KV = 1. 10 -14
![v čisté vodě jsou koncentrace obou iontů stejné H 3 O OH v čisté vodě jsou koncentrace obou iontů stejné [H 3 O+] = [OH- ]](https://slidetodoc.com/presentation_image_h2/5cc38d081cf0b41c9bbbff40db5f0046/image-13.jpg)
v čisté vodě jsou koncentrace obou iontů stejné [H 3 O+] = [OH- ] …. neutrální roztok můžeme psát: KV = [H 3 O+] 2 Rovnováha mezi oxoniovými a hydroxidovými anionty se ustavuje ve všech vodných roztocích roztoky zásadité : [OH-] > [H 3 O+] roztoky kyselé : [H 3 O+] > [OH-] Počítání s mocninami je nevýhodné, proto byla zavedena tzv. stupnice p. H vodíkový exponent zavedl dánský chemik S. P. Sörensen v r. 1909 : p. H = - log [H 3 O+]

Sören Peter Lauritz Sörensen dánský biochemik (9. 1. 1868 -12. 2. 1939) Zabýval se studiem roztoků, acidity a alkality, studoval aminokyseliny, peptidy a enzymy

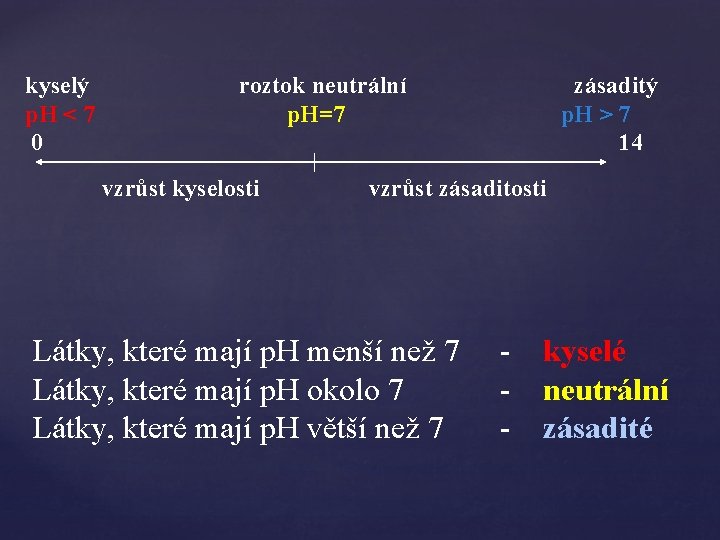
kyselý p. H < 7 0 roztok neutrální p. H=7 vzrůst kyselosti zásaditý p. H > 7 14 vzrůst zásaditosti Látky, které mají p. H menší než 7 Látky, které mají p. H okolo 7 Látky, které mají p. H větší než 7 - kyselé - neutrální - zásadité

měření p. H : acidobazické indikátory, p. H-metry Indikátory - látky, které mají jinou barvu v kyselém prostředí a jinou barvu v zásaditém prostředí. Většinou se používají univerzální indikátorové papírky. Jsou v krabičce s barevnou stupnicí p. H. Papírek se namočí do roztoku a zbarvení papírku se porovná se stupnicí na krabičce. Barva odpovídající barvě papírku udává hodnotu p. H.


3. Neutralizace reakce mezi vodnými roztoky kyselin a zásad produkty: sůl a voda HCl (aq) + Na. OH (aq) iontově: H 3 O+ + Cl- + Na+ + OH- Na. Cl (aq) + H 2 O (l) Na+ + Cl- + 2 H 2 O princip: oxoniové kationty a hydroxylové anionty poskytují molekulu vody

4. Hydrolýza solí = protolytická reakce iontů soli s vodou mohou nastat tyto případy: • sůl odvozená od silné kyseliny a silné zásady tvoří roztoky neutrální, disociací vznikají stabilní ionty, které nepodléhají hydrolýze Příklad: Na. Cl, KNO 3, Na 2 SO 4, KBr

• sůl odvozená od silné kyseliny a slabé zásady tvoří roztoky kyselé Příklad: NH 4 NO 3, Fe. Cl 3, Al. Cl 3 Kationty slabé zásady jsou nestabilní, reagují jako kyseliny a při reakci s vodou uvolňují ionty H 3 O+. NH 4+ + H 2 O Fe 3+ + 6 H 2 O Al 3+ + 6 H 2 O NH 3+ H 3 O+ Fe(OH)3 + 3 H 3 O+ Al(OH)3 + 3 H 3 O+

• sůl odvozená od slabé kyseliny a silné zásady tvoří roztoky zásadité Příklad: Na 2 S, Na 2 CO 3, K 3 PO 4, Na. Cl. O Anionty slabé kyseliny jsou nestabilní, reagují jako zásady a při reakci s vodo uvolňují ionty OH- S 2 - + H 2 O CO 32 - + H 2 O PO 43 - + H 2 O Cl. O- + H 2 O HSHCO 3 HPO 42 HCl. O + + OHOH-

• sůl odvozená od slabé kyseliny a slabé zásady tvoří roztoky přibližně neutrální Příklad: (NH 4)2 CO 3, (NH 4)2 S Hydrolýze podléhají oba ionty, takže se současně uvolňují ionty H 3 O+ i OH-, a proto není rovnováha těchto iontů příliš narušena

Zdroje Literatura: KOVALČÍKOVÁ, Tatiana. Obecná a anorganická chemie. 3. vyd. Pavko, 2004. Odkazy: PRIX-NOBEL. ORG. [online]. [cit. 2014 -11 -23]. Dostupné z: http: //www. prixnobel. org/EN/Chemistry/images/arrhenius. jpg XERIUS. JERGYM. HIEDU. CZ. [online]. [cit. 2014 -11 -23]. Dostupné z: http: //xerius. jergym. hiedu. cz/~canovm/objevite/objev 2/sorensen 5. jpg WIKIPEDIA. ORG. [online]. [cit. 2014 -11 -23]. Dostupné z: http: //cs. wikipedia. org/wiki/Soubor: Johannes_Br%C 3%B 8 nsted. jpg
