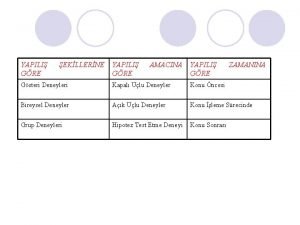
MALZEMELERN SINIFLANDIRILMASI Malzemeler fiziksel hallerine gre Kat Sv




















- Slides: 21

MALZEMELERİN SINIFLANDIRILMASI

Malzemeler, fiziksel hallerine göre • Katı • Sıvı • Gaz

Doğada bulunan malzemeleri Madensel ve Madensel olmayanlar diye iki ana gruba ayrılmaktadır Madensel Malzemeler: Bu gruba doğada bulunan bütün metaller girmektedir. Metaller belirli ortak özelliklere sahiptirler. Biçimlendirilebilmeleri, ağır oluşları, ısı ve elektriği iyi iletmeleri, her metalin kendine özgü bir rengi bulunması, oda sıcaklığında katı durumda bulunmaları, kristal yapıya sahip olmaları metallerin ortak özellikleridir. Madensel Olmayan Malzemeler: Madensel malzemeler dışındaki bütün malzemelerdir. Organik ve İnorganik olmak üzere iki grup altında toplanabilirler. Yine her bir grupta yapay ve doğal olmak üzere kendi aralarında ikiye ayrılırlar.


3. MALZEMELERİN İÇ YAPISI Madde Nedir ? • Uzayda yer kaplayan her şeye madde denilmektedir. Maddeler, • katı, • sıvı veya • gaz • halinde bulunabilirler.

Molekül: Bir cismin özelliklerini taşıyan en küçük parçacığa molekül adı verilmektedir. Madde ise aynı özelliklere sahip moleküller topluluğudur. Atom : Elementlerin en küçük birimine atom adı verilmektedir.

Malzeme biliminin amacı Malzemelerin iç yapısını incelemek, İç yapılarla özellikler arasındaki ilişkileri araştırmak, Geliştirilecek temel ilkeler ve kavramlar ışığında uygulamada kullanılan malzemeleri tanıtmaktadır. Bu bölümde malzemelerin iç yapıları gözden geçirilecektir.

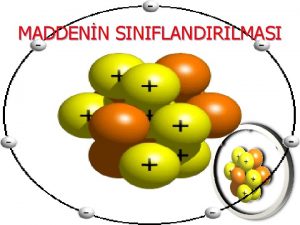
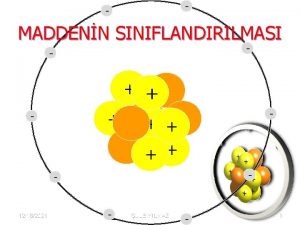
3. 1. Atomsal Yapı • Atomlar bir çekirdek ile onu çevreleyen elektronlardan oluşurlar. • Çekirdekte artı elektriksel yüklü protonlarla, yüksüz nötronlar bulunur. • Elektriksel yük yönünden nötr bir atomda çekirdeği çevreleyen eksi yüklü elektronlarla artı yüklü protonların sayısı eşittir.

• Atomun ağırlığı çekirdeği oluşturan proton ve nötronların ağırlıkları toplamına eşit sayılır. • Bir atomun çekirdeğini kuşatan elektronlar belirli enerjilere sahiptirler ve belirli yörüngeler üzerinde hareket ederler. Bir enerji düzeyinde en fazla iki elektron bulunabilir ve bunlar zıt yönde hareket ederler. Enerji düzeyi doldukça elektronlar bir üst düzeye geçerler. • Atomların en dış kabuğundaki elektronlara valans elektronlar denir. Bunlar atomların oluşturduğu cisimlerin özelliklerini büyük ölçüde etkiler. Atomlar arası bağ türlerini, atomlar arası uzaklığı, mekanik mukavemetleri, elektriksel, kimyasal ısıl ve optik özellikleri bu elektronlar belirler.

• Elektron alışverişi ve elektron paylaşılması sonucu zıt işaretli elektriksel yüke sahip parçacıklar doğar. Bunlar arasındaki elektrostatik türden çekme kuvvetleri atomlar arası bağları oluşturur. • Bu şekilde doğan kuvvetlere atomlar arası kuvvetli bağlar denir. Bu bağlar iyonsal bağlar, kovalent bağlar, metalsal bağlar olmak üzere üç sınıfa ayrılırlar.

3. 1. 1. Atomlar Arası Bağlar • İyonik Bağ • Kovalent Bağ • Metalsal Bağ • Atomlar Arası Zayıf Bağlar

İYONSAL BAĞ • Atomlararası en basit bağ türü olan iyonsal bağ artı yüklü iyonla eksi yüklü iyon arasındaki çekme kuvvetinden doğar. İyonsal bağ küresel nitelikte olduğundan yönsüzdürler. En çok rastlanan iyonsal bağ, bir metal atomundan diğer metal olmayan bir atoma elektron transferi sonucu oluşur (Na. Cl de olduğu gibi) İyonların son yörünge elektronlarının dizilişi bir soy gaz yapısına benzeyinceye kadar bu devam eder. Örneğin, Na+ + Cl- �Na+Cl- 3. 20 denkleminde Na'un elektron dizilişi, (1 s)2 (2 p)6 (3 s)1; 3. 21 Cl’un elektron dizilişi, (1 s)2 (2 p)6 (3 s)2 ve (3 p)5 3. 22 • Bir atom ister elektron alsın, ister şeklindedir. Burada Na son yörüngesindeki 1 elektronunu Cl’a vererek asal gaz konumuna elektron versin + veya – yük kazanır. + veya – yüklü atomlara Sahib olurlar. Bu bağ çeşidi kimyasal bağların en önemlisidir. Doğal bileşiklerin İYON adı verilir. Farklı elektrik % 80'i bu bağa sahiptir (silikat, sülfit ve oksitler yüküne sahip iyonlar birbirlerini gibi) çekerler. İyonlar arasındaki bu çekme gücüne İYONİK BAĞ adı verilir

Kovalent Bağ • Bazı atomlar özel koşullar altında elektronlarının bir kısmını komşuları ile çifter paylaşabilirler. Paylaşılan eksi yüklü elektronlarla artı yüklü ana atomların çekirdekleri arasında çekme kuvvetleri kovalent bağ oluşturur.

Metalsal Bağ • Metal ve alaşımlarda en çok görülen bağ çeşididir. Bir atomda yalnız birkaç valans (dış kabuk) elektronu var ise, bunlar kolaylıkla atomdan ayrılabilirler, diğer elektronlar ise çekirdeğe sıkıca bağlıdır. Valans elektronları metal içerisinde serbest olarak hareket ettiğinden, ekseriya “elektron bulutu” denilen ortamı yaratır (Şekil 4)

Kristal Yapı Atomların üç boyutlu uzayda belirli bir düzene göre dizilmeleri sonucu oluşan yapıya kristal yapı adı verilir Bütün metaller, önemli sayıda seramikler, doğada bulunan bazı mineraller ve bazı polimerler kristal yapıya sahiptirler. Sıvı halde düzensiz biçimde dağılan atomlar katılaşırken belirli bir düzene göre dizilirler. Metallerdeki özelliklerin büyük kısmı atomlarının diziliş şekillerine “Kafes Şekillerine” bağlıdır.

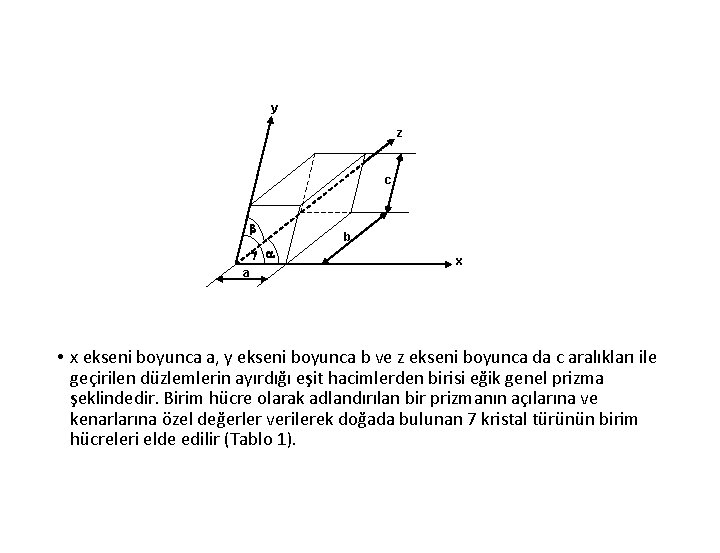
Kristal Türleri • Düzenli yapının en küçük hacimsel birimine Birim Hücre denir. • Basit bir geometrik şekle sahiptir ve uzayı düzlemlerle eşit hacimlere bölerek elde edilir. Uzayda en genel halde bir eksen takımı seçilsin, bu eksenlerin aralarındaki açılar a, b, c olsun ve uzay bu eksenler boyunca eşit aralıklı paralel düzlemler geçirilerek eşit hacimlere ayrılsın

y z c b g a a b x • x ekseni boyunca a, y ekseni boyunca b ve z ekseni boyunca da c aralıkları ile geçirilen düzlemlerin ayırdığı eşit hacimlerden birisi eğik genel prizma şeklindedir. Birim hücre olarak adlandırılan bir prizmanın açılarına ve kenarlarına özel değerler verilerek doğada bulunan 7 kristal türünün birim hücreleri elde edilir (Tablo 1).




 Servant çeşitleri
Servant çeşitleri Manyetik alan
Manyetik alan Yeşil salata sosları
Yeşil salata sosları Dönüşümsüz malzemeler
Dönüşümsüz malzemeler Elastik bölge plastik bölge
Elastik bölge plastik bölge Metallerin özellikleri
Metallerin özellikleri Smd kılıf ölçüleri
Smd kılıf ölçüleri Beton üretiminde kullanılan malzemeler
Beton üretiminde kullanılan malzemeler Motor gre
Motor gre Draws heavily on meaning
Draws heavily on meaning Gre
Gre Danubiana roman
Danubiana roman Maria gre
Maria gre Gre sınav soruları
Gre sınav soruları Iprof gre
Iprof gre Gre recife sul
Gre recife sul Difference of t distribution and normal distribution
Difference of t distribution and normal distribution How to pronounce postgre
How to pronounce postgre Peter gre
Peter gre Gre elaboration
Gre elaboration The power of film video and tv in the classroom
The power of film video and tv in the classroom Gre test
Gre test