Les molcules Molcule daspirine ralise avec le logiciel

















- Slides: 21

Les molécules Molécule d’aspirine réalisée avec le logiciel Avogadro

THEME 2 : La Santé Dixième parcours : Les molécules NOTIONS ET CONTENUS COMPÉTENCES ATTENDUES Formules et modèles moléculaires. Représenter des formules développées Formules développées et semi développées correspondant à développées des modèles moléculaires. Savoir qu’à une formule brute peuvent Isomérie. correspondre plusieurs formules semi développées. Utiliser des modèles moléculaires et des logiciels de représentation. Repérer la présence d'un groupe Molécules simples ou complexes : caractéristique structures et groupes caractéristiques. dans une formule développée.

Sanofi et Astra. Zeneca échangent des molécules pour innover plus rapidement Les groupes pharmaceutiques Sanofi et Astra. Zeneca ont annoncé vendredi un accord de collaboration prévoyant l'échange de plus de 200 000 molécules issues de leurs chimiothèques exclusives respectives. "Nous avons beaucoup travaillé ces dernières années pour enrichir notre bibliothèque de molécules et cet échange, de loin le plus important que nous ayons réalisé, nous permet d'accroître sa diversité de manière significative", déclare Mene Pangalos, viceprésident exécutif, Médicaments Innovants et Développement Précoce, d'Astra. Zeneca. Reuters, 20/11/2015

Etape 1: Comment se forment les molécules ? Visiblement, médicament et molécules ont un lien, mais qu'est-ce qu'une molécule ? Et pourquoi ce nombre si important, 200 000 ? Activité page 78 de votre manuel.

1 a. Donner la formule et le nom de la molécule présentée sur la figure 1. H 2, dihydrogène. b. Quelle est la structure électronique de l'atome qui constitue cette molécule ? H : (K)1.

2 a. Quelle est celle de l'atome d'hélium (He), qui est un gaz noble ? He : (K)2. b. Rappeler pourquoi les gaz nobles sont particulièrement stables. Les gaz nobles ont 2 ou 8 électrons externes.

3 Afin d'acquérir la même structure électronique l'atome d'hélium, combien d'électrons manquet-il à l'atome de la figure 1 ? Il manque un électron à l’atome d’hydrogène. 4 Pour obtenir le ou les électrons qui lui manquent, un atome va pouvoir établir des liaisons chimiques avec d'autres atomes et former une molécule.

Pour former une liaison chimique, un atome va mettre en commun un électron avec un autre atome. Représenter les deux atomes de la figure 1 par leur symbole chimique en plaçant autour d'eux, sous forme de points, les électrons de leur couche externe. H· ·H

5 a. On obtient la formule développée de la molécule en reliant par un trait deux électrons partagés par deux atomes, formant ainsi un doublet d'électrons. Écrire la formule développée de la molécule de la figure 1. H–H

b. Vérifier que chacun des atomes est maintenant entouré du même nombre d'électrons que l'hélium. Chaque atome d’hydrogène est entouré de 2 électrons, comme l’atome d’hélium. 6 Appliquer la même démarche pour établir la formule développée de la molécule de la figure 2, sachant que pour l'atome central le gaz noble de référence est le néon (Z = 10).

C : (K)2 (L)4 et Ne : (K)2 (L)8. L’atome de carbone va établir 4 liaisons, d’où : Pour conclure Une liaison entre deux atomes est appelée liaison covalente. Pourquoi et comment une liaison covalente se forme-t-elle ?

Une liaison covalente correspond à la mise en commun de deux électrons par deux atomes, chaque atome fournissant un électron. Les liaisons covalentes permettent aux atomes de gagner le nombre d’électrons dont ils ont besoin pour acquérir la même structure électronique qu’un gaz noble.

Etape 2: Réalisons des modèles moléculaires Le logiciel Avogadro permet de visualiser les molécules dans l’espace, de les observer sous différents angles et suivant différents modes de représentation. Ainsi les chimistes peuvent-ils communiquer. Objectif 1 Créez le modèle moléculaire de la molécule d’aspirine.

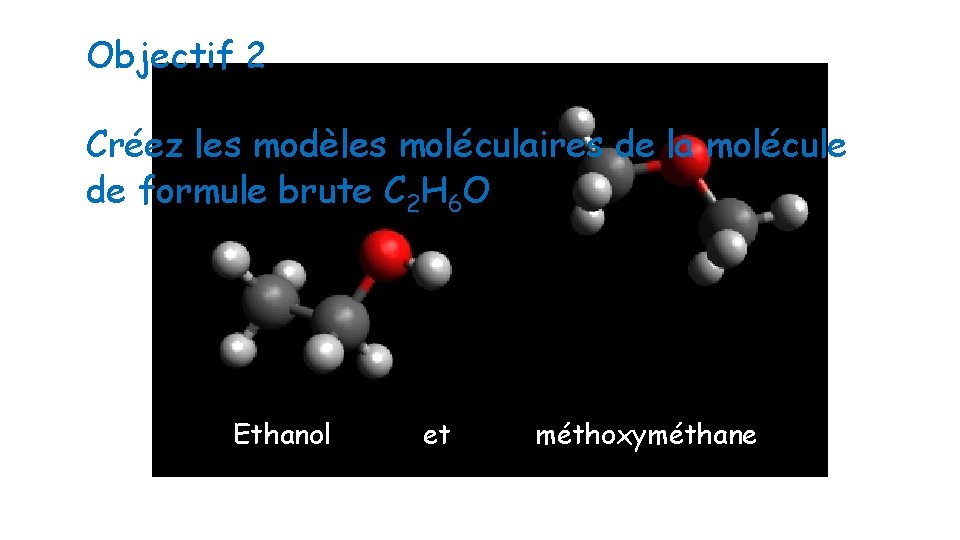
Objectif 2 Créez les modèles moléculaires de la molécule de formule brute C 2 H 6 O Ethanol et méthoxyméthane.

La formule brute d'une molécule indique la nature des atomes qui la constituent et le nombre de chacun de ces atomes. Ce nombre est précisé en indice, à droite du symbole des atomes. Une liaison covalente correspond à la mise en commun de deux électrons par deux atomes, chaque atome fournissant un électron. Elle est schématisée par un trait : —

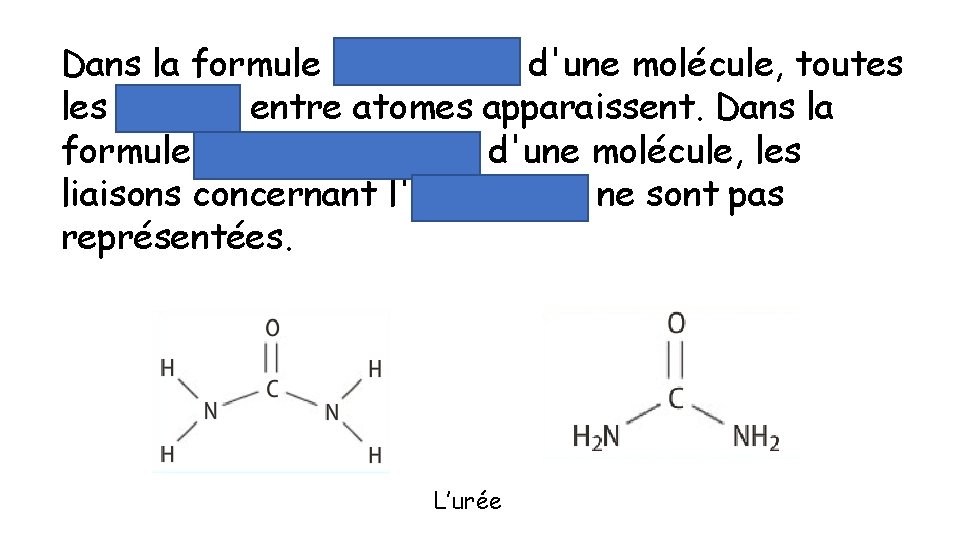
Dans la formule développée d'une molécule, toutes liaisons entre atomes apparaissent. Dans la formule semi-développée d'une molécule, les liaisons concernant l'hydrogène ne sont pas représentées. L’urée

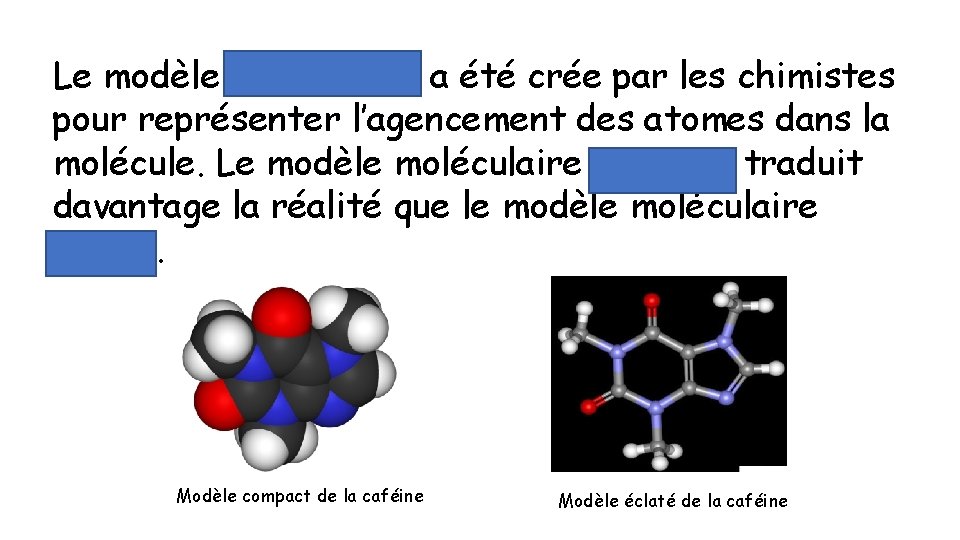
Le modèle moléculaire a été crée par les chimistes pour représenter l’agencement des atomes dans la molécule. Le modèle moléculaire compact traduit davantage la réalité que le modèle moléculaire éclaté. Modèle compact de la caféine Modèle éclaté de la caféine

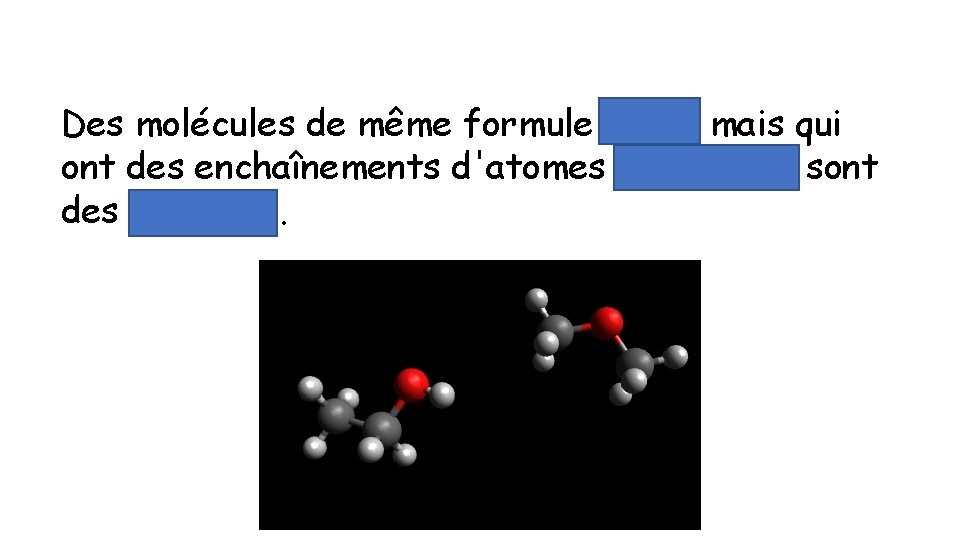
Des molécules de même formule brute mais qui ont des enchaînements d'atomes différents sont des isomères.

Etape 3 : Groupes caractéristiques Un groupe caractéristique est une partie de la molécule (groupement d’atomes autres que les seuls atomes de carbone et d’hydrogène) qui confère des propriétés particulières à la molécule.

Repérer et entourer les groupes caractéristiques présents dans les formules développées représentées ci-dessous : Molécule 1 : caféine. Molécule 2 : tétrahydrocannabinol (molécule principale du cannabis). Molécule 3 : cocaïne. Molécule 4 : éphédrine (espèce chimique stimulante). Molécule 5 : aspirine (médicament).

 Molcules
Molcules Ralise
Ralise Ralise
Ralise Jesus soit avec vous a jamais
Jesus soit avec vous a jamais Fait des comparaisons avec les adjectifs
Fait des comparaisons avec les adjectifs Les parents avec l'institutrice parle sont ceux de marie
Les parents avec l'institutrice parle sont ceux de marie Pronom réfléchi
Pronom réfléchi Le grand je suis paroles
Le grand je suis paroles Pronoms toniques
Pronoms toniques Les expressions avec le subjonctif
Les expressions avec le subjonctif Première prise de contact
Première prise de contact Logiciel
Logiciel Logiciel sacoche
Logiciel sacoche Calage avion
Calage avion Logiciel
Logiciel Joseph larmarange
Joseph larmarange Ebios exemple
Ebios exemple Le protocole arp
Le protocole arp Passerelle logiciel
Passerelle logiciel Logiciel gabi
Logiciel gabi Lindo systems
Lindo systems Logiciel schéma cinématique
Logiciel schéma cinématique