Les molcules et les solutions Questce quune molcule




- Slides: 13

Les molécules et les solutions

Qu’est-ce qu’une molécule ? Une MOLÉCULE est un ensemble de deux ou de plusieurs atomes liés chimiquement. Pourquoi les atomes ont-ils tendance à se lier avec d’autres atomes ? Une des réponses à cette question est que les atomes cherchent généralement à acquérir une configuration électronique semblable à celle des gaz nobles, car ils deviennent alors plus stables. Les GAZ NOBLES, qui forment la FAMILLE VIII A dans le tableau périodique, sont en effet extrêmement stables. Il est très difficile de faire réagir un gaz noble avec d’autres atomes. Cette particularité vient du fait que leur couche électronique la plus éloignée du noyau, c’est-à-dire la couche contenant les ÉLECTRONS DE VALENCE, est complète.

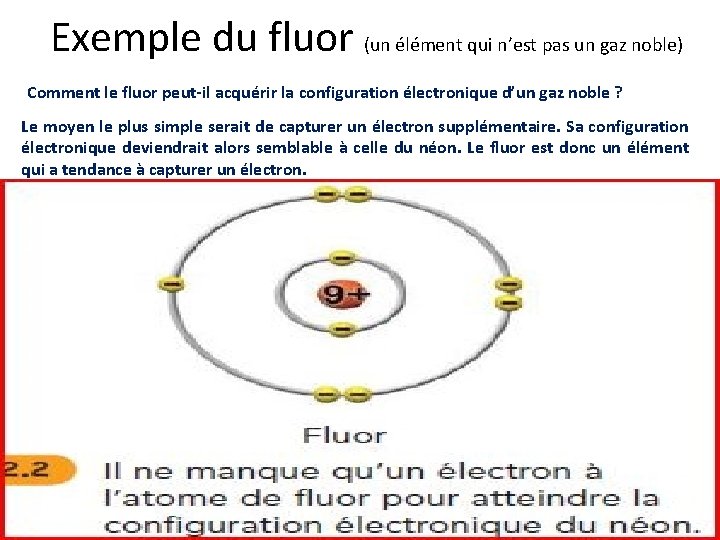
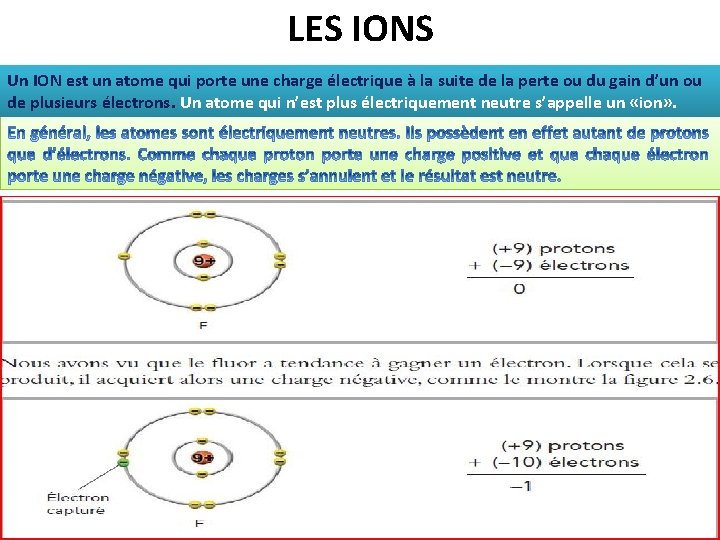
Exemple du fluor (un élément qui n’est pas un gaz noble) Comment le fluor peut-il acquérir la configuration électronique d’un gaz noble ? Le moyen le plus simple serait de capturer un électron supplémentaire. Sa configuration électronique deviendrait alors semblable à celle du néon. Le fluor est donc un élément qui a tendance à capturer un électron.

Le cas du sodium La couche électronique la plus éloignée du noyau de cet élément ne contient qu’un seul électron. Il pourrait bien sûr essayer de capturer sept autres électrons pour atteindre la même configuration électronique l’argon, mais il existe un moyen plus simple: donner un électron. S’il agissait ainsi, le sodium présenterait la même configuration électronique le néon. Le sodium est donc un élément qui a tendance à donner un électron.

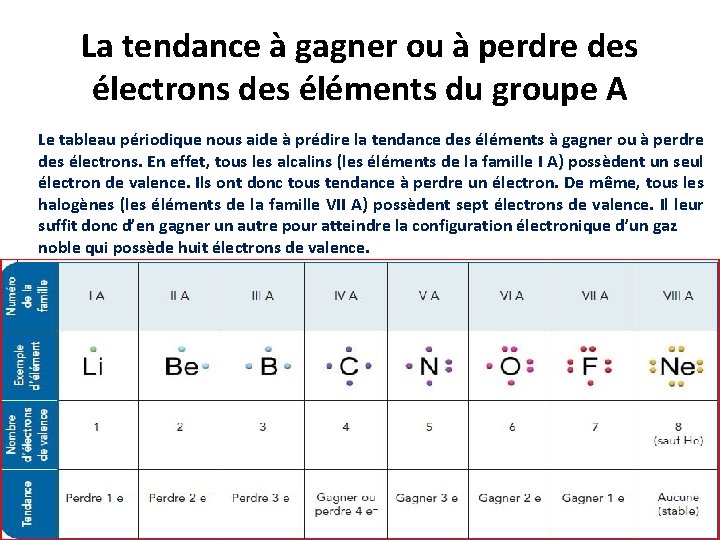
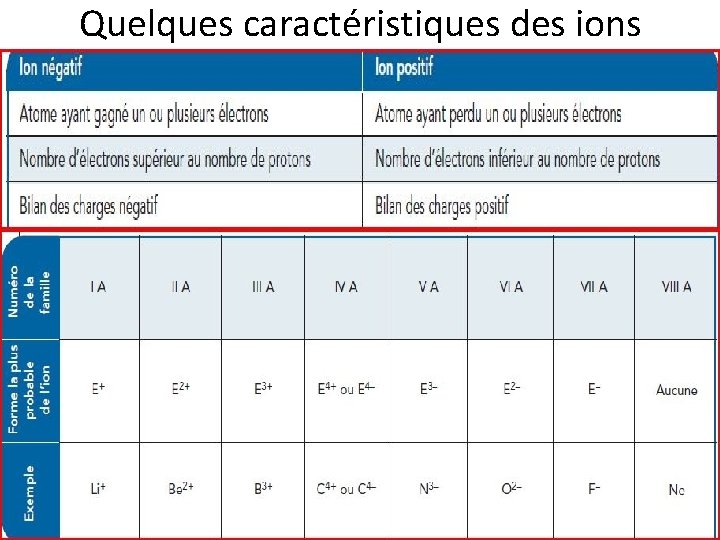
La tendance à gagner ou à perdre des électrons des éléments du groupe A Le tableau périodique nous aide à prédire la tendance des éléments à gagner ou à perdre des électrons. En effet, tous les alcalins (les éléments de la famille I A) possèdent un seul électron de valence. Ils ont donc tous tendance à perdre un électron. De même, tous les halogènes (les éléments de la famille VII A) possèdent sept électrons de valence. Il leur suffit donc d’en gagner un autre pour atteindre la configuration électronique d’un gaz noble qui possède huit électrons de valence.

LES IONS Un ION est un atome qui porte une charge électrique à la suite de la perte ou du gain d’un ou de plusieurs électrons. Un atome qui n’est plus électriquement neutre s’appelle un «ion» .

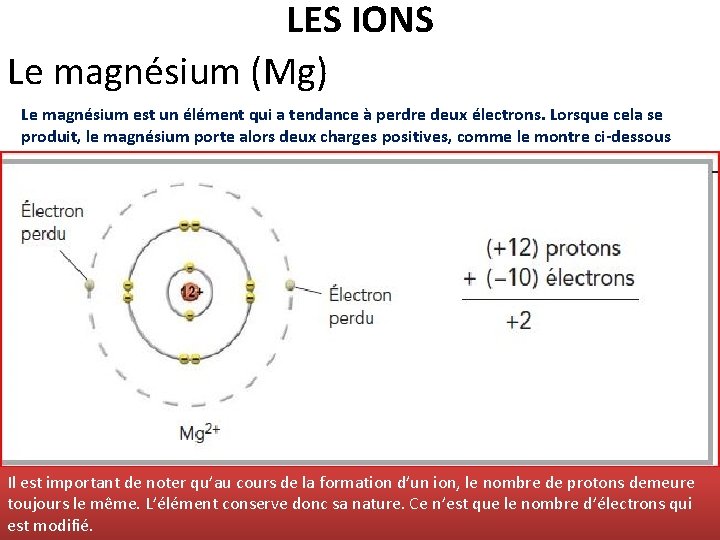
LES IONS Le magnésium (Mg) Le magnésium est un élément qui a tendance à perdre deux électrons. Lorsque cela se produit, le magnésium porte alors deux charges positives, comme le montre ci-dessous Il est important de noter qu’au cours de la formation d’un ion, le nombre de protons demeure toujours le même. L’élément conserve donc sa nature. Ce n’est que le nombre d’électrons qui est modifié.

Quelques caractéristiques des ions

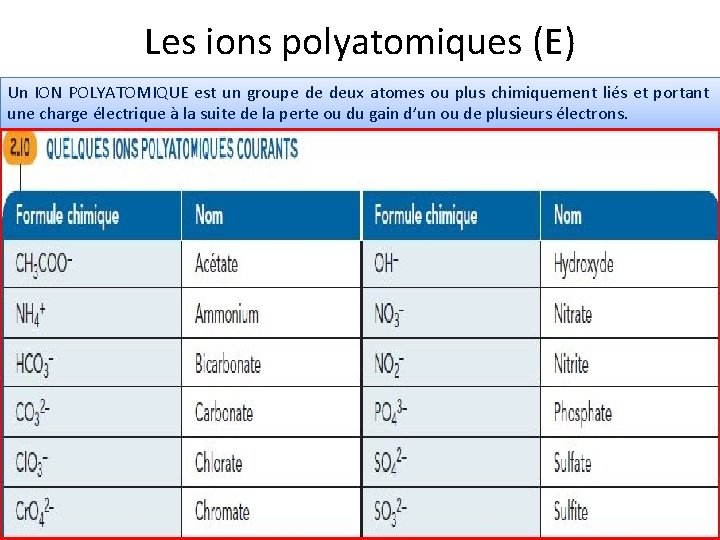
Les ions polyatomiques (E) Un ION POLYATOMIQUE est un groupe de deux atomes ou plus chimiquement liés et portant une charge électrique à la suite de la perte ou du gain d’un ou de plusieurs électrons.

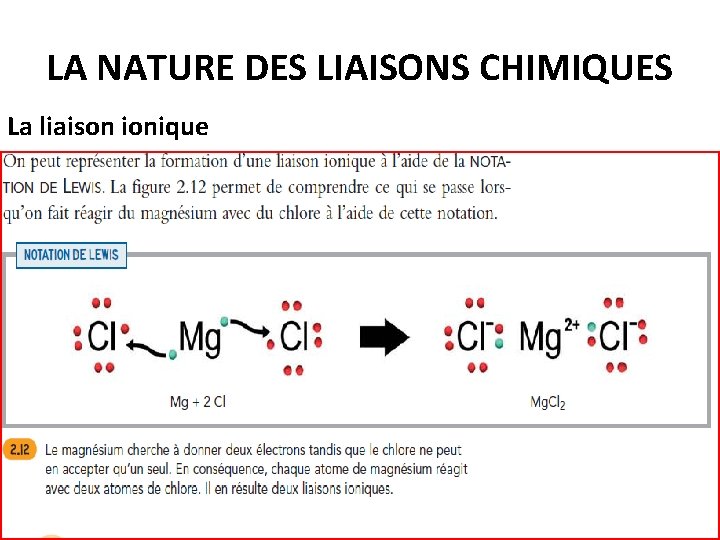
LA NATURE DES LIAISONS CHIMIQUES (STE) Une LIAISON CHIMIQUE est l’union de deux atomes à la suite du transfert ou du partage d’un ou de plusieurs électrons. Il existe 2 type de liaisons chimiques La liaison ionique Une LIAISON IONIQUE est le résultat du transfert d’un ou de plusieurs électrons d’un atome (généralement un métal: donneur d’électrons) à un autre atome (généralement un non-métal: receveur d’électrons).

LA NATURE DES LIAISONS CHIMIQUES La liaison ionique

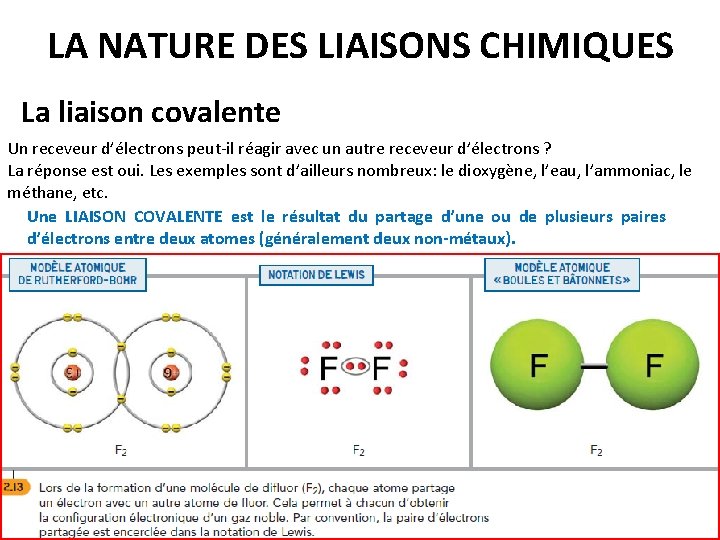
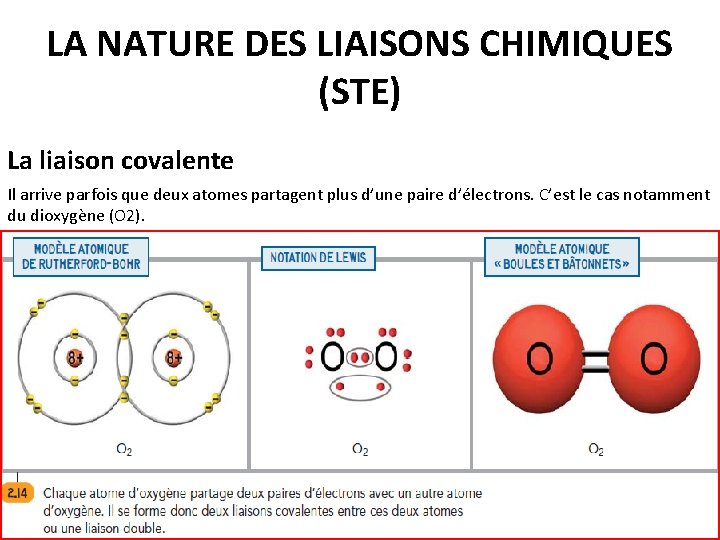
LA NATURE DES LIAISONS CHIMIQUES La liaison covalente Un receveur d’électrons peut-il réagir avec un autre receveur d’électrons ? La réponse est oui. Les exemples sont d’ailleurs nombreux: le dioxygène, l’eau, l’ammoniac, le méthane, etc. Une LIAISON COVALENTE est le résultat du partage d’une ou de plusieurs paires d’électrons entre deux atomes (généralement deux non-métaux).

LA NATURE DES LIAISONS CHIMIQUES (STE) La liaison covalente Il arrive parfois que deux atomes partagent plus d’une paire d’électrons. C’est le cas notamment du dioxygène (O 2).