Latomo da Dalton a Rutherford 100 anni di


















- Slides: 23

L’atomo da Dalton a Rutherford 100 anni di scoperte e invenzioni che hanno rivoluzionato Chimica e Fisica Roberto Argazzi, ISOF-CNR

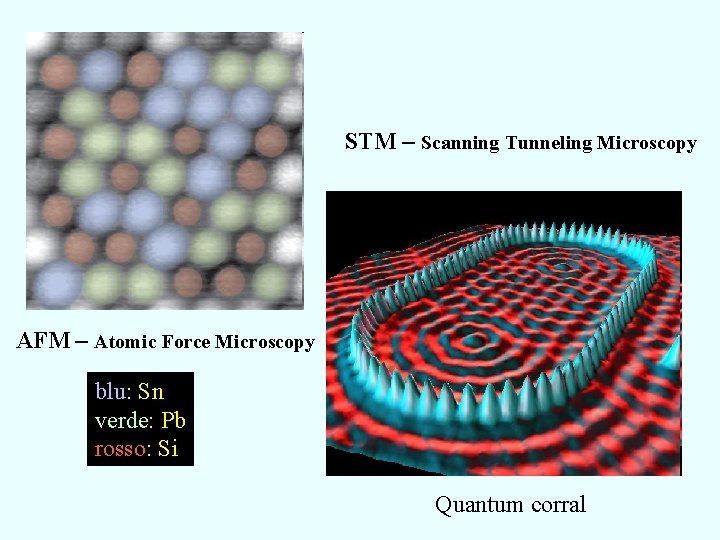
STM – Scanning Tunneling Microscopy AFM – Atomic Force Microscopy blu: Sn verde: Pb rosso: Si Quantum corral

John Dalton (1766 -1844) Internet Archive

Le leggi ponderali Legge della conservazione della massa (Lavoisier, 1743 -1794). Legge delle proporzioni definite (Proust, 1754 -1826). Nelle comuni trasformazioni chimiche la somma dei pesi delle sostanze reagenti è uguale alla somma dei pesi dei prodotti di reazione Due o più elementi si combinano per formare un composto in una proporzione di massa definita e costante. Legge delle proporzioni multiple (Dalton, 1766 -1844). Legge delle proporzioni reciproche (Richter, 1762 -1807). Differenti quantità di uno stesso elemento che si combinano con la stessa quantità di un altro elemento per formare composti diversi, stanno tra loro come numeri interi generalmente piccoli. Il rapporto fra quantità di differenti elementi che si combinano con la stessa quantità di un altro elemento è lo stesso con il quale si combinano tra loro. Es. SO 3, , SO 2 2: 3 Es. CCl 4, CH 4; HCl (1: 1)

Joseph Louis Gay-Lussac (1778 -1850 Legge dei volumi (1808) Quando due sostanze gassose reagiscono tra loro per formare nuove sostanze, anche esse gassose, i volumi dei gas reagenti e di quelli prodotti stanno tra loro in rapporti espressi da numeri interi e semplici

Lorenzo Romano Amedeo Carlo Avogadro, conte di Quaregna e Cerreto (1776 -1856) 1811 « volumi uguali di gas, alla stessa temperatura e pressione, contengono lo stesso numero di molecole »

Michael Faraday (1791 -1867) I° legge di Faraday sull’elettrolisi: II° legge di Faraday sull’elettrolisi: la quantità di sostanza liberata ad un elettrodo di una cella elettrolitica è proporzionale alla quantità di elettricità che ha attraversato la cella. le masse di sostanze diverse liberate agli elettrodi da una stessa quantità di elettricità stanno fra loro come i rispettivi pesi equivalenti (peso atomico/valenza).

Hermann von Helmholtz 1821 -1894 Professor von Helmholtz in April 1881. “Now the most startling result of Faraday's Law is perhaps this. If we accept the hypothesis that the elementary substances are composed of atoms, we cannot avoid concluding that electricity also, positive as well as negative, is divided into definite elementary portions which behave like atoms of electricity. As long as it moves about on the electrolytic liquid each ion remains united with its electric equivalent or equivalents. At the surface of the electrodes decomposition can take place if there is sufficient electromotive force, and then the ions give off their electric charges and become electrically neutral. ”

Heinrich Geissler (1814 -1879)

Heinrich Daniel Ruhmkorff (1803 -1877)

Julius Plucker (1801 -1868) Johann Wilhelm Hittorf (1824 -1914)

William Crookes (1832 -1919)

The Cathode Ray Tube site


Eugen Goldstein (1850 -1931) Raggi canale (1886)

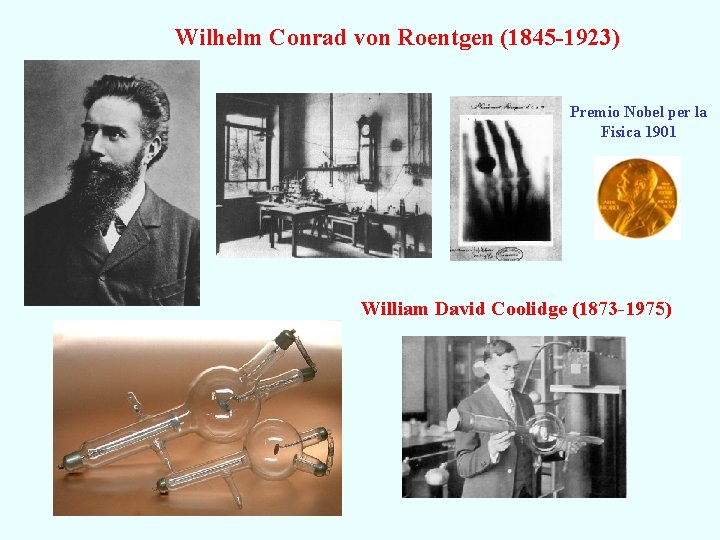
Wilhelm Conrad von Roentgen (1845 -1923) Premio Nobel per la Fisica 1901 William David Coolidge (1873 -1975)

Joseph John Thomson (1856 -1940) Cavendish Laboratory (Cambridge)



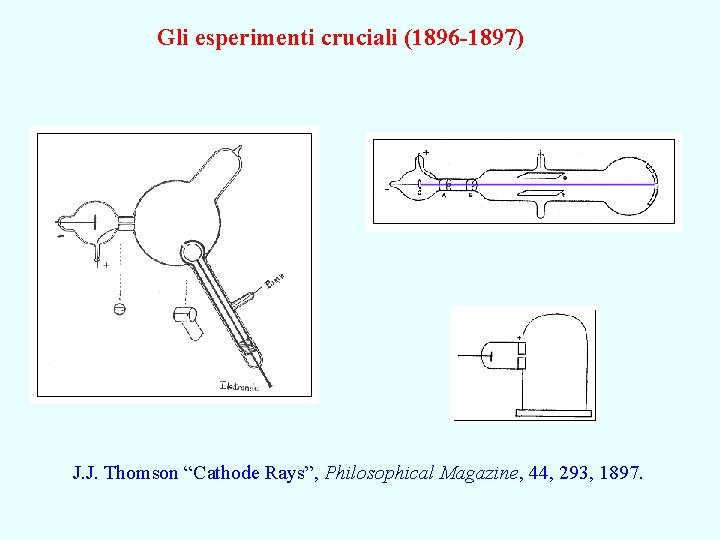
Gli esperimenti cruciali (1896 -1897) J. J. Thomson “Cathode Rays”, Philosophical Magazine, 44, 293, 1897.

"Could anything at first sight seem more impractical than a body which is so small that its mass is an insignificant fraction of the mass of an atom of hydrogen? which itself is so small that a crowd of these atoms equal in number to the population of the whole world would be too small to have been detected by any means then known to science. " Modello atomico “plum-pudding” di Thomson Premio Nobel per la Fisica 1906

Premio Nobel per la Fisica 1903. Ernest Rutherford (1871 -1937). Antoine Henri Becquerel Pierre Curie Marie Curie (1859 -1906). (1867 -1934). (1852 -1908). Premio Nobel per la Chimica 1908. "for his investigations into the disintegration of the elements, and the chemistry of radioactive substances" Marie Curie Premio Nobel per la Chimica 1911. (1867 -1934). "in recognition of the extraordinary services he has rendered by his discovery of spontaneous radioactivity" "in recognition of the extraordinary services they have rendered by their joint researches on the radiation phenomena discovered by Professor Henri Becquerel" "in recognition of her services to the advancement of chemistry by the discovery of the elements radium and polonium, by the isolation of radium and the study of the nature and compounds of this remarkable element"

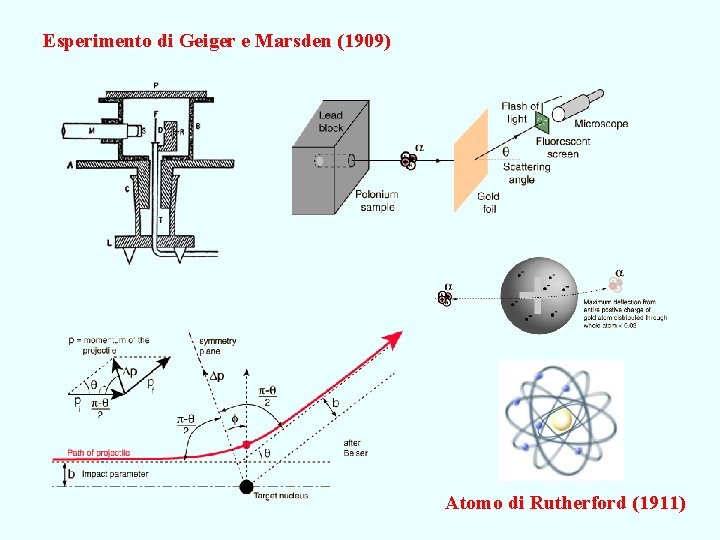
Esperimento di Geiger e Marsden (1909) Atomo di Rutherford (1911)