LARUTAN PENYANGGA Adalah larutan yang dapat mempertahankan p















- Slides: 15

LARUTAN PENYANGGA Adalah larutan yang dapat mempertahankan p. H akibat atau penambahan sedikit asam, basa atau karena pengenceran


CAMPURAN LARUTAN PENYANGGA A. Campuran asam lemah + basa kunjugasi atau garamnya disebut “PENYANGGA ASAM” Contoh : a. CH 3 COOH + CH 3 COONa b. H 3 PO 4 + Na. H 2 PO 4 B. Campuran basa lemah + asam kunjugasi atau garamnya disebut “PENYANGGA BASA” Contoh : NH 4 OH + NH 4 Cl

PEMBUATAN LARUTAN PENYANGGA (A) Asam lemah yang berlebihan dengan basa kuat, akan habis bereaksi dengan kelebihan asam lemah membentuk garam

PEMBUATAN LARUTAN PENYANGGA (B) Basa lemah yang berlebihan dengan asam kuat, akan habis bereaksi dengan basa lemah membentuk garam

PRINSIP KERJA 1. Jika ditambah asam : Ion H+ dari asam tersebut akan dinetralkan oleh basa lemah. 2. Jika ditambah basa : Ion OH- dari basa tersebut akan dinetrakan oleh asam konjugasi

RUMUS p. H (ASAM ) PENYANGGA BERSIFAT ASAM (H+) = Ka. (A) (B) p. H = - log (H+) = p. Ka + log (G) (A) Ket : (A) : konsentrasi asam lemah (G) : konsentrasi basa konjugasi Ka : konstanta asam

RUMUS p. H (BASA) PENYANGGA BERSIFAT BASA (OH-) = Kb. (B) (G) p. OH = - log (OH-) = p. Kb + log (B) (G) Ket : (B) : konsentrasi asam lemah (G) : konsentrasi asam konjugasi Kb : konstanta basa

FUNGSI LARUTAN PENYANGGA ã Dalam tubuh makhluk hidup - Larutan penyangga H 2 CO 3 + HCO 3 - untuk menjaga p. H dalam darah p. H darah tubuh manusia berkisar antara 7, 35 -7, 45. p. H darah tidak boleh kurang dari 7, 0 dan tidak boleh melebihi 7, 8 karena akan berakibat fatal bagi manusia. Organ yang paling berperan untuk menjaga p. H darah adalah paru-paru dan ginjal. - Untuk menjaga PH tubuh agar sesuai dengan karakteristik reaksi enzim - Larutan penyangga karbonat - Larutan penyangga fosfat

FUNGSI LARUTAN PENYANGGA ã Dalam kehidupan sehari-hari Larutan penyangga asam dan natrium sitrat yang menjaga PH dalam makanan kaleng sehingga makanan tidak mudah dirusak oleh bakteri LARUTAN PENYANGGA DALAM OBAT-OBATAN Sebagai obat penghilang rasa nyeri, aspirin mengandung asam asetilsalisilat. Beberapa merek aspirin juga ditambahkan zat untuk menetralisir kelebihan asam di perut, seperti Mg. O.

Obat suntik atau obat tetes mata, p. H-nya harus disesuaikan dengan p. H cairan tubuh. Obat tetes mata harus memiliki p. H yang sama Obat tetes mata dengan p. H air mata agar tidak menimbulkan iritasi yang mengakibatkan rasa perih pada mata. Begitu pula obat suntik harus Obat suntik disesuaikan dengan p. H darah.

LARUTAN PENYANGGA DALAM INDUSTRI Dalam industri, penyangga penanganan Limbah industri digunakan limbah. larutan untuk Larutan penyangga ditambahkan pada limbah untuk mempertahankan p. H 5 -7, 5. Hal itu untuk memisahkan materi organik pada limbah sehingga layak di buang Pembuangan limbah industri ke perairan.

CONTOH SOAL ASAM Ke dalam larutan CH 3 COOH ditambahkan padatan CH 3 COONa , shg konsentrasi CH 3 COOH = 0, 1 Molar dan konsentrasi CH 3 COONa = 0, 05 Molar. Jika Ka CH 3 COOH 1, 8 X 10 -5. Tentukan p. H campuran ? Jawab ( H+) = Ka x (Asam lemah) (Garam) = 1, 8 x 10 -5 x 0, 1 = 3, 6 x 10 -5 0, 05 p. H = - log ( H+) = - log 3, 6 x 10 -5 = 5 - log 3, 6

CONTOH SOAL BASA 50 ml NH 4 OH 0, 1 Molar dicampur dgn 100 ml ( NH 4)2 SO 4 = 0, 2 Molar. Jika Kb NH 4 OH = 10 -5. Tentukan p. H campuran? Jawab: mmol NH 4 OH = V X M = 0, 5 ml x 0, 1 = 5 mmol (NH 4)2 SO 4 = VXM = 100 ml x 0, 2 = 20 mmol ( OH-) = Kb x (mmol basa lemah) 2(mmol garam ) = 10 -5 x 5 = 10 -5 x 0, 125= 1, 25 x 10 -6 2 x 20 p. OH = - log ( OH) = - log 1, 25 x 10 -6 = 6 – log 1, 25 p. H = 14 – ( 6 – log 1, 25 ) = 8+ log 1, 25

TERIMA KASIH
 Rumus oh-
Rumus oh- Larutan penyangga pada obat tetes mata
Larutan penyangga pada obat tetes mata Ke dalam larutan basa lemah loh ditambahkan padatan garam
Ke dalam larutan basa lemah loh ditambahkan padatan garam Macam macam larutan penyangga
Macam macam larutan penyangga Buffer adalah
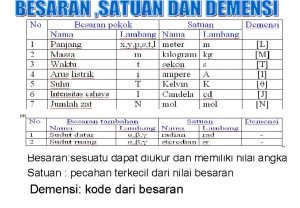
Buffer adalah Sesuatu yang memiliki nilai dan dapat diukur adalah
Sesuatu yang memiliki nilai dan dapat diukur adalah Penyangga kamera berkaki tiga sering disebut
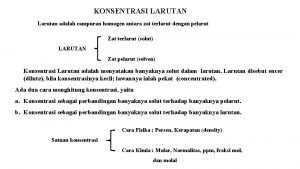
Penyangga kamera berkaki tiga sering disebut Larutan adalah campuran yang
Larutan adalah campuran yang Campuran homogen
Campuran homogen Rumus normalitas
Rumus normalitas Campuran yang menghasilkan garam terhidrolisis sebagian
Campuran yang menghasilkan garam terhidrolisis sebagian Larutan adalah campuran yang
Larutan adalah campuran yang Sifat koligatif
Sifat koligatif Mengapa kita perlu mempertahankan kemerdekaan
Mengapa kita perlu mempertahankan kemerdekaan Setiap benda cenderung untuk mempertahankan
Setiap benda cenderung untuk mempertahankan Etika bisnis dan kewirausahaan
Etika bisnis dan kewirausahaan