Kyseliny Ing Jarmila Kirvejov Cle k se nau


























- Slides: 33

Kyseliny Ing. Jarmila Kirvejová

Cíle: • Žák se naučí : • Rozlišovat pojmy kyselý, zásaditý, neutrální. • Definovat pojem kyselina. • Vyjmenuje nejznámější kyseliny a jejich použití • Zapsat rovnici neutralizace

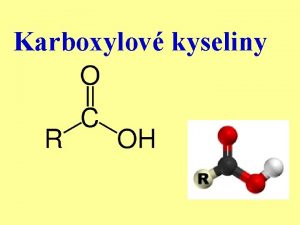
Kyseliny • jsou to sloučeniny, které ve vodných roztocích odštěpují kation vodíku H+ • kation H+ se spojí s molekulou vody a vzniká tzv. oxoniový kation H 3 O+

Co jsou to kyseliny? • Představ si, že si kousneš do citronu. Okamžitě se ti vybaví kyselá chuť. A v čem jsou nakládané kyselé okurky? Kyselina octová (ocet) se používá jak do okurek tak do zálivek na saláty. • A co superkyselé Bompary? Obsahují velké množství kyseliny citronové. • Minerálky, které chutnají příjemně kysele se podle toho nazývají kyselky.

Co jsou to kyseliny? • Ne každá kyselina chutná kysele (nehledě k tomu, že ochutnávání chemikálií je životu nebezpečné). Ukážeme si vhodnější způsoby, jak zjistit, zda je látka kyselá. Protikladem kyselin jsou v chemii zásady.

Určování kyselosti a zásaditosti roztoků • K určování kyselosti nebo zásaditosti roztoků se používají tzv. indikátory (česky ukazatele). • Indikátory jsou látky, které mají jinou barvu v kyselém prostředí a jinou barvu v zásaditém prostředí. Prostředí, které není ani kyselé ani zásadité se nazývá neutrální.

Přírodní indikátor • Lakmus se získává z isladského lišejníku. Má fialovou barvu. V kyselém prostředí zčervená a v zásaditém prostředí zmodrá. Můžeme jej použít jako roztok (přikápneme ho do roztoku) nebo jako lakmusový papírek, který se do roztoku namočí.


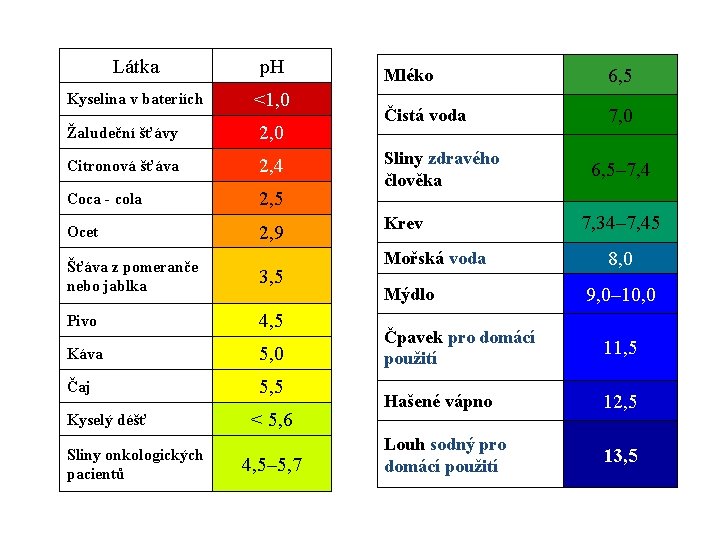
p. H – vodíkový exponent • Vyjádření míry kyselosti (zásaditosti) roztoku – stupnice p. H • p. H = - log [H 3 O+] záporný logaritmus koncentrace vodíkových iontů • 0 --------- 7 ----------->14 • Kyselost zásaditost

Látka p. H Kyselina v bateriích <1, 0 Žaludeční šťávy 2, 0 Citronová šťáva 2, 4 Coca - cola 2, 5 Ocet 2, 9 Šťáva z pomeranče nebo jablka 3, 5 Pivo 4, 5 Káva 5, 0 Čaj 5, 5 Kyselý déšť Sliny onkologických pacientů < 5, 6 4, 5– 5, 7 Mléko 6, 5 Čistá voda 7, 0 Sliny zdravého člověka Krev Mořská voda Mýdlo 6, 5– 7, 4 7, 34– 7, 45 8, 0 9, 0– 10, 0 Čpavek pro domácí použití 11, 5 Hašené vápno 12, 5 Louh sodný pro domácí použití 13, 5

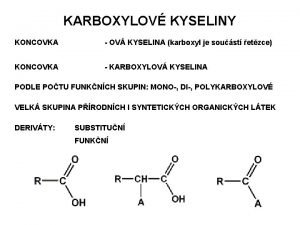
Rozdělení kyselin 1) Bezkyslíkaté kyseliny HCl HBr 2) Kyslíkaté kyseliny H 2 SO 4 HNO 3

Bezkyslíkaté kyseliny • dvouprvkové sloučeniny, které vždy začínají písmenem H (vodík) • prvek na druhém místě dává kyselině název HCl HBr kyselina chlorovodíková kyselina bromovodíková

Bezkyslíkaté kyseliny • molekula je složená z kyselinotvorného prvku a vodíku • halogenvodíkové kyseliny – HF, HCl, HBr, HI • kys. sulfanová (sirovodíková) – H 2 S • kys. kyanovodíková -HCN

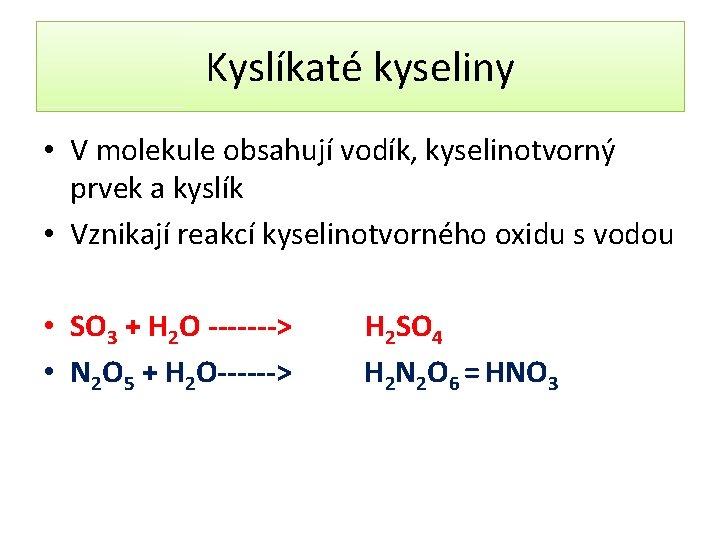
Kyslíkaté kyseliny • tříprvkové sloučeniny • na začátku vzorce je vždy H (vodík), na konci O (kyslík). Uprostřed je značka prvku, který dává kyselině pojmenování H 2 SO 4 kyselina sírová H NO 3 kyselina dusičná

Kyslíkaté kyseliny • V molekule obsahují vodík, kyselinotvorný prvek a kyslík • Vznikají reakcí kyselinotvorného oxidu s vodou • SO 3 + H 2 O -------> • N 2 O 5 + H 2 O------> H 2 SO 4 H 2 N 2 O 6 = HNO 3

Kyselina chlorovodíková HCl kyselina solná • bezbarvá, těkavá kapalina, max. 37%; technická • zbarvena do žluta příměsmi Fe. Cl 3 • 0, 3% obsažena v žaludeční šťávě, kde se podílí na štěpení bílkovin použití: - čištění kovů před letováním - výroba plastů, barviv - v koželužském a potravinářském průmyslu

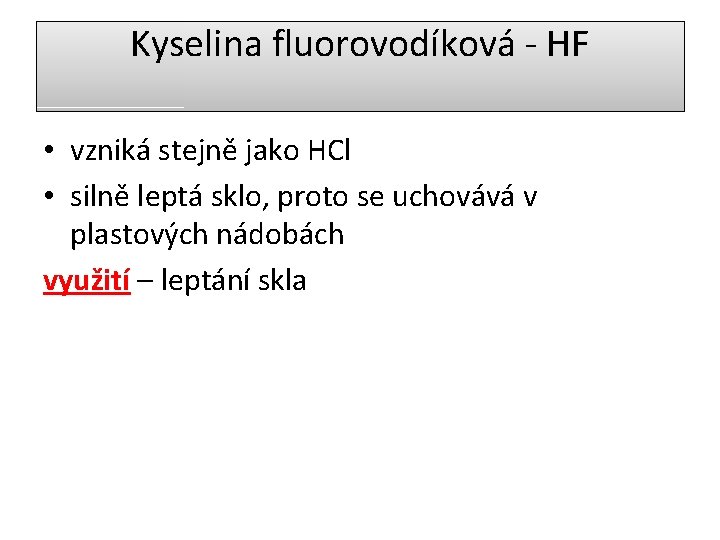
Kyselina fluorovodíková - HF • vzniká stejně jako HCl • silně leptá sklo, proto se uchovává v plastových nádobách využití – leptání skla

Další bezkyslíkaté kyseliny Sirovodíková – sulfanová H 2 S • rozpuštěním sirovodíku v H 2 O Kyanovodíková - HCN • rozpuštěním kyanovodíku v H 2 O • prudce jedovatá • její sloučenina KCN - cyankáli

Kyselina dusičná HNO 3 • bezbarvá kapalina, nestálá na světle (žloutne) • silná žíravina, max. 65% • použití: hnojiva, výbušniny, barviva • dráždí dýchací cesty • soli - dusičnany Použití - výroba barviv - výroba výbušnin - dusíkatá průmyslová hnojiva

Kyselina sírová (H 2 SO 4) • bezbarvá olejovitá kapalina • soli - sírany Použití - výroba chemikálií - průmyslová hnojiva - plasty, barviva, léčiva - výbušniny - čištění ropných produktů - úprava rud

Dehydratační účinky kyseliny sírové • Koncentrovaná kyselina sírová má schopnost odebírat látkám vodu. Všechny organické látky obsahují uhlík. Pokud organické látce odebereme vodu, zčerná (uhlík se vyloučí).

Dehydratační účinky kyseliny sírové

Kyselina fosforečná (H 3 PO 4) • soli - fosforečnany Použití - výroba průmyslových hnojiv - výroba nealkoholických nápojů (minerálky, cola…)

Další kyslíkaté kyseliny Kyselina uhličitá H 2 CO 3 – rozpouštěním CO 2 a H 2 O – snadno se rozkládá – součást perlivých nápojů Kyselina siřičitá H 2 SO 3 – rozpouštěním SO 2 a H 2 O – SO 2 spalováním fosilních paliv, ve vzduchu reaguje s vodou a vytváří kyselé deště

Kyselé deště

Ředění kyselin • Při ředění kyselin se uvolňuje velké množství tepla. • Platí pravidlo KDV – Kyselinu lijeme Do Vody (zamezíme prudkému ohřátí vody a možnému vystříknutí žíravé směsi).

Disociace (ionizace) kyselin Popisuje průběh děje, kdy kyselina ve vodném roztoku odštěpuje vodíkový iont H+. Ze zbytku molekuly se stane anion kyseliny. HCl ------- > H+ + Cl. H 2 SO 4 ----> 2 H 2+ SO 4 -2

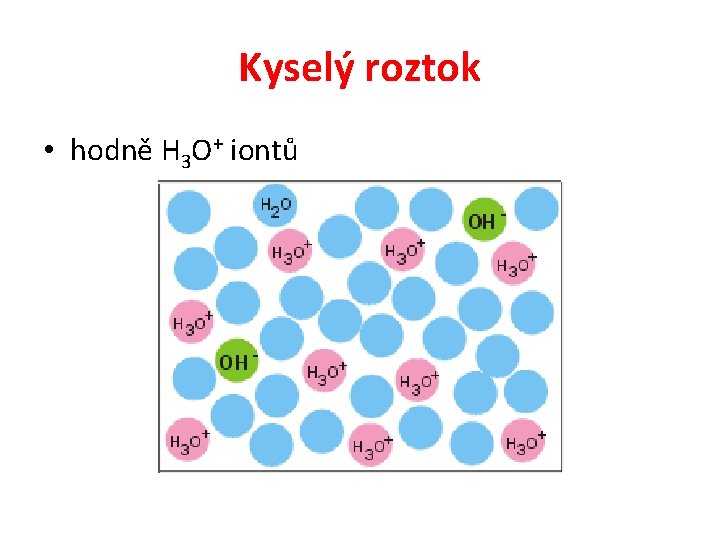
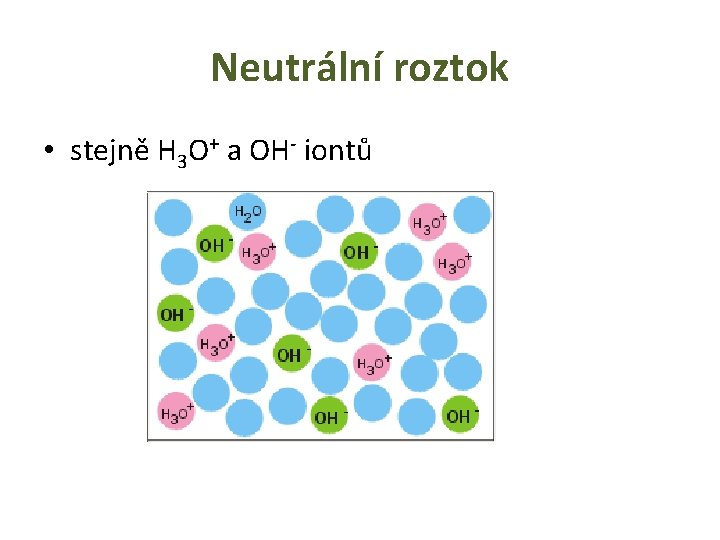
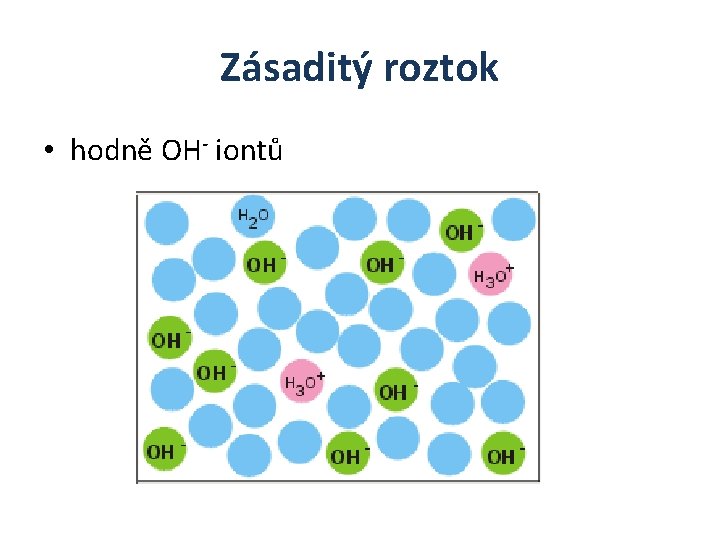
Kyselý, neutrální, zásaditý • Vodíkový (oxóniový) kation způsobuje kyselost roztoku. Čím víc je v roztoku vodíkových kationtů, tím je roztok kyselejší. Naopak anionty OH- způsobují zásaditost roztoku. Pokud je v roztoku více aniontů OHnež kationtů H 3 O+, je roztok zásaditý. Neutrální roztok obsahuje stejný počet H 3 O+ a OH- iontů.

Kyselý roztok • hodně H 3 O+ iontů

Neutrální roztok • stejně H 3 O+ a OH- iontů

Zásaditý roztok • hodně OH- iontů

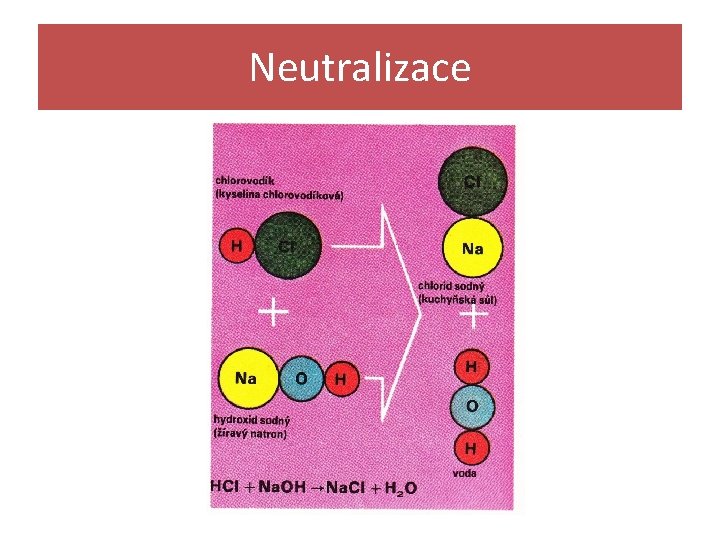
Neutralizace

Pravidla bezpečné práce s kyselinami • 1. Při práci s kyselinami používáme ochranné pomůcky. • 2. Při ředění kyselin se uvolňuje velké množství tepla, proto vždy opatrně přiléváme kyselinu do vody. • 3. Při potřísnění kyselinou postižené místo omýváme proudem tekoucí vody, popřípadě je neutralizujeme roztokem jedlé sody.
 Jarmila gábová
Jarmila gábová škrkavka
škrkavka La prière est la clé du matin et le verrou du soir
La prière est la clé du matin et le verrou du soir Diagramme de classe vers modèle relationnel
Diagramme de classe vers modèle relationnel Sports law cle
Sports law cle Legal research cle
Legal research cle Amarrage lspcc
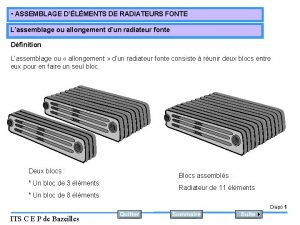
Amarrage lspcc Assemblage radiateur fonte
Assemblage radiateur fonte Nysba cle
Nysba cle 0700800362
0700800362 Greenville bar year end cle
Greenville bar year end cle Hkust pdev
Hkust pdev Hku cle
Hku cle Velk cle
Velk cle Dibujos con fla fle fli flo flu
Dibujos con fla fle fli flo flu Clé bdf
Clé bdf Conversion factor math
Conversion factor math Velk cle
Velk cle Vzorec hmotnostní zlomek
Vzorec hmotnostní zlomek Nukleové kyseliny
Nukleové kyseliny Kyselina siřičitá
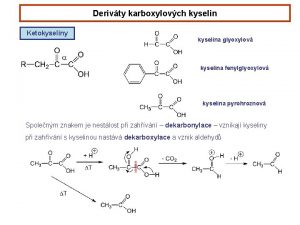
Kyselina siřičitá Glyoxylová kyselina
Glyoxylová kyselina Dietylamid
Dietylamid Hrušková esence vzorec
Hrušková esence vzorec Kyselina dusičita
Kyselina dusičita Methylester methanové kyseliny
Methylester methanové kyseliny Nazvoslovie soli kyselin
Nazvoslovie soli kyselin Název
Název Sloučeniny s obecným vzorcem hxo jsou
Sloučeniny s obecným vzorcem hxo jsou Kyselina octov
Kyselina octov Kyselina chlorovodíková se prodává pod názvem
Kyselina chlorovodíková se prodává pod názvem Site:slidetodoc.com
Site:slidetodoc.com Ph kyseliny
Ph kyseliny Ethanoát
Ethanoát