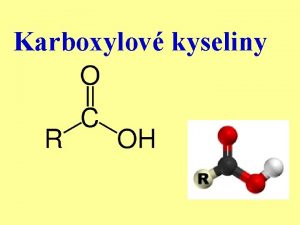
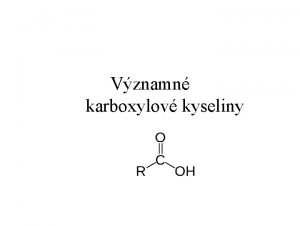Kyseliny a zsady Arrheniova teorie Arrheniova kyselina je





![p. H • p. H = log[H 3 O+] = 10 p. H – p. H • p. H = log[H 3 O+] = 10 p. H –](https://slidetodoc.com/presentation_image_h2/012d672969b0f98328ad17916e818afd/image-8.jpg)









- Slides: 22

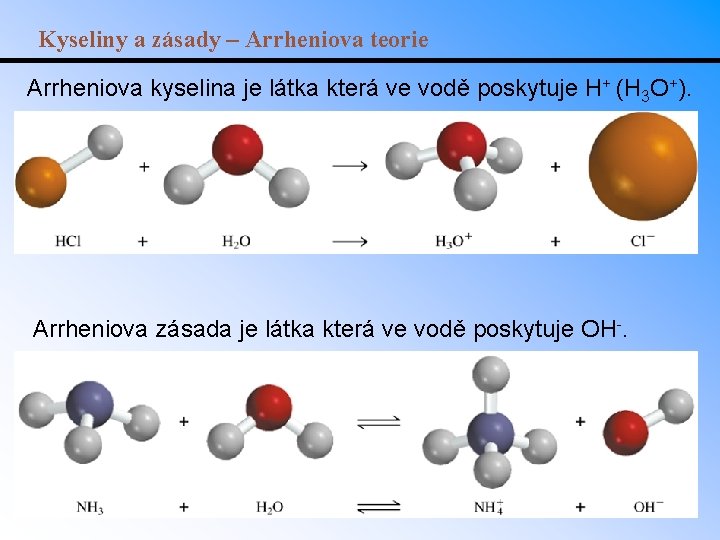
Kyseliny a zásady – Arrheniova teorie Arrheniova kyselina je látka která ve vodě poskytuje H+ (H 3 O+). Arrheniova zásada je látka která ve vodě poskytuje OH-.

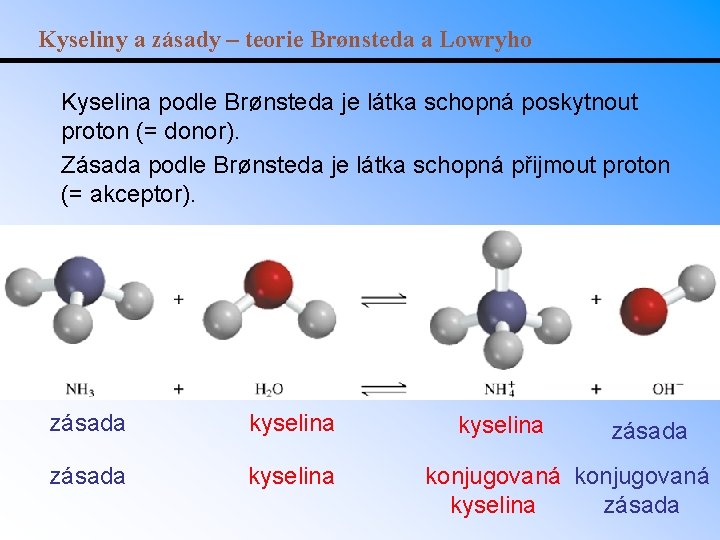
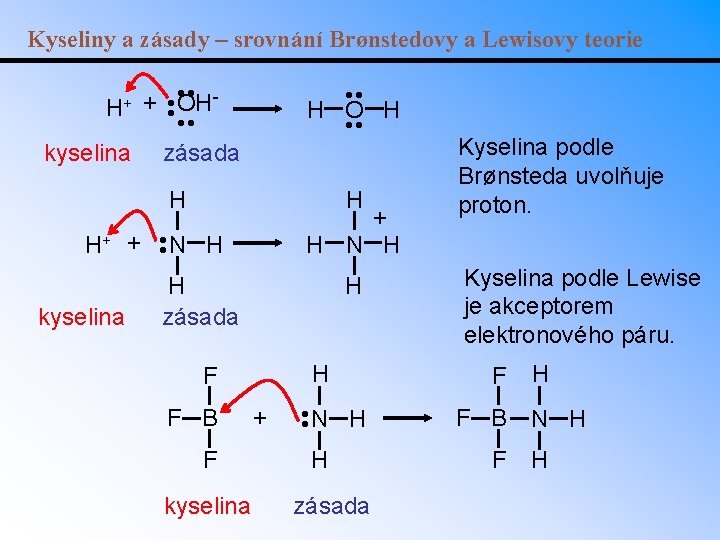
Kyseliny a zásady – teorie Brønsteda a Lowryho Kyselina podle Brønsteda je látka schopná poskytnout proton (= donor). Zásada podle Brønsteda je látka schopná přijmout proton (= akceptor). zásada kyselina zásada konjugovaná kyselina zásada

Konjugované páry • V Brønsted–Lowryho konceptu se zásada mění na svoji konjugovanou kyselinu a naopak, včetně změny acidobazických vlastností. • Př. : Identifikujte každou z následujících částic jako kyselinu nebo jako zásadu a najděte k nim příslušné konjugované částice: , , F , H 2 CO 3, • Amfoterní látky se mohou chovat buď jako kyseliny nebo jako zásady (např. H 2 O):

Síla kyselin a zásad • Stupeň disociace kyseliny na proton a konjugovanou zásadu záleží na relativní síle kyseliny a konjugované zásady: Silné kyseliny a zásady reagují za vzniku slabších konjugovaných zásad/kyselin. Některé běžné silné kyseliny a zásady • Silné kyseliny a zásady reagují (vyměňují proton) prakticky úplně, např. : kyseliny zásady HCl. O 4 Li. OH H 2 SO 4 Na. OH HI KOH HBr Ca(OH)2 HCl Sr(OH)2 HNO 3 Ba(OH)2

Relativní síla kyselina zásad • Z relativní síly kyselin a konjugovaných zásad lze předpovědět směr acidobazické reakce. • Př. : které z následujících částic spolu budou reagovat? HNO 3 + CN- nebo HCN + HF + nebo F- + HNO 3 HCl. O + S 2 - nebo HS- + Cl. O-

Faktory ovlivňující sílu kyselin • Binární kyseliny: – Disociační energie vazby je nepřímo úměrná síle kyseliny. • Disociační energie HI a HBr je nižší než pro HF and HCl, proto jsou HI a HBr silnější kyseliny. • Kyslíkaté kyseliny obsahují v molekule kromě kyslíku centrální atom nekovu, např. HNO 3, HCl. O. . . Síla kyseliny je ovlivňována polaritou vazby O–H: – Vyšší elektronegativita centrálního atomu zvyšuje polaritu vazby O–H a zvyšuje kyselost. – Více kyslíků = vyšší polarita a kyselost. • Př. : Odhadněte relativní kyselost HIO, HBr. O a HCl. O. • Př. : Ověřte tvrzení: HCl. O 4 je nejsilnější kyselina mezi kyslíkatými kyselinami chlóru.

Autoprotolýza vody • Voda reaguje zároveň jako kyselina a jako zásada: H 2 O + H 2 O H 3 O+ + OH. Kw = [OH ][H 3 O+] = 1. 00 x 10 14. • V čisté vodě při pokojové teplotě [OH ] = [H 3 O+] = 1 x 10 7 M (neutrální roztok) – kyselý [H 3 O+] > 1. 00 x 10 7 M – neutrální [H 3 O+] = 1. 00 x 10 7 M – zásaditý [H 3 O+] < 1. 00 x 10 7 M • Ve vodných roztocích kyselin/zásad musí být zachována rovnovážná konstanta autoprotolýzy. Kyseliny/zásady pouze přidávají do vody H 3 O+ nebo OH. • Př. : Koncentrace hydroxoniových iontů v kyselém roztoku byla 1. 00 x 10 5 M. Jaká je koncentrace [OH ]? • Př. : Jaká je koncentrace hydroxoniových iontů v roztoku jednosytného hydroxidu o koncentraci 2. 50 x 10 3 M?
![p H p H logH 3 O 10 p H p. H • p. H = log[H 3 O+] = 10 p. H –](https://slidetodoc.com/presentation_image_h2/012d672969b0f98328ad17916e818afd/image-8.jpg)
p. H • p. H = log[H 3 O+] = 10 p. H – kyselý p. H < 7. 00 – neutrální p. H = 7. 00 – zásaditý p. H > 7. 00 Př. : Určete p. H roztoku kde [H 3 O+] = 5. 40 x 10 6 M. Př. : Určete p. H roztoku kde [OH ] = 3. 33 x 10 3 M. Př. : Určete [H 3 O+] je-li p. H roztoku 7. 35. • Každá veličina p. X je definována stejně jako p. H. Př. : Kolik je p. Ca je-li [Ca 2+] = 6. 44 x 10 -4 M?

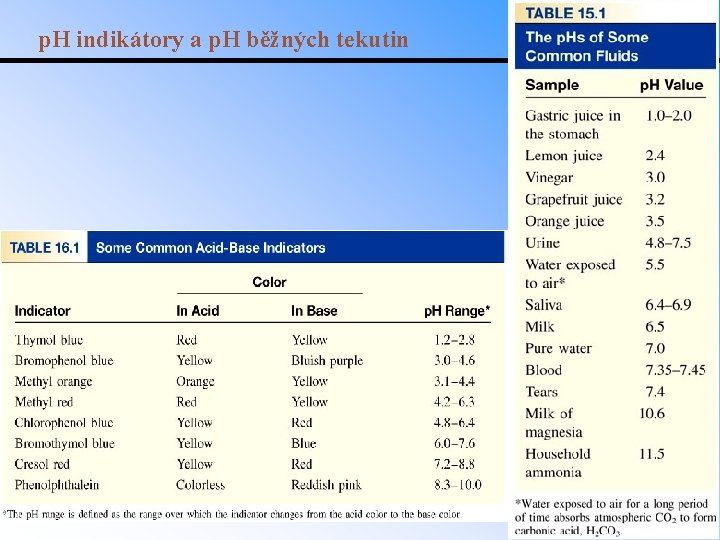
Měření p. H • p. H papírky nasycené sloučeninou která mění barvu v prostředí o různém p. H, pouze indikativní. • Barevné indikátory přidány do roztoku, mění barvu s p. H: HIn(aq) + H 2 O(l) H 3 O+(aq) + In (aq) Př. : fenolftalein je v kyselém prostředí bezbarvý a v zásaditém prostředí růžový. – p. H při kterém dochází ke změně barvy závisí na rovnovážné konstantě disociace indikátoru. • Nejpřesnější měření p. H pomocí p. H metru: kombinace elektrod a voltmetru.

p. H indikátory a p. H běžných tekutin

Silné kyseliny a zásady • Silná kyselina ve vodě kompletně disociuje na [H 3 O+] a příslušný aniont. Př. : Vypočítejte [H 3 O+], [OH ] a [Cl ] pro 0. 048 M roztok HCl. Autoprotolýzu vody zanedbejte. Př. : Vypočítejte koncentraci obou iontů a p. H v roztoku Na. OH o koncentraci 0. 080 M. Př. : Kolik je p. H a [OH ] v 0. 125 M roztoku Ba(OH)2. • Koncentrace H 3 O+ z autoprotolýzy vody je nízká vzhledem k množství H 3 O+ z disociace silné kyseliny a obvykle se ve výpočtech zanedbává. Přesnější postup: – Druhý člen je zanedbatelný kromě případů kdy je koncentrace kyseliny velmi nízká.

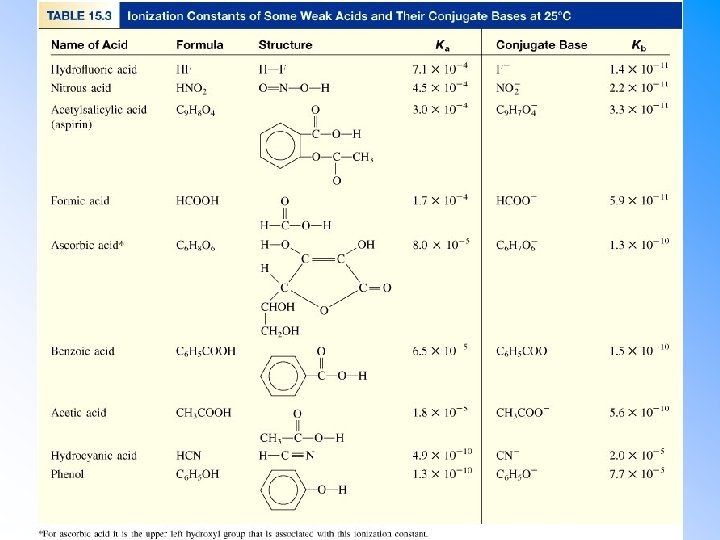
Ionizace slabých kyselin • • • Slabé kyseliny disociují na ionty pouze částečně; stupeň disociace se experimentálně stanovuje nejčastěji měřením elektrické vodivosti. Disociační reakce probíhá do rovnovážného stavu: – Koncentraci hydroxoniového iontu lze určit ze známé rovnovážné konstanty. Relativní sílu slabých kyselin lze stanovit z hodnoty rovnovážné konstanty ionizační reakce. – Vyšší disociační konstanta silnější kyselina – Nižší disociační konstanta slabší kyselina • Př. : Určete která z následujících kyselin je nejsilnější a která nejslabší: kyselina Ka HCN 4. 9 x 10 10 HCOOH 1. 8 x 10 4 CH 3 COOH 1. 8 x 10 5 HF 3. 5 x 10 4

Stupeň ionizace • Stupeň nebo % ionizace jednoduše vyjadřuje sílu kyseliny: – 100% ionizace silná kyselina. – Stupeň ionizace slabých kyselin je nižší než 1 (méně než 100%). • Př. : Určete stupeň ionizace 0. 100 M a 0. 001 M roztoků HCN (Ka = 4. 9 x 10 10). – Řešení: zapsat rovnovážnou konstantu, dosadit z bilance, řešit pro x, výsledek dosadit do výše uvedeného vztahu. – Stupeň ionizace je vyšší u zředěnějších roztoků.

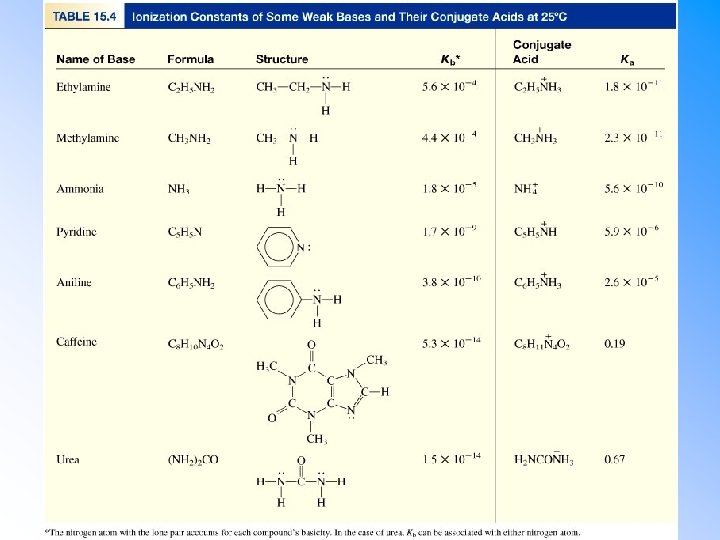
Slabé zásady • • Zachází se s nimi stejně jako se slabými kyselinami, pouze se místo koncentrace protonu počítá [OH ]. Obecná reakce zásad ve vodě: • Stupeň ionizace slabé zásady získáme opět z rovnovážné konstanty ionizační reakce: • Protože CB je obvykle známé, můžeme bilanci dosadit do vztahu pro Kb a získat x. Pozor: x = [OH ], nikoli [H 3 O+]. Př. : Vypočítejte p. H 0. 10 M roztoku NH 3(aq). • •

Dusíkaté báze • Řada sloučenin které obsahují dusík jsou bazické, nejdůležitější skupinou jsou aminy. • Většina aminů má volný elektronový pár který je možné využít pro vazbu s kyselým protonem. • Vodíky v řadě aminů jsou nahrazeny uhlovodíkovými řetězci. R 2 N H R 1

Vztah mezi Ka a Kb • Ka a Kb konjugovaných párů jsou navzájem nepřímo úměrné. HA(aq)+ H 2 O(l) H 3 O (aq)+ A (aq)+ H 2 O(l) HA(aq) +OH (aq) 2 H 2 O(l) Ka = Kb = [ A ][H 3 O + ] [HA][OH ] [A ] H 3 O (aq)+OH (aq) Kw = Ka • Kb + • Nepřímá úměra vysvětluje proč jsou konjugované báze velmi slabých kyselin relativně silné a naopak. • Př. : se znalostí Ka kyselin v tabulce sestavte seznam jejich konjugovaných bází seřazený podle relativní síly. kyselina HF HCOOH HCl. O HCN Ka 3. 5 x 10 4 1. 8 x 10 4 3. 5 x 10 8 4. 9 x 10 10



Vícesytné kyseliny • Některé kyseliny mohou v roztoku odštěpit více protonů, např. dvojsytné kyseliny H 2 S a H 2 SO 4 nebo trojsytná kyselina H 3 PO 4. • První proton se uvolňuje snadno, další mnohem obtížněji. • Rovnovážná konstanta ionizace do 2. stupně je typicky 10 -5 krát menší než první ionizační konstanta. • Př. : Určete p. H 0. 100 M roztoku H 2 SO 3 a koncentraci.

Kyseliny a zásady – Lewisova teorie • Lewisova kyselina: akceptor elektronového páru • Lewisova báze: donor elektronového páru • Lewisova definice je nejobecnější (ve srovnání s teoriemi Brønsteda a Arrhenia). • Př. : Určete Lewisovu kyselinu a bázi v reakci: • Určete Lewisovu kyselinu a bázi v reakci: Co 3+(aq) + 6 F (aq) [Co. F 6]3

Kyseliny a zásady – srovnání Brønstedovy a Lewisovy teorie • • H+ + OH • • kyselina zásada • • H O H • • H H zásada H F F B F kyselina + N H • • kyselina N H • • H+ + + H N H H zásada Kyselina podle Brønsteda uvolňuje proton. Kyselina podle Lewise je akceptorem elektronového páru. F F B F H N H H

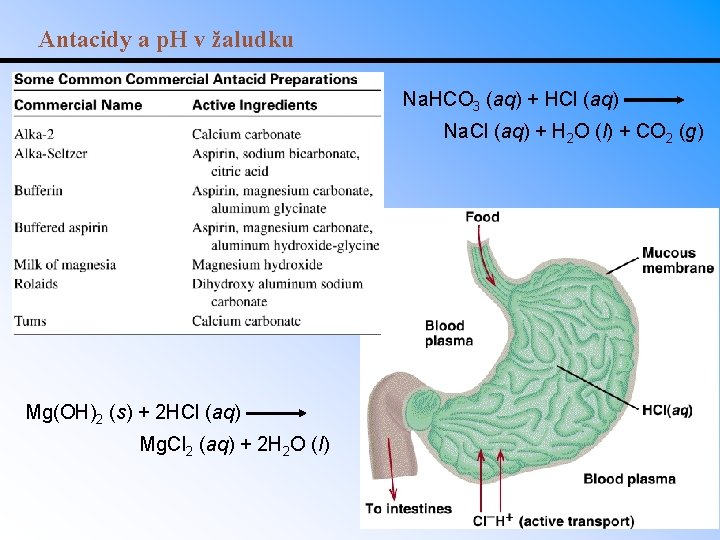
Antacidy a p. H v žaludku Na. HCO 3 (aq) + HCl (aq) Na. Cl (aq) + H 2 O (l) + CO 2 (g) Mg(OH)2 (s) + 2 HCl (aq) Mg. Cl 2 (aq) + 2 H 2 O (l)
 Zsady
Zsady Zsady
Zsady Zsady
Zsady Zsady
Zsady Arrheniova rovnice
Arrheniova rovnice Fickov zakon
Fickov zakon Bezkyslíkaté kyseliny prezentace
Bezkyslíkaté kyseliny prezentace Kyseliny vzorce
Kyseliny vzorce Koncentrace kyseliny octové v octu
Koncentrace kyseliny octové v octu Kyselina selenovodíková vzorec
Kyselina selenovodíková vzorec Kyseliny vzorce
Kyseliny vzorce Nukleové kyseliny
Nukleové kyseliny Kyseliny
Kyseliny Bezkyslíkaté kyseliny
Bezkyslíkaté kyseliny Koncentrace kyseliny octové v octu
Koncentrace kyseliny octové v octu Bezkyslíkaté kyseliny
Bezkyslíkaté kyseliny Ester kyseliny akrylové
Ester kyseliny akrylové Etylester kyseliny propanovej
Etylester kyseliny propanovej Koncentrace kyseliny octové v octu
Koncentrace kyseliny octové v octu Soli kyseliny chlorovodíkovej
Soli kyseliny chlorovodíkovej Cyklopentankarboxamid
Cyklopentankarboxamid Nukleové kyseliny
Nukleové kyseliny Ve 100g vody bylo rozpuštěno 30g kyseliny octové
Ve 100g vody bylo rozpuštěno 30g kyseliny octové