ZKLADN KOLA ST NAD LABEM ANEKY ESK 70217

ZÁKLADNÍ ŠKOLA ÚSTÍ NAD LABEM, ANEŽKY ČESKÉ 702/17, PŘÍSPĚVKOVÁ ORGANIZACE ČÍSLO PROJEKTU: CZ. 1. 07/1. 4. 00/21. 2887 NÁZEV PROJEKTU: „UČÍME LÉPE A MODERNĚJI“ OP VK 1. 4 VÝUKOVÝ MATERIÁL Název DUMu: VY_52_INOVACE_04_3_KYSELINY Číslo skupiny: 2 Autor: Ing. Stanislava Kolářová Vzdělávací oblast/Předmět/Téma: ČLOVĚK A PŘÍRODA / CHEMIE / KYSELINY Druh učebního materiálu: PREZENTACE Metodický list: NE Anotace: Seznámení s kyselinami a zákonitostmi jejich tvoření pomocí prezentace. Připomenutí zásad bezpečnosti práce s kyselinami, dělení kyselin na kyslíkaté a bezkyslíkaté a odvození jejich názvosloví – včetně procvičení. Ověřeno ve třídě: 9. A Datum ověření: 29. 9. 2011 Prohlášení: Prohlašuji, že při tvorbě výukového materiálu jsem respektoval(a) všeobecně užívané právní a morální zvyklosti, autorská a jiná práva třetích osob, zejména práva duševního vlastnictví (např. práva k obchodní firmě, autorská práva k software, k filmovým, hudebníma fotografickým dílům nebo práva k ochranným známkám)dle zákona 121/2000 Sb. (autorský zákon). Nesu veškerou právní odpovědnost za obsah a původ svého díla. Prohlašuji dále, že výše uvedený materiál jsem ověřil(a) ve výuce a provedl(a) o tom zápis do TK. Dávám souhlas, aby moje dílo bylo dáno k dispozici veřejnosti k účelům volného užití (§ 30 odst. 1 zákona 121/2000 Sb. ), tj. že k uvedeným účelům může být kýmkoliv zveřejňováno, používáno, upravováno a uchováváno. Datum: 29. 9. 2011 Podpis:

KYSELINY

ZÁPIS DO SEŠITU KYSELINY: � podle složení dělíme na kyslíkaté a bezkyslíkaté + které ve vodných roztocích odštěpují kation vodíku H � sloučeniny, + H se spojí s+molekulou vody a vzniká tzv. oxoniový kation H 3 O � kation Ředění kyselin • přiléváme kyselinu do vody, nikoli naopak

PRVNÍ POMOC PŘI ZASAŽENÍ KYSELINOU: � při práci se silnými kyselinami nutné používat ochranné pomůcky (ochranný obličejový štít nebo brýle, pryžové rukavice, laboratorní plášť, uzavřená obuv) � při potřísnění pokožky nahlásit vyučujícímu a postupovat dle jeho pokynů (. . . otřít suchou látkou a bez prodlení oplachovat pod proudem čisté vody)

ORIENTAČNÍ URČENÍ SÍLY KYSELINY Velmi slabá kyselina Hn. XOn • Slabá kyselina Hn. XOn+1 • Silná kyselina Hn. XOn+2 Velmi silná kyselina Hn. XOn+3 • •
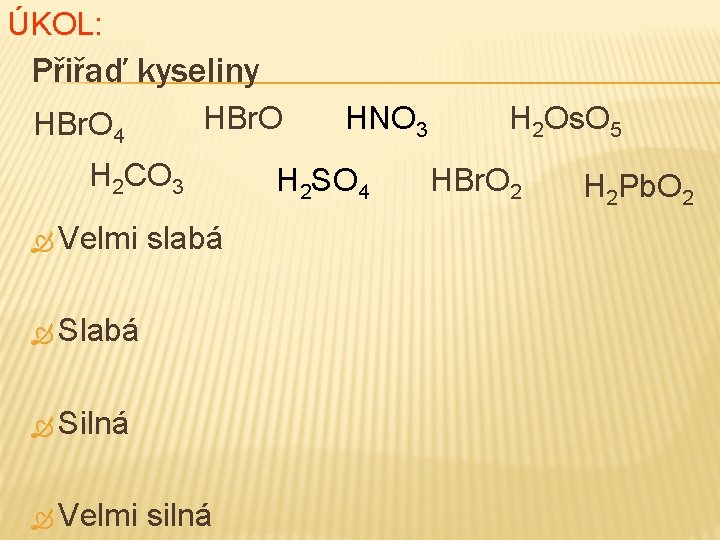
ÚKOL: Přiřaď kyseliny HBr. O 4 H 2 CO 3 Velmi slabá Silná Velmi silná HNO 3 H 2 SO 4 H 2 Os. O 5 HBr. O 2 H 2 Pb. O 2

Bezkyslíkaté kyseliny: Mezi nejznámější bezkyslíkaté kyseliny patří dvouprvkové sloučeniny vodíku s halogenem. Název se skládá ze dvou slov - kyselina a z názvu sloučeniny halogenu s vodíkem a zakončení - ová Kyseliny HCl HBr HI HCN H 2 Se H 2 Te HSCN Aniont kyseliny v soli chlorovodíková Cl chlorid bromovodíková Br bromid jodovodíková Ijodid kyanovodíková CN kyanid selenovodíková Se 2 - selenid tellurovodíková Te 2 - tellurid thiokyanatá SCN- rodanid, thiokyanatan

KYSLÍKATÉ KYSELINY � Vodík HIm. XO-IIn má v kyselinách oxidační číslo I � Kyslík má v kyselinách oxidační číslo –II � celková hodnota molekuly je 0

OXIDAČNÍ ČÍSLO KONCOVKA VZOREC � � � � I II IV V VI VII NÁZEV - ná bromná HBr. O - natá olovnatá H 2 Pb. O 2 - itá bromitá HBr. O 2 - ičitáuhličitá H 2 CO 3 - ičná dusičná HNO 3 - ečná fosforečná HPO 3 - ová sírová H 2 SO 4 - istá bromistá HBr. O 4 - ičelá osmičelá H 2 Os. O 5

Příklad: Urči název H 2 SO 4 1. Doplníme známá oxidační čísla HI 2 SO-II 4 2. Dopočítáme oxidační číslo kyselinotvorného prvku 2*I + 4*-II = -6 …hledané oxidační číslo je tedy VI 3. Název odvodíme od kyselinotvorného prvku a koncovku podle dopočítaného oxidačního čísla prvku Kyselinotvorným prvkem je SÍRA, s koncovkou -ová … hledaný název je kyselina sírová

ÚKOL: urči oxidační čísla: H 2 SO 3 HFe. O 2 HNO HCr. O 4 Ř

Příklad: Urči vzorec kyseliny dusičné 1. Napíšeme značky známých prvků ve správném pořadí (z názvu poznáme, že jde o kyselinu kyslíkatou) HNO 2. napíšeme k prvkům oxidační čísla HINVO-II 3. vzorec dotvoříme dopočítáním do nulové hodnoty (1*I + V*1)/2 …k atomu kyslíku přidáme 3 --> 1*I + V*1 + (-II *3) = 0 výsledný vzorec: HNO 3

ÚKOL: vytvoř vzorce a oxidační čísla těchto kyselin: chlorovodíková fosforečná (trihydrogenfosforečná) hořečnatá osmičelá Ř

ŘEŠENÍ ÚKOLU: Přiřaď kyseliny H 2 Pb. O 2 HBr. O Slabá HBr. O 2 H 2 CO 3 Silná HNO 3 H 2 SO 4 H 2 Os. O 5 HBr. O 4 Velmi slabá silná

ŘEŠENÍ ÚKOLU: URČI NÁZVY kyslíkatých KYSELIN: � HI 2 SIVO-II 3 KYSELINA SIŘIČITÁ � HIFe. IIIO-II 2 KYSELINA ŽELEZITÁ � HINIO-II KYSELINA DUSNÁ � HICr. VIIO-II 4 KYSELINA CHROMISTÁ zpět

ŘEŠENÍ ÚKOLU: vytvoř vzorce těchto kyselin: � chlorovodíková HICl-I. . . bezkyslíkatá kyselina � fosforečná (trihydrogenfosforečná) HI 3 PVO-II 4 � hořečnatá HI 2 Mg. IIO-II 2 � osmičelá HI 2 Os. VIIIO-II 5 zpět

CITACE Autorem materiálu a všech jeho částí, není-li uvedeno jinak, je Ing. Stanislava Kolářová.
- Slides: 17