KYSELINY Jsou to ltky kter se ve vod















- Slides: 15

KYSELINY Jsou to látky, které se ve vodě štěpí na kationty H+ a anionty (radikály) kyseliny (např. Cl-, NO 3 -, SO 42 -). 1) BEZKYSLÍKATÉ KYSELINY: (koncovka -vodíková) Kyselina fluorovodíková chlorovodíková bromovodíková jodovodíková sirovodíková kyanovodíková Vzorec HF HCl HBr HI H 2 S HCN Vznikají rozpuštěním některých binárních sloučenin s vodíkem ve vodě.

SOLI BEZKYSLÍKATÝCH KYSELIN – koncovka ID kyselina fluorovodíková chlorovodíková bromovodíková jodovodíková sirovodíková kyanovodíková vzorec kys. HF HCl HBr HI H 2 S HCN název soli fluorid chlorid bromid jodid sulfid kyanid Sůl z kyseliny vznikne tak, že se odštěpí kationty vodíku a nahradí se jiným kationtem

Příklady k napsání vzorců: Fluorid zinečnatý (fluor – F, zinek - Zn) Chlorid fosforečný (chlor – Cl, fosfor - P) Sulfid cíničitý (síra – S, cín - Sn) Kyanid draselný (draslík – K) Příklady k pojmenování: Ca. Cl 2 (Ca – vápník, Cl – chlor) Pbl 2 (Pb – olovo, I - jód) Na. CN (Na – sodík) Fe 2 S 3 (Fe – železo, S – síra) Zn. F 2 PCl 5 Sn. S 2 KCN Chlorid vápenatý Jodid olovnatý Kyanid sodný Sulfid železitý

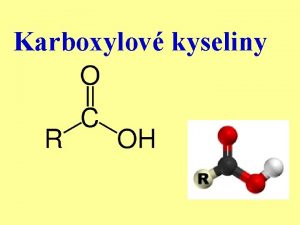
2) KYSLÍKATÉ KYSELINY (OXOKYSELINY) VZNIKAJÍ reakcí: a) oxidů nekovů a polokovů s vodou Př. : SO 2 + H 2 O = H 2 SO 3 nebo b) oxidů kovů s vyšším oxidačním číslem (V a víc) s H 2 O Př. : Mn 2 O 7 + H 2 O = 2 HMn. O 4 Mají obecný VZOREC : H m. Z x. O y kde vodík má ox. číslo +I, kyslík má –II. Z je kyselinotvorný prvek a může mít ox. číslo I až VIII

VZOREC lze utvořit 3 způsoby: a) z chemické rovnice pro vznik kyseliny, tj. : příslušný oxid + H 2 O = kyselina b) analogií se známou kyselinou c) pomocí rovnice pro oxid. číslo Příklady k napsání vzorců: Kyselina dusitá (dusík - N) Kyselina dusičná (dusík - N) Kyselina siřičitá (síra – S) Kyselina chromová (chrom - Cr) HNO 2 HNO 3 H 2 SO 3 H 2 Cr. O 4

Ø OXOKYSELINY s 1 ATOMEM prvku Z ox. koncov vzorec č. Z ka příklad kyseliny +I -ná HZO +II -natá H 2 ZO 2 H 2 Sn. O 2 kys. cínatá cínatan +III -itá HZO 2 kys. dusitá dusitan +IV -ičitá H 2 ZO 3 H 2 CO 3 kys. uhličitá uhličitan kys. dusičná dusičnan síran +V -e(i)čná HZO 3 HCl. O HNO 2 HNO 3 kys. chlorná její sůl chlornan +VI -ová H 2 ZO 4 H 2 SO 4 kys. sírová +VII -istá HZO 4 kys. chloristá chloristan HCl. O 4

NÁZEV lze získat 2 způsoby: a) pomocí rovnice pro oxid. číslo b) analogií se známou kyselinou se stejnými stech. koeficienty Příklady k napsání názvů: HCl. O 3 (Cl - chlor) Kyselina chlorečná H 2 CO 3 (C - uhlík) Kyselina uhličitá HPO 3 (P - fosfor) Kyselina fosforečná H 3 PO 4 (P - fosfor) ?

Má – li kyselina více vodíkových atomů než 2 MUSÍ BÝT V NÁZVU UVEDEN JEJICH POČET Někdy OXID reaguje s VÍCE MOLEKULAMI H 2 O, Př. P 2 O 5 + H 2 O = 2 HPO 3 kys. hydrogenfosforečná P 2 O 5 + 3 H 2 O = 2 H 3 PO 4 kys. trihydrogenfosforečná Pozn. : Vodík je HYDROGENIUM a číslovky: mono (nepoužívá se), di, tri, tetra, penta. . Př. : Pojmenuj H 5 IO 6 vzorec H 5 IO 6 je kyselina pentahydrogen jodistá

Ø OXOKYSELINY s VÍCE ATOMY prvku Z, v názvu kyseliny pak musí být uveden i počet atomů Z. Příklady k napsání vzorců: Kyselina disírová (síra - S) Kyselina disiřičitá (síra – S) H 2 S 2 O 7 H 2 S 2 O 5 Příklady k napsání názvů: H 2 Cr 2 O 7 (Cr - chrom) Kyselina dichromová

SOLI KYSLÍKATÝCH KYSELIN koncovka -AN Vznikají náhradou vodíku v kyselině kovem či amonnou skupinou (např. neutralizací). Neutralizace – reakce mezi kyselinou a zásadou za vzniku soli a vody: Př. : H 2 SO 4 + Ca(OH)2 = Ca. SO 4 + 2 H 2 O , kde Ca. SO 4 je sůl - síran sodný a (SO 4)-II je zbytek kys. (radikál) Radikál vystupuje v reakcích pohromadě, proto jeho název tvoří 1 slovo. Názvosloví solí se pak tvoří jako názvosloví binárních sloučenin (podst. jm. – naučit se + příd. jm. - umíme)

Soli kyslíkatých kyselin Příklady k napsání vzorců: Dusičnan draselný Uhličitan hlinitý Síran vápenatý Manganistan draselný Příklady k napsání názvů: K 2 SO 3 Fe 2(SO 4)3 NH 4 PO 3 (NH 4)3 PO 4

Ø HYDROGENSOLI VZNIK: všechny atomy H v kyselině nejsou nahraženy. V NÁZVU hydrogensoli je uvedený počet nenahražených H. Pozn. : názvosloví tvoříme jako u solí. Př. Utvoř název ke vzorci Ca(HSO 4)2 Výsledek: Ca(HSO 4)2 je hydrogensíran vápenatý.

Př. : Utvoř vzorec k názvu hydrogenuhličitan železitý. Hydrogenuhličitan železitý má vzorec Fe(HCO 3)3 Př. : Utvoř vzorec k názvu hydrogenfosforečnan vápenatý. Pozn. : Jako zákl. kyselinu nelze použít HPO 3, 1 atom H je nutno nechat v soli a aspoň 1 atom H použít k náhradě za Ca. HPO 3 má ale celkem jen 1 atom H. Kyselinu s větším počtem vodíkových atomů získáme přičtením molekuly vody: HPO 3 + H 2 O = H 3 PO 4 Hydrogenfosforečnan vápenatý má vzorec Ca. HPO 4.

Sami: vytvořte vzorec: dihydrogenfosforečnan draselný (KH 2 PO 4)