Kristal ve amorf katlar Katlar kristal ve amorf




























- Slides: 41

Kristal ve amorf katılar Katılar, kristal ve amorf olabilirler. Kristal katılarda atom, iyon veya moleküller düzenli bir şekilde sıralanmıştır. Tuz ve şeker bu tür kristal katılara örnek olarak verilebilirler. Amorf katılarda ise, atom, iyon veya moleküller rastgele yığılmışlardır. Örneğin, tereyağ, lâstik, cam, plâstiklerde olduğu gibi.

Kristal katılar ile amorf katılar arasında gözlenen en önemli ayrıcalıklardan biri de, kristal olanların sabit sıcaklıkta erimeleri, amorf olanların ise belli bir sıcaklık aralığında gitgide yumuşayarak akıcılık kazanmalarıdır. Katıyı oluşturan taneciklerin belirli bir düzenle üç boyutlu olarak dizilmesiyle meydana gelen yapıya "kristal örgüsü“ adı verilir. Bir kristalin tüm özelliklerini gösteren en küçük parçasına da "birim hücre" denir.

Kristal yapının belirlenmesinde, (yani kristaldeki atom, iyon ya da moleküllerin nasıl istiflendiğini görmek için), X- ışını kırınımı yönteminden yararlanılır. X- Işını kırınımı, X- ışınının kristal yapıdaki atomların elektronları ile etkileşmesi ve ışın demetinin yeniden yayılması veya saçılmasıdır.



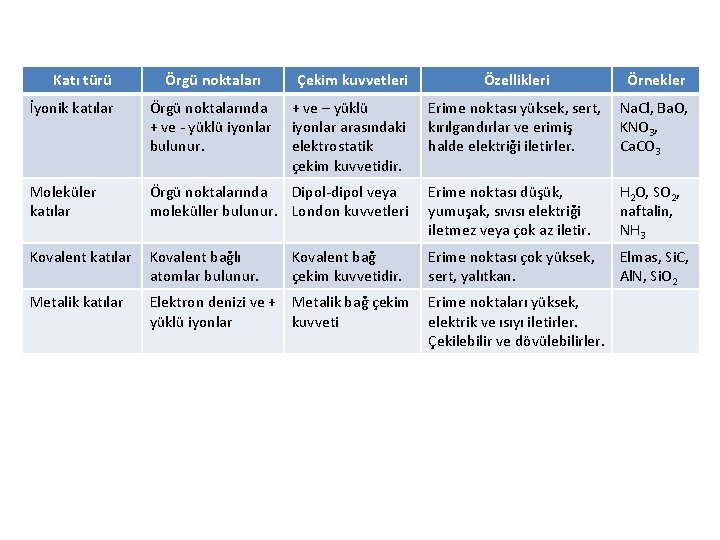
• Kristallerin yapıları ve özellikleri (örneğin, erime noktası, yoğunluk ve sertlik) tanecikleri (atom, iyon ve molekülleri) birarada tutan kuvvetlerin çeşitlerine • göre belirlenir. Kristalleri dört tür olarak sınıflandırabiliriz: • �� Moleküler katılar • �� Metalik katılar • �� İyonik katılar • �� Kovalent ağlı katılar

Katı türü Örgü noktaları Çekim kuvvetleri Özellikleri Örnekler İyonik katılar Örgü noktalarında + ve - yüklü iyonlar bulunur. + ve – yüklü iyonlar arasındaki elektrostatik çekim kuvvetidir. Erime noktası yüksek, sert, kırılgandırlar ve erimiş halde elektriği iletirler. Na. Cl, Ba. O, KNO 3, Ca. CO 3 Moleküler katılar Örgü noktalarında Dipol-dipol veya moleküller bulunur. London kuvvetleri Erime noktası düşük, yumuşak, sıvısı elektriği iletmez veya çok az iletir. H 2 O, SO 2, naftalin, NH 3 Kovalent katılar Kovalent bağlı atomlar bulunur. Erime noktası çok yüksek, sert, yalıtkan. Elmas, Si. C, Al. N, Si. O 2 Metalik katılar Elektron denizi ve + Metalik bağ çekim yüklü iyonlar kuvveti Kovalent bağ çekim kuvvetidir. Erime noktaları yüksek, elektrik ve ısıyı iletirler. Çekilebilir ve dövülebilirler.

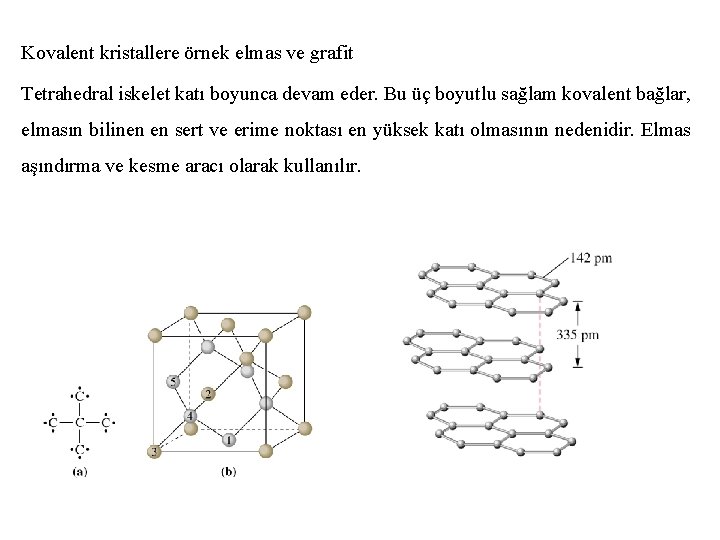
Kovalent kristallere örnek elmas ve grafit Tetrahedral iskelet katı boyunca devam eder. Bu üç boyutlu sağlam kovalent bağlar, elmasın bilinen en sert ve erime noktası en yüksek katı olmasının nedenidir. Elmas aşındırma ve kesme aracı olarak kullanılır.

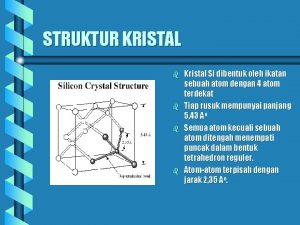
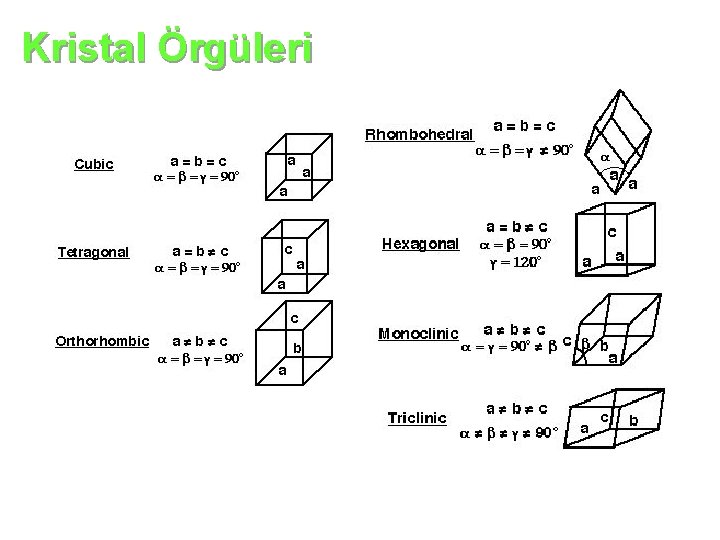
Kristal Örgüler: Kristal katılarda, tanecikler kristal örgüsü içinde belirli bir geometrik şekle göre istiflenirler. Kristal örgüsünün en küçük birimine birim hücre denir. Birim hücrelerin üç boyutlu olarak yana gelmesiyle katının kristali oluşur. Kristal örgülere Bravais örgüleri denir. Kristal örgüleri, birim hücrenin üç kenar uzunluğu ve kenarları arasındaki açılarla tanımlanır.

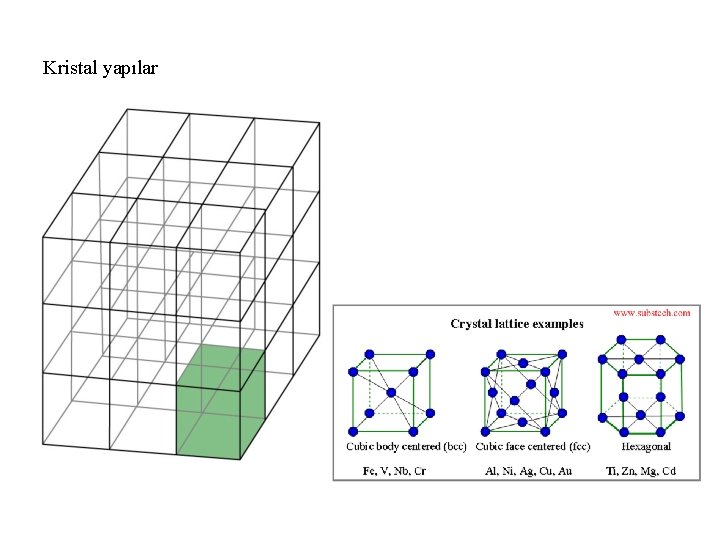
Kristal yapılar

Kristal Örgüleri



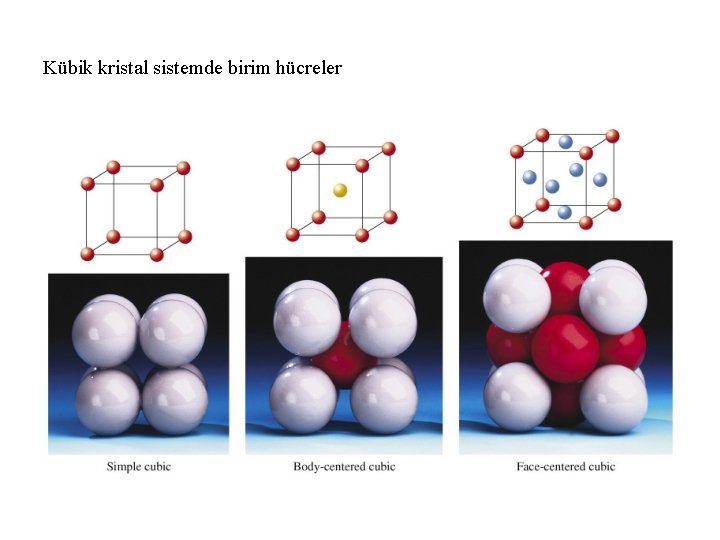
Kübik kristal sistemde birim hücreler

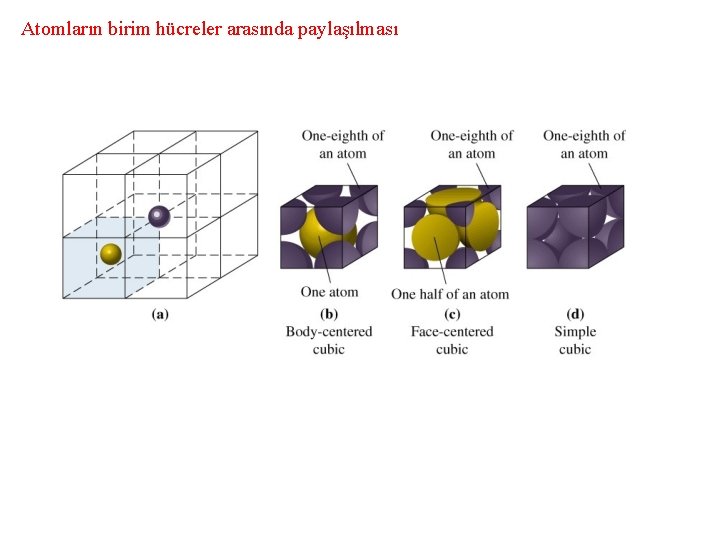
Atomların birim hücreler arasında paylaşılması

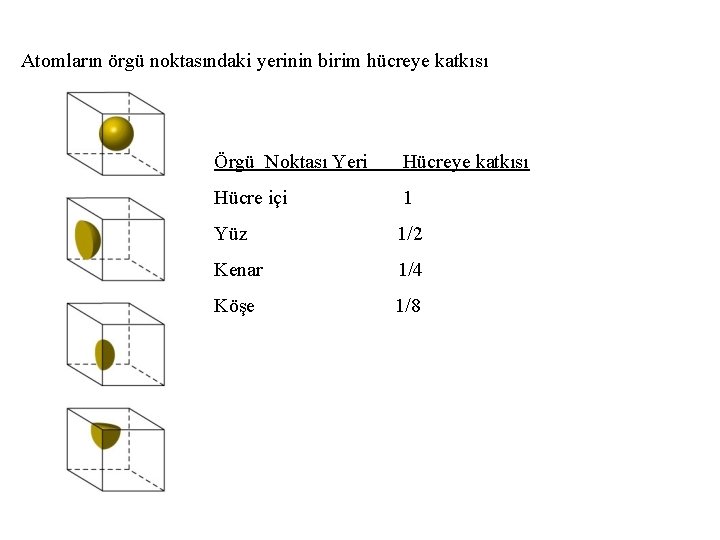
Atomların örgü noktasındaki yerinin birim hücreye katkısı Örgü Noktası Yeri Hücreye katkısı Hücre içi 1 Yüz 1/2 Kenar 1/4 Köşe 1/8

Birim hücredeki atom sayısı Basit kübik sistem (1 atom) Hacim merkezli kübik sistem (2 atom) Yüzey merkezli kübik sistem ( 4 atom)

Örnek: Vanadyum hacim merkezli kübik yapıda kristalleşir. Birim hücrenin bir kenarı 305 pm olduğuna göre vanadyumun yoğunluğu nedir?

1 pm = 1 x 10 -10 cm olduğundan 305 pm = 3, 05 x 10 -8 cm olur. Bir birim hücrenin hacmi, küp olduğundan , a 3 şeklinde hesaplanır, (3, 05 x 10 -8 cm)3 = 2, 83 x 10 -23 cm 3 olur. Birim hücre hacim merkezli olduğundan, 2 atom içerir. 1 cm 3 hacimde kaç atom olduğunu bulalım. 2 atom 2, 83 x 10 -23 cm 3 ise ? atom 1 cm 3 hacimde ? = 0, 707 x 1023 atom. 6. 02 x 023 atom 50, 09 g ise, 0, 707 x 1023 atom ? kaç gramdır? ? = 5, 88 g/cm 3

Örnek: Ksenon (131. 3 g/mol) yüzey merkezli kübik bir örgüde kristallenir. Birim hücrenin bir kenarı 620 pm olduğuna göre kristal ksenonun yoğunluğu nedir?

1 pm = 1 x 10 -10 cm olduğundan 620 pm = 6. 20 x 10 -8 cm olur. Bir birim hücrenin hacmi, küp olduğundan , a 3 şeklinde hesaplanır, (6. 20 x 10 -8 cm)3 = 2. 38 x 10 -22 cm 3 olur. Birim hücre yüzey merkezli olduğundan, 4 atom içerir. 1 cm 3 hacimde kaç atom olduğunu bulalım. 4 atom 2. 38 x 10 -22 cm 3 ise ? atom 1 cm 3 hacimde x = 1. 68 x 1022 atom. 6. 02 x 023 atom 1. 68 x 1022 atom ? = 3. 66 g/cm 3 131. 3 g ise, ? gramdır

Örnek: Nikel yüzey merkezli kübik bir yapıda kristallenir. Bir birim hücrenin bir kenarı 352 pm dir. Nikelin atom ağırlığı 58, 7 ve yoğunluğu, 8, 94 g/cm 3 olduğuna göre Avogadro sayısını hesaplayınız.

1 pm = 1 x 10 -10 cm olduğundan 352 pm = 3. 52 x 10 -8 cm olur. Bir birim hücrenin hacmi, küp olduğundan , a 3 şeklinde hesaplanır, (3. 52 x 10 -8 cm)3 = 4. 36 x 10 -23 cm 3 olur. Birim hücre yüzey merkezli olduğundan, 4 atom içerir. Bir atomun hacmi ise, = 4. 36 x 10 -23 cm 3/4 = 1. 09 x 10 -23 cm 3 bulunur. Yoğunluğun tanımına göre 1 cm 3 nikel 8. 94 g gelir. 58. 7 g nikelin hacmi ise basit bir orantıyla 6. 57 cm 3 olarak bulunabilir. Bu hacimde bulunan atom sayısı, = 6. 57 cm 3/1. 09 x 10 -23 = 6. 02 x 1023 atom olarak bulunur.

Örnek: Platin yüzey merkezli kübik bir yapıda kristallenir. Bir birim hücrenin bir kenarı 392 pm dir. Platinin yoğunluğu 21, 5 g/cm 3 olduğuna göre atom ağırlığını hesaplayınız.

1 pm = 1 x 10 -10 cm olduğundan 392 pm = 3, 92 x 10 -8 cm olur. Bir birim hücrenin hacmi, küp olduğundan , a 3 şeklinde hesaplanır, (3, 92 x 10 -8 cm)3 = 6, 02 x 10 -23 cm 3 olur. Birim hücre yüzey merkezli olduğundan 4 atom bulunur 4 atom 6, 02 x 10 -23 cm 3 ise ? atom 1 cm 3 hacimde x = 6, 64 x 1022 atom. 6, 64 x 022 atom 21, 5 g ise, 6, 02 x 1023 atom ? gramdır ? = 194, 92 g (6, 02 x 1023 atom = 1 mol)

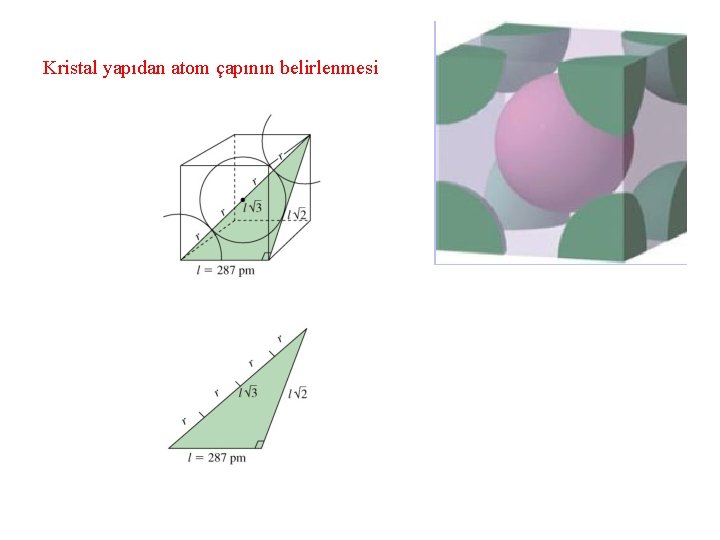
Kristal yapıdan atom çapının belirlenmesi

Örnek: Demir Hacim merkezli kübik bir yapıda kristallenir. Bir birim hücrenin bir kenarı 287 pm olarak bulunmuştur. Demirin atom çapı nedir?


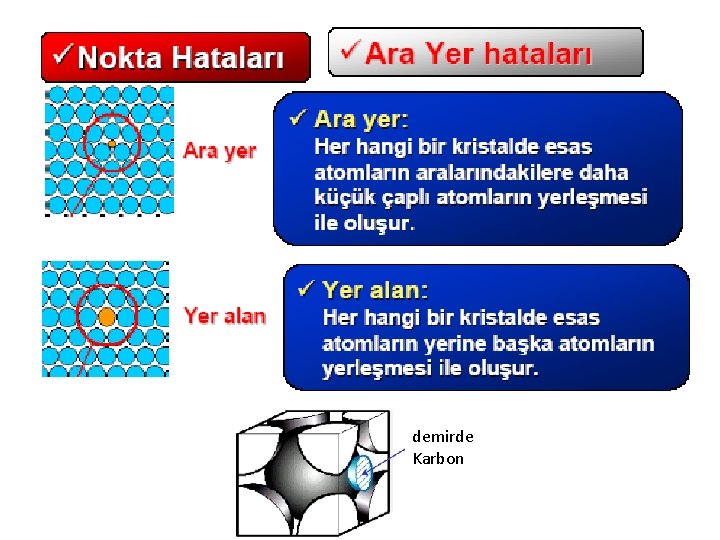
Kristal kusurları : Gerçek kristaller insanlar gibidir ve asla mükemmel değillerdir. Daima kusurları vardır. Fakat bu kusurlar bazen, düşünülenin aksine bir katının çok faydalı işlevleri kazanmasına da neden olabilir.



demirde Karbon


Eksik atom düzlemleri



İç yada hacim kusurları

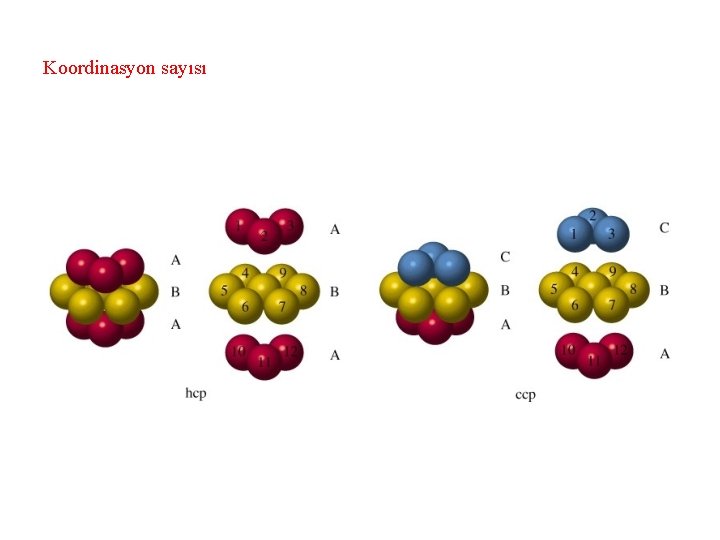
Koordinasyon sayısı

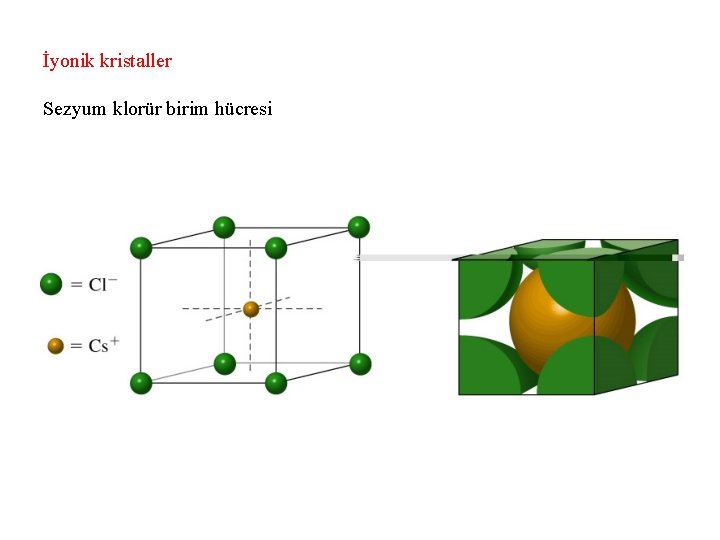
İyonik kristaller Sezyum klorür birim hücresi

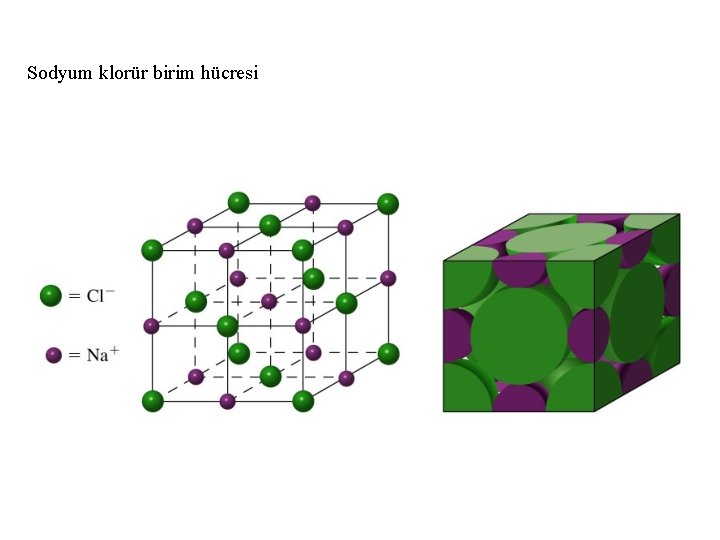
Sodyum klorür birim hücresi

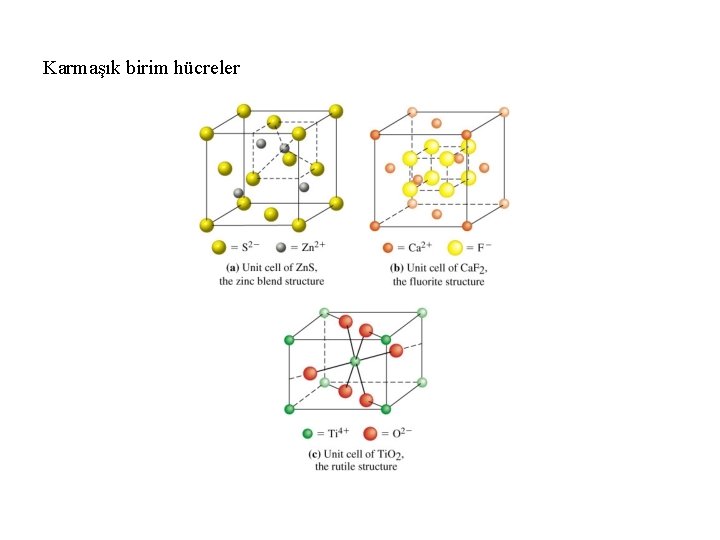
Karmaşık birim hücreler
 Kristalografik anizotropi
Kristalografik anizotropi Amorf zout urine
Amorf zout urine Losse gesteenten
Losse gesteenten Amorf fosfat kristalleri
Amorf fosfat kristalleri Amorf katılar
Amorf katılar Klinast kristal
Klinast kristal Contoh mineral triklin
Contoh mineral triklin Kisi dan basis
Kisi dan basis Kumpulan tetesan air
Kumpulan tetesan air Kristal yap
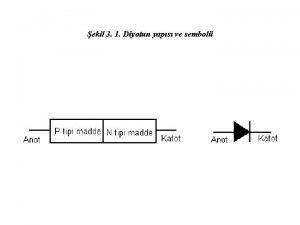
Kristal yap Foto diyot sembol
Foto diyot sembol Je lève les yeux vers les montagnes maranatha
Je lève les yeux vers les montagnes maranatha Pseudogut
Pseudogut Bentuk kristal
Bentuk kristal Taktisite
Taktisite Struktur kristal material teknik
Struktur kristal material teknik Atomik yapılı element
Atomik yapılı element Splitting orbital
Splitting orbital Monoklinik yapı
Monoklinik yapı Kristal artropati
Kristal artropati