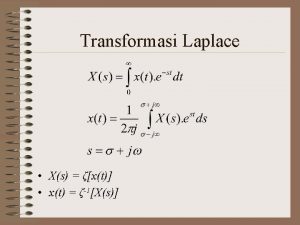Mengenal Sifat Material Struktur Kristal dan Nonkristal Kristal




![Kristal Sel Satuan pada Kisi-Kisi Ruang BRAVAIS [2, 5] Kristal Sel Satuan pada Kisi-Kisi Ruang BRAVAIS [2, 5]](https://slidetodoc.com/presentation_image_h/27265b4b24e55968075e9fb9d5951d38/image-5.jpg)


![Kristal Atom Group VI (S, Se, Te) [2] Atom Group VI (S, Se, Te) Kristal Atom Group VI (S, Se, Te) [2] Atom Group VI (S, Se, Te)](https://slidetodoc.com/presentation_image_h/27265b4b24e55968075e9fb9d5951d38/image-9.jpg)















- Slides: 36

Mengenal Sifat Material Struktur Kristal dan Nonkristal


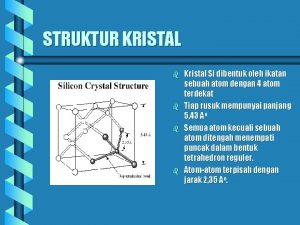
Kristal merupakan susunan atom-atom yang teratur dalam ruang tiga dimensi. Keteraturan susunan tersebut timbul karena kondisi geometris yang dihasilkan oleh ikatan atom yang terarah dan paking yang rapat. Sesungguhnya tidaklah mudah untuk menyatakan bagaimana atom tersusun dalam padatan. Namun ada hal-hal yang diharapkan menjadi faktor penting yang menentukan terbentuknya polihedra koordinasi atom-atom. Secara ideal, susunan polihdra koordinasi paling stabil adalah yang memungkinkan terjadinya energi per satuan volume minimal. Keadaan tersebut dicapai jika: 1. kenetralan listrik terpenuhi 2. ikatan kovalen yang diskrit dan terarah terpenuhi 3. meminimalkan gaya tolak ion-ion 4. paking atom serapat mungkin

Kristal Struktur kristal yang biasa teramati padatan dinyatakan dalam konsep geometris ideal yang disebut kisi-kisi ruang (space lattice) dan menyatakan cara bagaimana polihedra koordinasi atom-atom tersusun bersama agar energi dalam padatan menjadi minimal. Kisi-kisi ruang adalah susunan tiga dimensi titik-titik di mana setiap titik memiliki lingkungan yang serupa. Titik dengan lingkungan yang serupa itu disebut titik kisi (Lattice Point). Titik kisi dapat disusun hanya dalam 14 susunan yang berbeda yang disebut kisi-kisi Bravais; oleh karena itu atom-atom dalam kristal haruslah tersusun dalam salah satu dari 14 kemungkinan tersebut.
![Kristal Sel Satuan pada KisiKisi Ruang BRAVAIS 2 5 Kristal Sel Satuan pada Kisi-Kisi Ruang BRAVAIS [2, 5]](https://slidetodoc.com/presentation_image_h/27265b4b24e55968075e9fb9d5951d38/image-5.jpg)
Kristal Sel Satuan pada Kisi-Kisi Ruang BRAVAIS [2, 5]

Kristal Setiap titik kisi dapat ditempati oleh satu atau lebih atom, tetapi atom atau kelompok atom pada satu titik kisi haruslah identik dengan orientasi yang sama agar memenuhi definisi kisi ruang. Susunan atom dapat disebutkan secara lengkap dengan menyatakan posisi atom dalam suatu unit yang secara berulang tersusun dalam kisi ruang. Unit yang berulang itu disebut sel satuan. Rusuk sel satuan, yaitu vektor yang menghubungkan dua titik kisi, haruslah merupakan translasi kisi, dan sel satuan yang identik akan membentuk kisi ruang jika mereka disusun bidang sisi ke bidang sisi. Satu kisi-kisi ruang dapat memiliki beberapa sel satuan berbeda yang memenuhi kriteria tersebut di atas, akan tetapi biasanya sel satuan dipilih yang memiliki geometri sederhana dan memuat beberapa titik kisi saja. Satu sel satuan yang memiliki titik kisi hanya pada sudut-sudutnya, atau dengan kata lain satu unit sel yang memuat hanya satu titik kisi, disebut sel primitif.

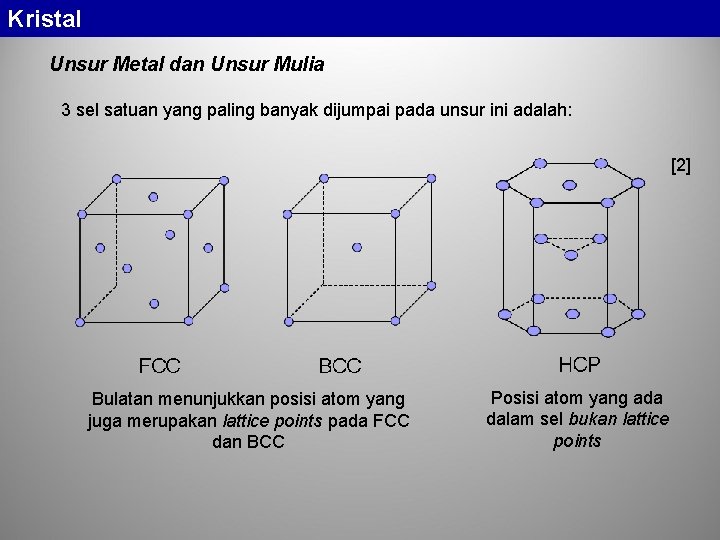
Kristal Unsur Metal dan Unsur Mulia 3 sel satuan yang paling banyak dijumpai pada unsur ini adalah: [2] Bulatan menunjukkan posisi atom yang juga merupakan lattice points pada FCC dan BCC Posisi atom yang ada dalam sel bukan lattice points

Kristal Unsur Dengan Lebih Dari 3 Elektron Valensi Unsur ini biasanya memiliki ikatan kovalen sehingga kristal yang terbentuk akan mengikuti ketentuan ikatan ini. Jika orbital yang tak terisi digunakan seluruhnya untuk membentuk ikatan, maka atom ini akan berikatan dengan (8 – N) atom lain, dimana N adalah jumlah elektron valensi yang dimilikinya. Elemen Cl, Br, J, kulit terluarnya memuat 7 elektron; oleh karena itu pada umumnya mereka berikatan dengan hanya 1 atom dari elemen yang sama membentuk molekul diatomik, Cl 2, Br 2, J 2. [2] Molekul diatomik tersebut membangun ikatan dengan molekul yang lain melalui ikatan sekunder yang lemah, membentuk kristal.
![Kristal Atom Group VI S Se Te 2 Atom Group VI S Se Te Kristal Atom Group VI (S, Se, Te) [2] Atom Group VI (S, Se, Te)](https://slidetodoc.com/presentation_image_h/27265b4b24e55968075e9fb9d5951d38/image-9.jpg)
Kristal Atom Group VI (S, Se, Te) [2] Atom Group VI (S, Se, Te) memiliki 6 elektron di kulit terluarnya dan membentuk molekul rantai atao cincin di mana setiap atom berikatan dengan dua atom (dengan sudut ikatan tertentu). Molekul ini berikatan satu sama lain dengan ikatan sekunder yang lemah membentuk kristal. Rantai spiral atom Te bergabung dengan rantai yang lain membentuk kristal hexagonal.

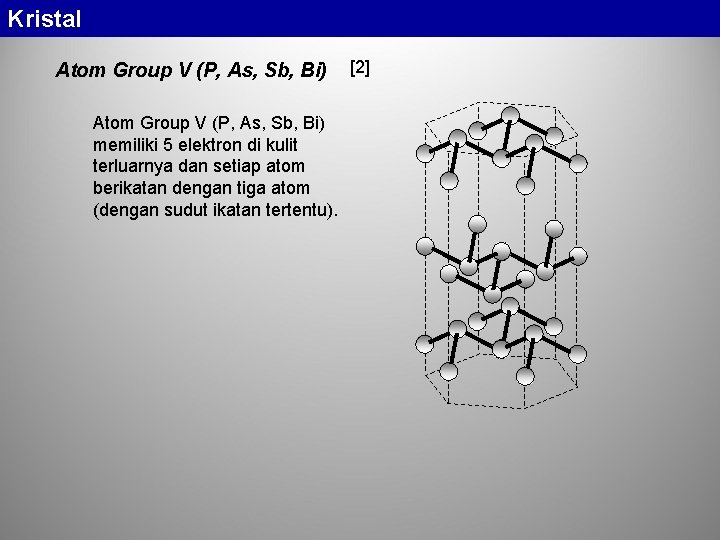
Kristal Atom Group V (P, As, Sb, Bi) memiliki 5 elektron di kulit terluarnya dan setiap atom berikatan dengan tiga atom (dengan sudut ikatan tertentu). [2]

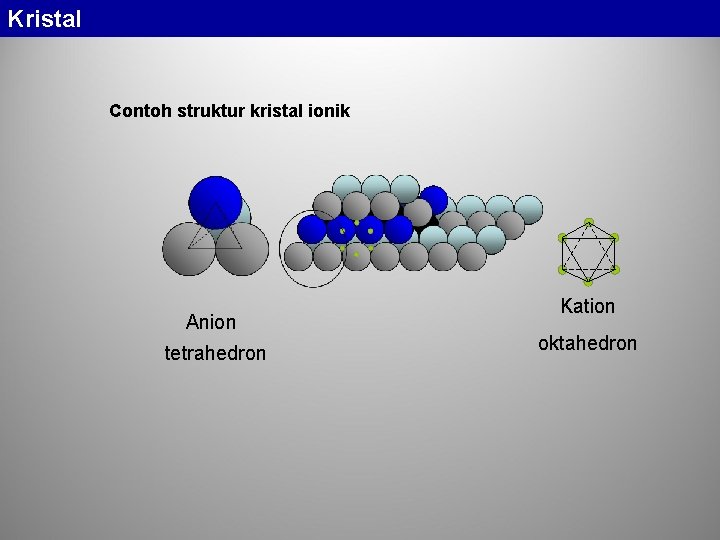
Kristal Ionik Walau sangat jarang ditemui kristal yang 100% ionik, namun beberapa kristal memiliki ikatan ionik yang sangat dominan sehingga dapat disebut sebagai kristal ionik. Contoh: Na. Cl, Mg. O, Si. O 2, Li. F. Dalam kristal ionik murni, polihedra anion (polihedra koordinasi) tersusun sedemikian rupa sehingga kenetralan listrik terpenuhi dan energi ikat per satuan volume menjadi minimum tanpa menyebabkan menguatnya gaya tolak antar muatan yang bersamaan tanda. Gaya tolak yang terbesar terjadi antar kation karena muatan listriknya terkonsentrasi dalam volume yang kecil, oleh karena itu polihedra koordinasi harus tersusun sedemikian rupa sehingga kation saling berjauhan.

Kristal Contoh struktur kristal ionik Anion tetrahedron Kation oktahedron

Kristal Molekul Jika dua atom terikat dengan ikatan primer, baik berupa ikatan ion ataupun ikatan kovalen, maka mereka dapat membentuk molekul yang diskrit. Jika ikatan primer tersebut kuat dalam satu sub-unit, maka ikatan yang terjadi antar sub-unit akan berupa bentuk ikatan yang berbeda dari ikatan primer. Kristal yang terbentuk adalah kristal molekuler dengan ikatan antar sub-unit yang lemah. Jika ikatan primernya adalah ikatan ion, molekul yang diskrit terbentuk jika muatan kation sama dengan hasilkali muatan anion dengan bilangan koordinasi. Contoh: sub-unit Si. F 4 terbentuk dengan ikatan ion, polihedra koordinasi atau polihedra anion berbentuk tetrahedra F mengelilingi kation Si yang kemudian tersusun dalam kisi-kisi BCC

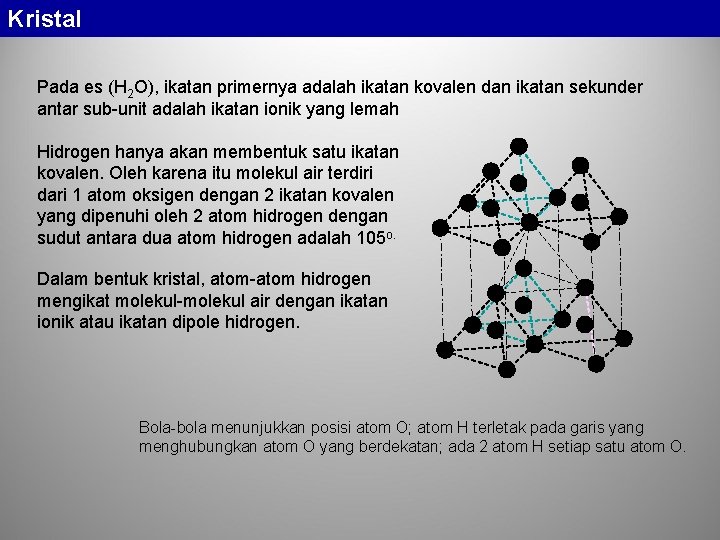
Kristal Pada es (H 2 O), ikatan primernya adalah ikatan kovalen dan ikatan sekunder antar sub-unit adalah ikatan ionik yang lemah Hidrogen hanya akan membentuk satu ikatan kovalen. Oleh karena itu molekul air terdiri dari 1 atom oksigen dengan 2 ikatan kovalen yang dipenuhi oleh 2 atom hidrogen dengan sudut antara dua atom hidrogen adalah 105 o. Dalam bentuk kristal, atom-atom hidrogen mengikat molekul-molekul air dengan ikatan ionik atau ikatan dipole hidrogen. Bola-bola menunjukkan posisi atom O; atom H terletak pada garis yang menghubungkan atom O yang berdekatan; ada 2 atom H setiap satu atom O.

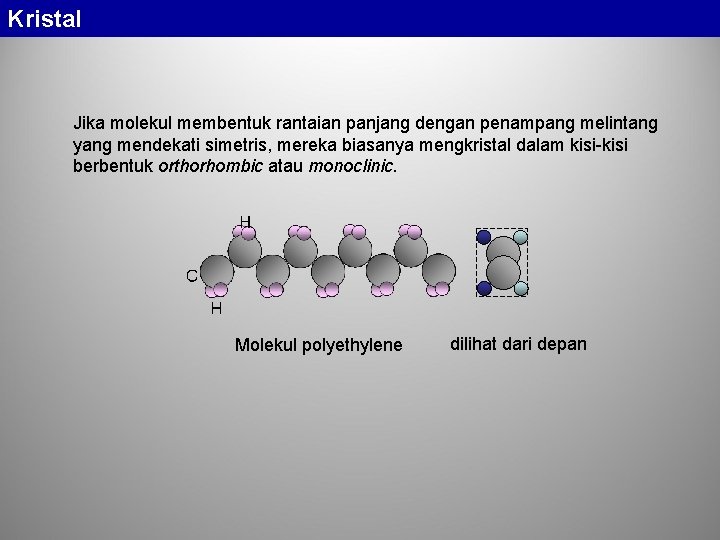
Kristal Jika molekul membentuk rantaian panjang dengan penampang melintang yang mendekati simetris, mereka biasanya mengkristal dalam kisi-kisi berbentuk orthorhombic atau monoclinic. Molekul polyethylene dilihat dari depan

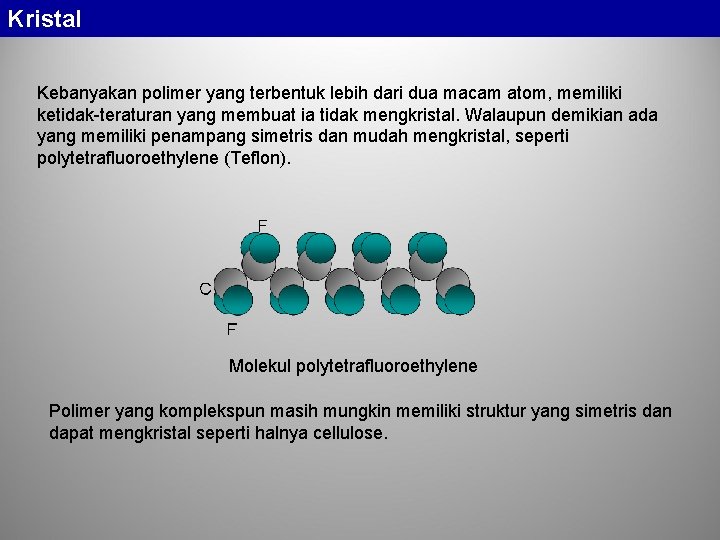
Kristal Kebanyakan polimer yang terbentuk lebih dari dua macam atom, memiliki ketidak-teraturan yang membuat ia tidak mengkristal. Walaupun demikian ada yang memiliki penampang simetris dan mudah mengkristal, seperti polytetrafluoroethylene (Teflon). Molekul polytetrafluoroethylene Polimer yang komplekspun masih mungkin memiliki struktur yang simetris dan dapat mengkristal seperti halnya cellulose.

Ketidaksempurnaan Pada Kristal

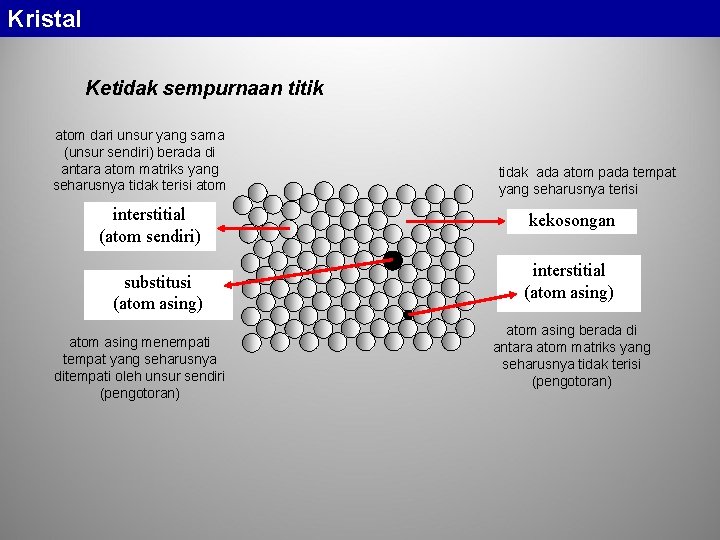
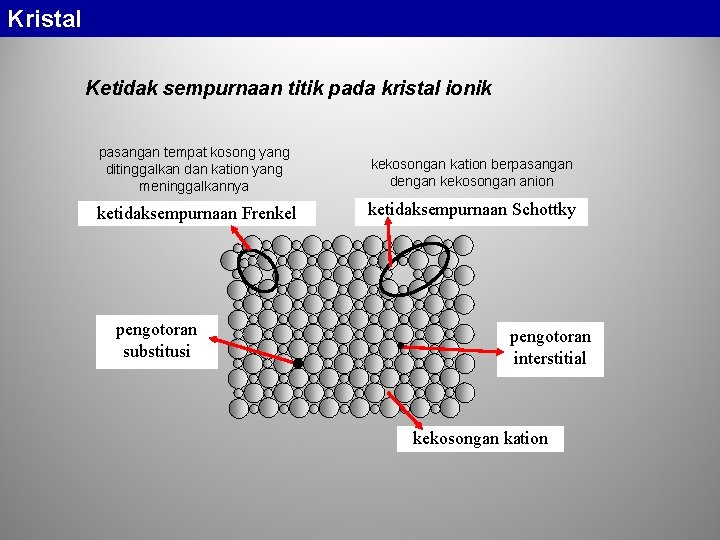
Kristal Kebanyakan kristal mengandung ketidak-sempurnaan. Karena kisi -kisi kristal merupakan suatu konsep geometris, maka ketidaksempurnaan kristal juga diklasifikasikan secara geometris. • ketidak-sempurnaan berdimensi nol (ketidak-sempurnaan titik), • ketidak-sempurnaan berdimensi satu (ketidak-sempurnaan garis), • ketidak-sempurnaan berdimensi dua (ketidak-sempurnaan bidang). • Selain itu terjadi pula ketidak-sempurnaan volume dan juga ketidak-sempurnaan pada struktur elektronik

Kristal Ketidak sempurnaan titik atom dari unsur yang sama (unsur sendiri) berada di antara atom matriks yang seharusnya tidak terisi atom interstitial (atom sendiri) substitusi (atom asing) atom asing menempati tempat yang seharusnya ditempati oleh unsur sendiri (pengotoran) tidak ada atom pada tempat yang seharusnya terisi kekosongan interstitial (atom asing) atom asing berada di antara atom matriks yang seharusnya tidak terisi (pengotoran)

Kristal Ketidak sempurnaan titik pada kristal ionik pasangan tempat kosong yang ditinggalkan dan kation yang meninggalkannya kekosongan kation berpasangan dengan kekosongan anion ketidaksempurnaan Frenkel ketidaksempurnaan Schottky pengotoran substitusi pengotoran interstitial kekosongan kation

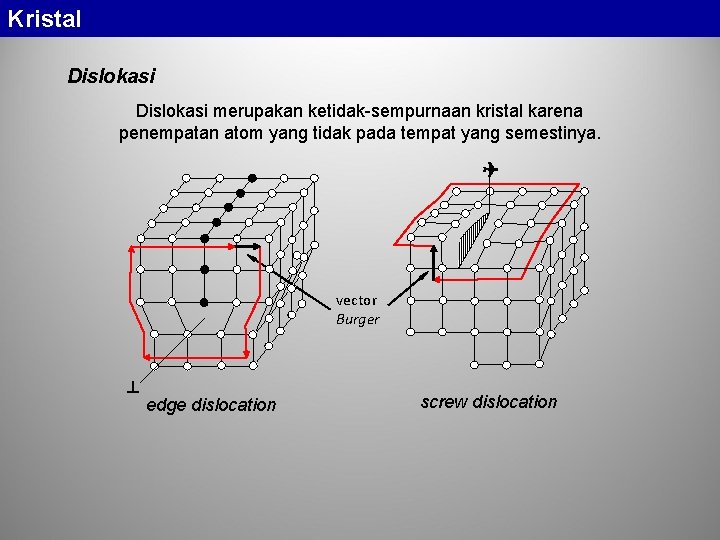
Kristal Dislokasi merupakan ketidak-sempurnaan kristal karena penempatan atom yang tidak pada tempat yang semestinya. vector Burger edge dislocation screw dislocation


Nonkristal Melihat strukturnya, material nonkristal dapat dikelompokkan menjadi dua kelompok utama, yaitu: a) struktur yang terbangun dari molekul berbentuk rantai panjang b) struktur yang terbangun dari jaringan tiga dimensi

Nonkristal Molekul Rantaian Panjang - Organik Beberapa faktor yang mendorong terbentuknya struktur nonkristal adalah: a) molekul rantaian yang panjang dan bercabang; b) kelompok atom yang terikat secara tak beraturan sepanjang sisi molekul; c) rantaian panjang yang merupakan kombinasi dari dua atau lebih polimer, yang disebut kopolimer; d) adanya unsur aditif, yang akan memisahkan satu rantaian dari rantaian yang lain; unsur aditif ini biasa disebut plasticizer.

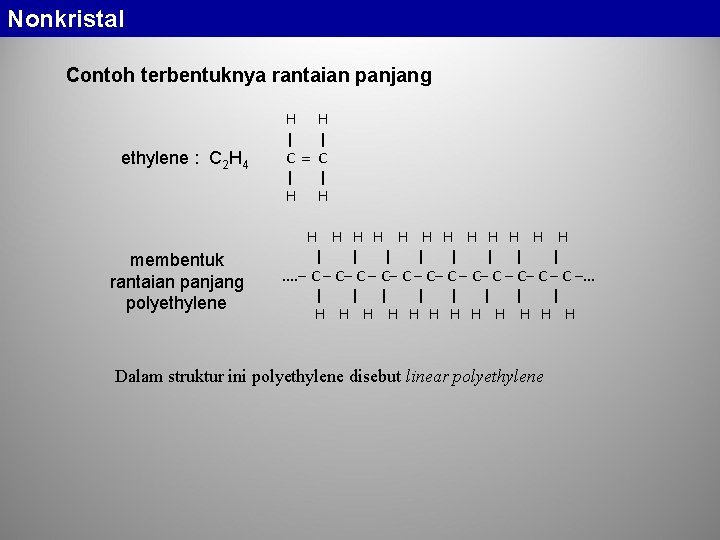
Nonkristal Contoh terbentuknya rantaian panjang ethylene : C 2 H 4 membentuk rantaian panjang polyethylene H H | | C C | | H H H H | | | |. . C C C C . . . | | | | H H H Dalam struktur ini polyethylene disebut linear polyethylene

Nonkristal Keadaan jauh berbeda jika molekul polyethylene bercabang. Makin bercabang, polyethylene makin nonkristal. Pengaruh adanya cabang ini bisa dilihat pada vinyl polymer, yaitu polymer dengan unit berulang C 2 H 3 X. Cabang X ini bisa berupa gugus atom yang menempati posisi di mana atom H seharusnya berada. H H | | C C | | H X

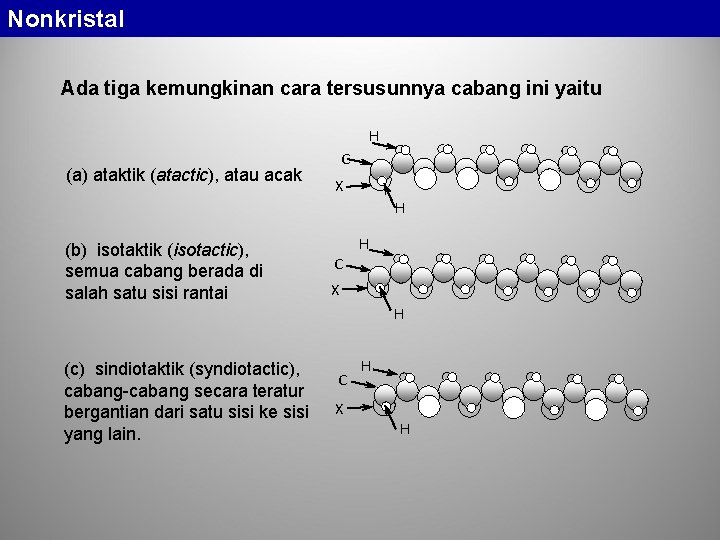
Nonkristal Ada tiga kemungkinan cara tersusunnya cabang ini yaitu H (a) ataktik (atactic), atau acak C X H (b) isotaktik (isotactic), semua cabang berada di salah satu sisi rantai H C X H (c) sindiotaktik (syndiotactic), cabang-cabang secara teratur bergantian dari satu sisi ke sisi yang lain. C H X H

Nonkristal Jika gugus cabang kecil, seperti pada polyvinyl alkohol di mana X = OH, dan rantaian linier, maka polimer ini dengan mudah membentuk kristal. Akan tetapi jika gugus cabang besar, polimer akan berbentuk nonkristal seperti pada poyvinyl chloride, di mana X = Cl; juga pada polystyrene, di mana X = benzena yang secara acak terdistribusi sepanjang rantaian (ataktik). Polimer isotactic dan syndiotactic biasanya membentuk kristal, bahkan jika cabang cukup besar.

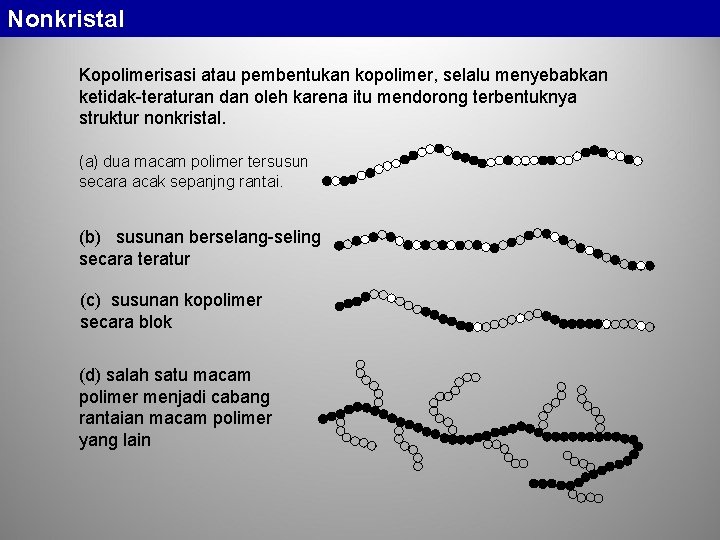
Nonkristal Kopolimerisasi atau pembentukan kopolimer, selalu menyebabkan ketidak-teraturan dan oleh karena itu mendorong terbentuknya struktur nonkristal. (a) dua macam polimer tersusun secara acak sepanjng rantai. (b) susunan berselang-seling secara teratur (c) susunan kopolimer secara blok (d) salah satu macam polimer menjadi cabang rantaian macam polimer yang lain

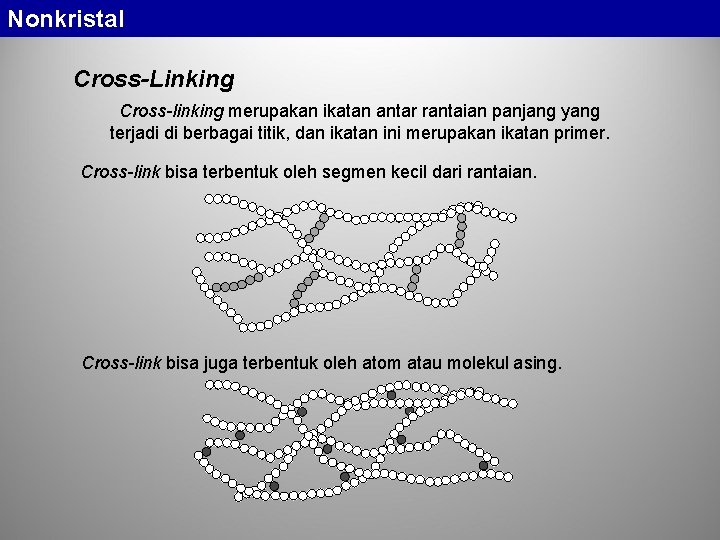
Nonkristal Cross-Linking Cross-linking merupakan ikatan antar rantaian panjang yang terjadi di berbagai titik, dan ikatan ini merupakan ikatan primer. Cross-link bisa terbentuk oleh segmen kecil dari rantaian. Cross-link bisa juga terbentuk oleh atom atau molekul asing.

Nonkristal Jaringan Tiga Dimensi - Anorganik Suatu senyawa anorganik cenderung membentuk struktur nonkristal jika: a) setiap anion terikat pada hanya dua kation; b) tidak lebih dari empat anion mengelilingi satu kation; c) polihedra anion berhubungan sudut ke sudut, tidak sisi ke sisi dan tidak pula bidang ke bidang; d) senyawa memiliki sejumlah besar atom penyusun yang terdistribusi secara tak menentu di seluruh jaringan. Jika muatan kation besar, seperti misalnya silika Si+4, dengan polihedron anion yang kecil, maka struktur nonkristal mudah sekali terbentuk. Kebanyakan gelas anorganik berbahan dasar silika, Si. O 2, dengan sub -unit berbentuk tetrahedra yang pada gelas silika murni terhubung sudut ke sudut

Nonkristal Penambahan oksida alkali pada struktur yang demikian ini dapat memutus rantaian tetrahedra; atom oksigen dari oksida ini menyelip pada titik dimana dua tetrahedra terhubung dan memutus hubungan tersebut sehingga masing-masing tertrahedron mempunyai satu sudut bebas. Terputusnya hubungan antar tetrahedra dapat menyebabkan turunnya viskositas, sehingga gelas lebih mudah dibentuk.

Struktur Padatan Dalam Skala yang Lebih Besar

Padatan Struktur kristal dan nonkristal adalah struktur padatan dilihat dalam skala atom atau molekul. Sesungguhnya kebanyakan padatan memiliki detil struktur yang lebih besar dari skala atom ataupun molekul, yang terbangun dari kelompok kristal ataupun nonkristal. Kelompok-kelompok ini dengan jelas dapat dibedakan antara satu dengan lainnya dan disebut fasa; bidang batas antara mereka disebut batas fasa. Secara formal dikatakan bahwa fasa adalah daerah dari suatu padatan yang secara fisis dapat dibedakan dari daerah yang lain dalam padatan tersebut. Pada dasarnya berbagai fasa yang hadir dalam suatu padatan dapat dipisahkan secara mekanis.

Padatan Dalam satu unit kristal jarak antara atom dengan atom hanya beberapa angstrom. Jika unit-unit kristal tersusun secara homogen membentuk padatan maka padatan yang terbentuk memiliki bangun yang sama dengan bangun unit kristal yang membentuknya namun dengan ukuran yang jauh lebih besar, dan disebut sebagai kristal tunggal; padatan ini merupakan padatan satu fasa. Pada umumnya susunan kristal dalam padatan satu fasa tidaklah homogen. Dislokasi dan perbedaan orientasi terjadi antara kristal-kristal. Padatan jenis ini merupakan padatan polikristal, walaupun tetap merupakan padatan satu fasa. Kristal-kristal yang membentuk padatan ini biasa di sebut grain, dan batas antara grain disebut batas grain. Pada padatan nonkristal sulit mengenali adanya struktur teratur dalam skala lebih besar dari beberapa kali jarak atom. Oleh karena itu kebanyakan padatan nonkristal merupakan padatan satu fasa. Padatan dapat tersusun dari dua fasa atau lebih. Padatan demikian disebut sebagai padatan multifasa. Padatan multifasa bisa terdiri hanya dari satu komponen (komponen tunggal) atau lebih (multikomponen).

Courseware Mengenal Sifat Material #2 Klasifikasi Padatan Sudaryatno Sudirham
 Barang siapa mengenal dirinya maka dia mengenal tuhannya
Barang siapa mengenal dirinya maka dia mengenal tuhannya Sifat wajib dan mustahil bagi allah
Sifat wajib dan mustahil bagi allah Struktur kristal material teknik
Struktur kristal material teknik Sifat - sifat -sifat pemerintah reformasi di indonesia
Sifat - sifat -sifat pemerintah reformasi di indonesia Sifat-sifat struktur data tree
Sifat-sifat struktur data tree Pengertian avl tree
Pengertian avl tree Contoh operasi vektor penjumlahan
Contoh operasi vektor penjumlahan Sifat sifat unsur dan senyawa periode 3
Sifat sifat unsur dan senyawa periode 3 Sifat koloid dalam kehidupan sehari-hari
Sifat koloid dalam kehidupan sehari-hari Maksud beriman kepada rasul
Maksud beriman kepada rasul Peta konsep sifat wajib allah
Peta konsep sifat wajib allah Sifat rangkaian seri
Sifat rangkaian seri Teorema determinan matriks
Teorema determinan matriks 14 kisi kristal
14 kisi kristal Contoh keterampilan menginferensi
Contoh keterampilan menginferensi Perkataan e pepet
Perkataan e pepet Implikasi kepercayaan kepada allah sebagai penyelamat
Implikasi kepercayaan kepada allah sebagai penyelamat Mengenal kekuatan dan kelemahan diri
Mengenal kekuatan dan kelemahan diri Jelaskan struktur puisi
Jelaskan struktur puisi Ekspektasi peubah acak
Ekspektasi peubah acak Sifat sifat warna
Sifat sifat warna Sifat bahan kemasan
Sifat bahan kemasan Sifat analisis regresi
Sifat analisis regresi Sifat sifat sudut segitiga
Sifat sifat sudut segitiga Log 2 artinya
Log 2 artinya Nilai harapan dari peubah acak diskrit adalah
Nilai harapan dari peubah acak diskrit adalah Kesetimbangan asam basa
Kesetimbangan asam basa Kemasan yang bersifat inert
Kemasan yang bersifat inert Hasil kali vektor
Hasil kali vektor Sifat perkalian skalar dua vektor
Sifat perkalian skalar dua vektor Sifat dasar analisis regresi
Sifat dasar analisis regresi Sifat sifat senyawa hidrokarbon
Sifat sifat senyawa hidrokarbon Penjelasan fungsi komposisi
Penjelasan fungsi komposisi Cahaya merupakan gelombang transversal.
Cahaya merupakan gelombang transversal. Sifat transformasi laplace
Sifat transformasi laplace Sifat dosa adalah
Sifat dosa adalah Sifat mekanik beton
Sifat mekanik beton