Katlar Svlar ve Moleklleraras kuvvetler Moleklleri birarada tutan

Katılar, Sıvılar ve Moleküllerarası kuvvetler
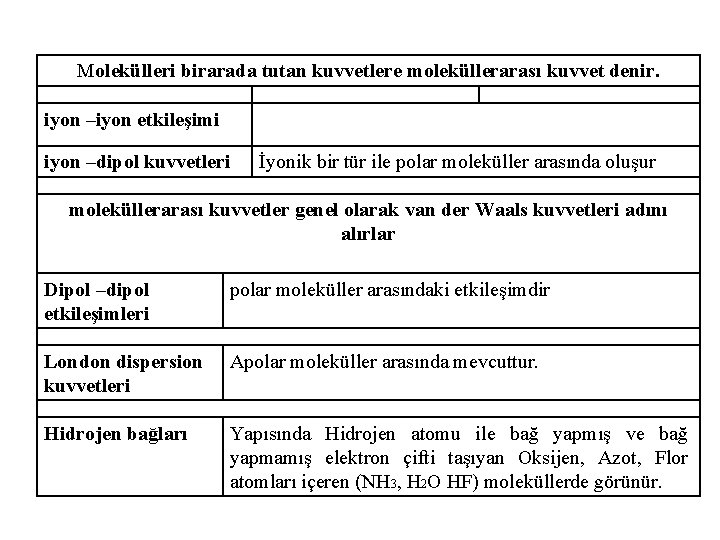
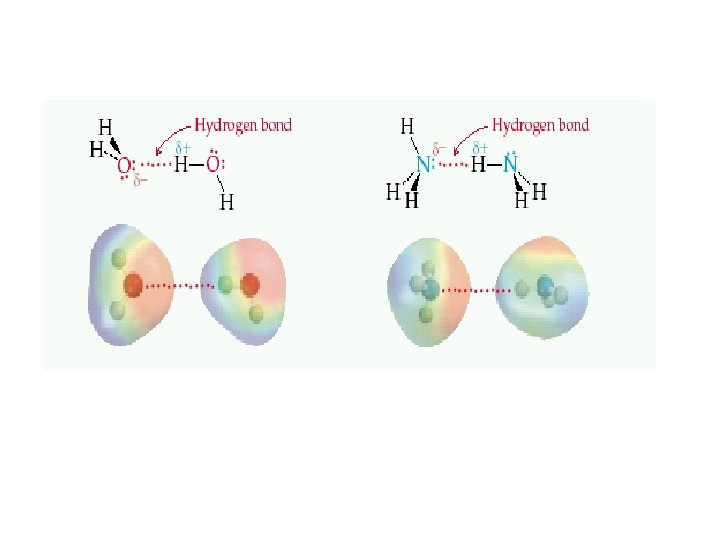
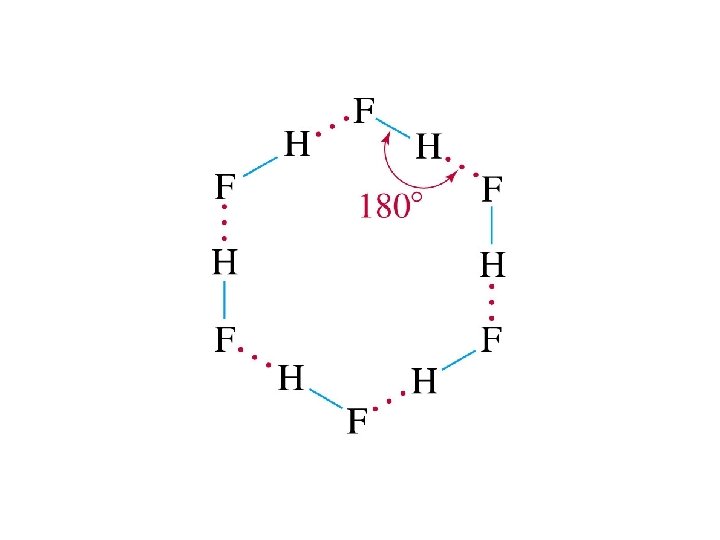
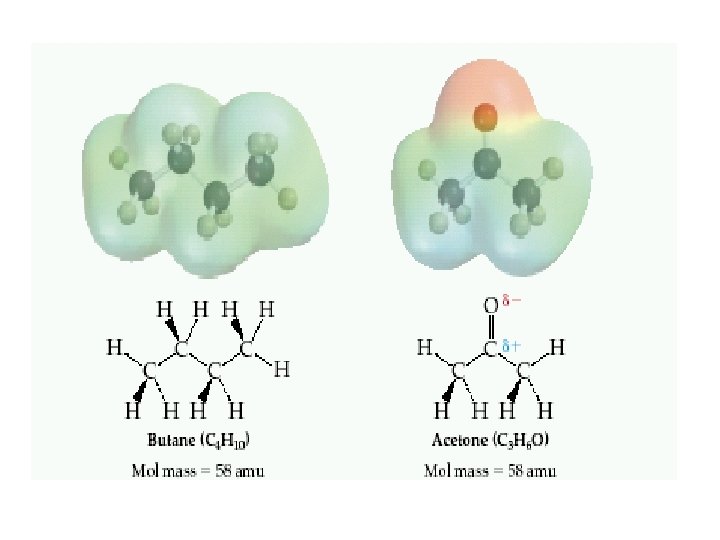
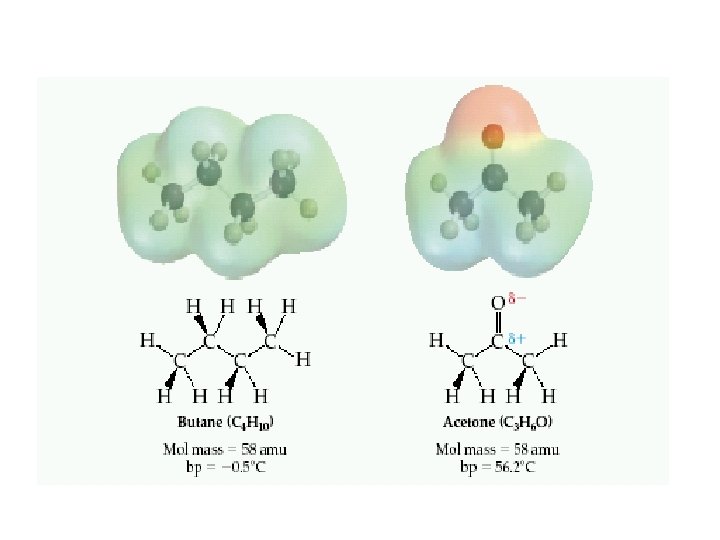
Molekülleri birarada tutan kuvvetlere moleküllerarası kuvvet denir. iyon –iyon etkileşimi iyon –dipol kuvvetleri İyonik bir tür ile polar moleküller arasında oluşur moleküllerarası kuvvetler genel olarak van der Waals kuvvetleri adını alırlar Dipol –dipol etkileşimleri polar moleküller arasındaki etkileşimdir London dispersion kuvvetleri Apolar moleküller arasında mevcuttur. Hidrojen bağları Yapısında Hidrojen atomu ile bağ yapmış ve bağ yapmamış elektron çifti taşıyan Oksijen, Azot, Flor atomları içeren (NH 3, H 2 O HF) moleküllerde görünür.
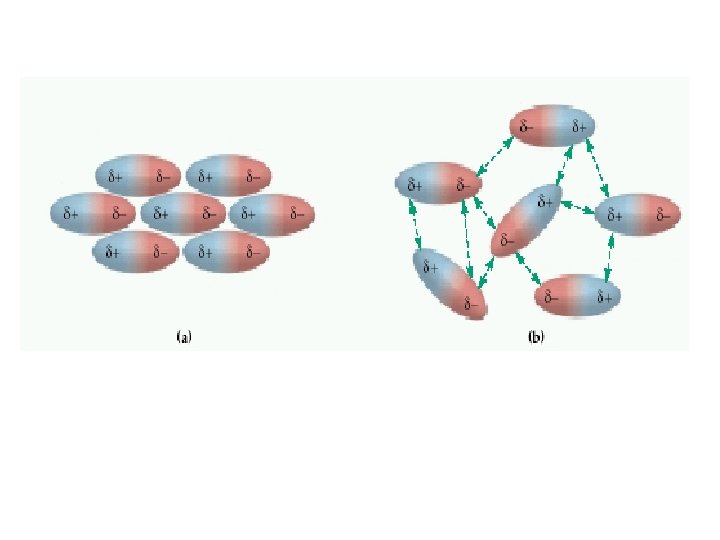

H 2 CCl 4 SCO NH 3 bileşiklerinde hangi tür moleküllerarası kuvvetler vardır.

-Moleküller arası çekim kuvveti arttıkça maddenin erime/kaynama noktası yükselir. -(london) Dağılım kuvvetleri tüm moleküllerde mevcuttur. - Molekül ağırlığı attıkça dağılım kuvvetleri daha güçlü hale gelir ve maddenin erime/kaynama noktası yükselir. Moleküller arası kuvvet Gücü özellik İyon – Dipol Orta (10 -50 k. J/mol) İyonlarla –polar moleküller Dipol- Dipol Zayıf (3 -4 k. J/mol) Polar moleküller arasında London dağılım Zayıf (1 -10 k. J/mol) Tüm moleküller arasında Hidrojen Bağları Orta (10 -40 k. J/mol) O-H, N-H, F-H arasında
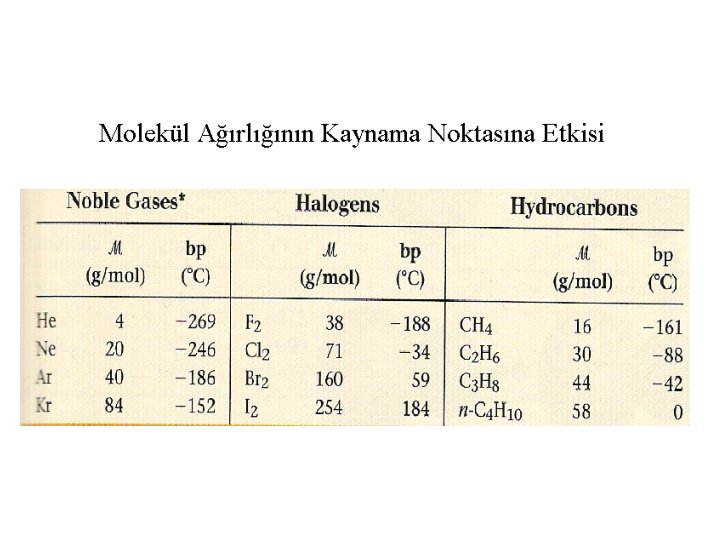



Aşağıdaki maddeleri artan kaynama noktalarına göre sıralayınız Ba. Cl 2 HF CO Ne

Katı ve sıvıların Bazı özellikleri

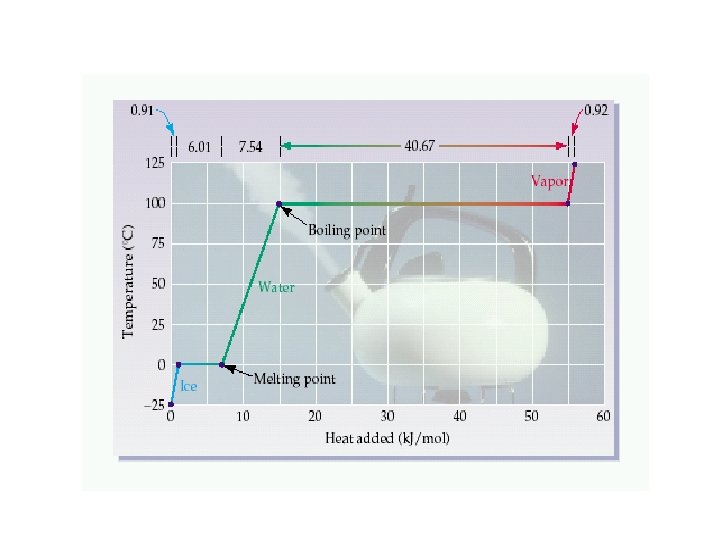
Katılar sıkıştırılamazlar, akışkan değildirler. are incompressible, do not flow. Katı maddenin yapısında tanecikler (atomlar, iyonlar veya moleküller) birbirleri ile yakın temas halindedir ve moleküller arası kuvvetler tarafından belli bir şekil ve hacimde olmaya zorlanırlar Sıvılar sıkıştırılamazlar ama akışkandırlar. Sıvı halde atom veya moleküller birbirlerine yakın dururlar ve moleküller arası kuvvetler nedeniyle belli bir hacim kaplarlar ancak şekilleri değişebilir.
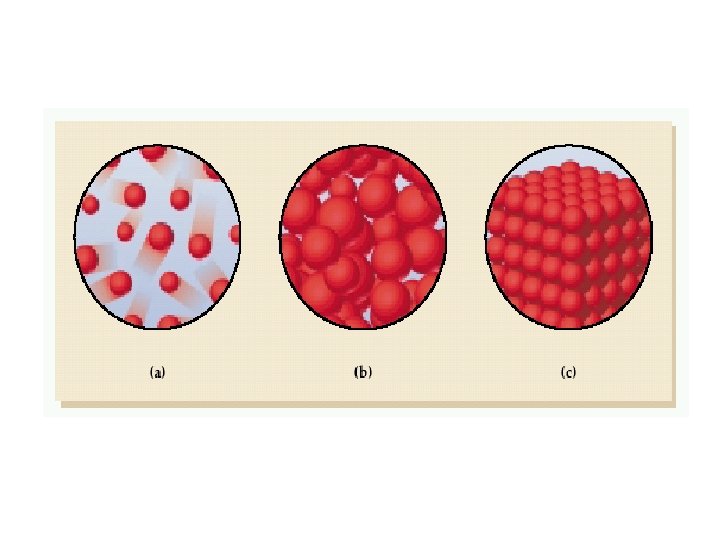
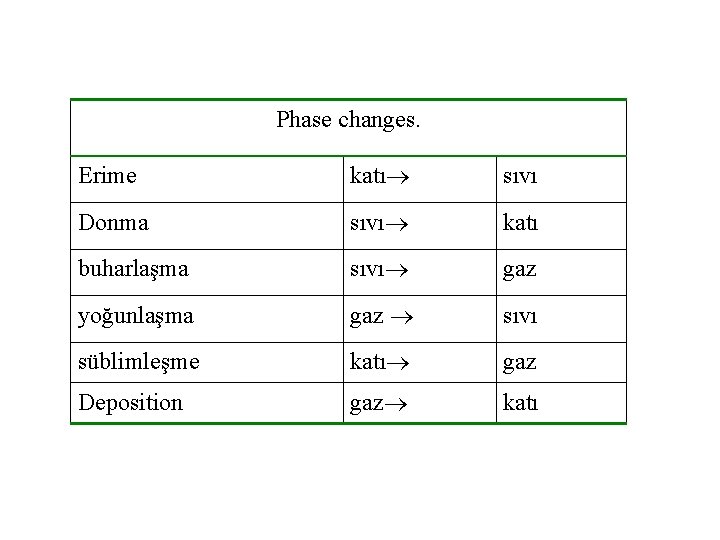
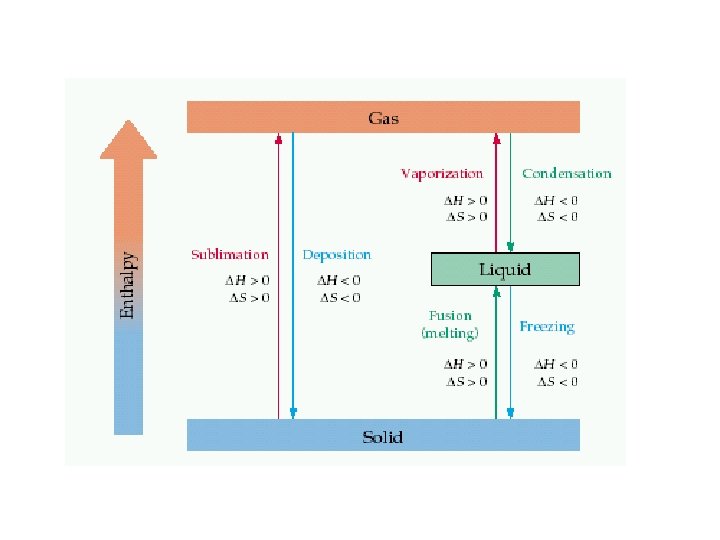
Phase changes. Erime katı sıvı Donma sıvı katı buharlaşma sıvı gaz yoğunlaşma gaz sıvı süblimleşme katı gaz Deposition gaz katı
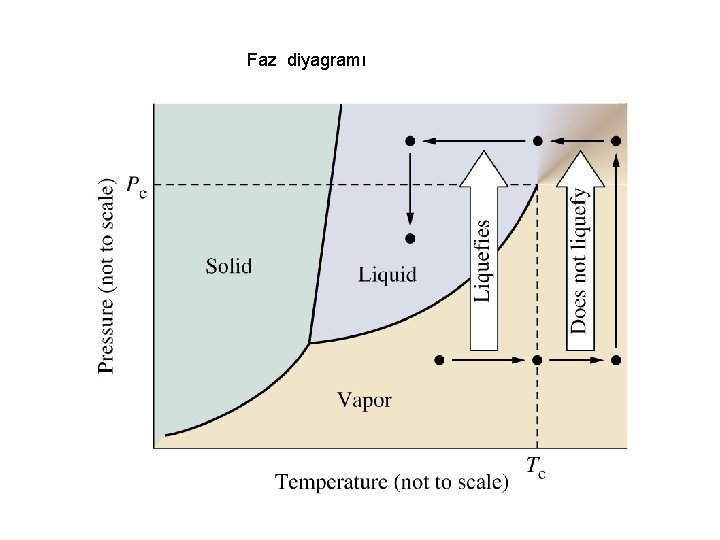
Faz diyagramı
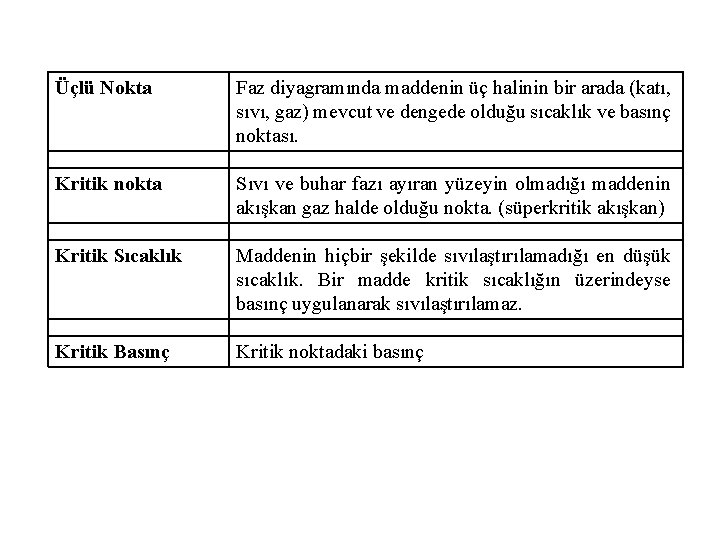
Üçlü Nokta Faz diyagramında maddenin üç halinin bir arada (katı, sıvı, gaz) mevcut ve dengede olduğu sıcaklık ve basınç noktası. Kritik nokta Sıvı ve buhar fazı ayıran yüzeyin olmadığı maddenin akışkan gaz halde olduğu nokta. (süperkritik akışkan) Kritik Sıcaklık Maddenin hiçbir şekilde sıvılaştırılamadığı en düşük sıcaklık. Bir madde kritik sıcaklığın üzerindeyse basınç uygulanarak sıvılaştırılamaz. Kritik Basınç Kritik noktadaki basınç

Supercritical Fluids
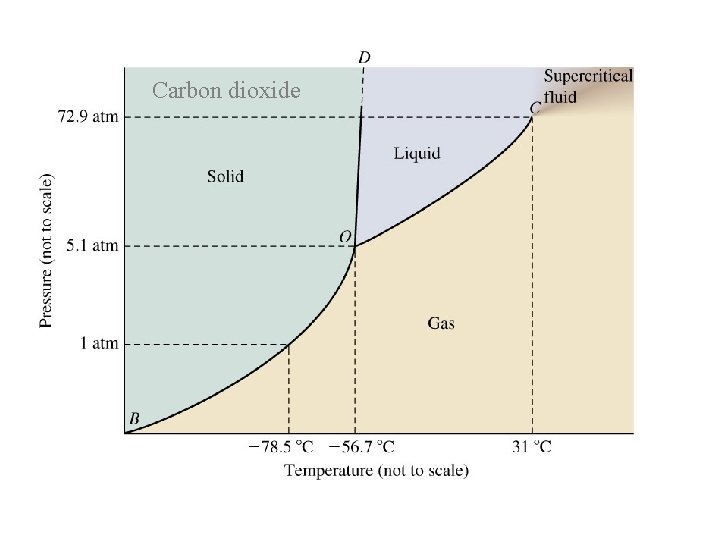
Carbon dioxide
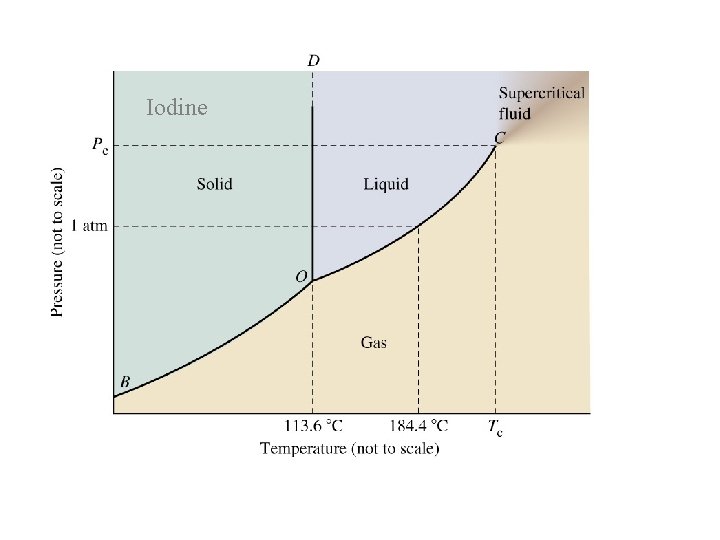
Iodine
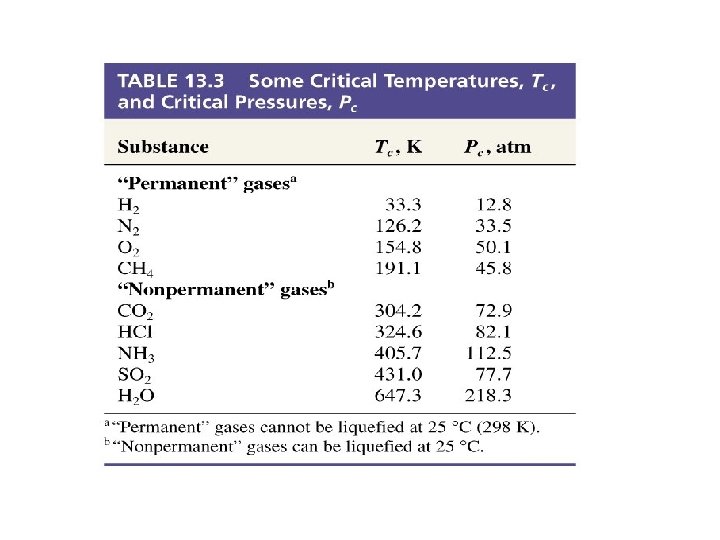

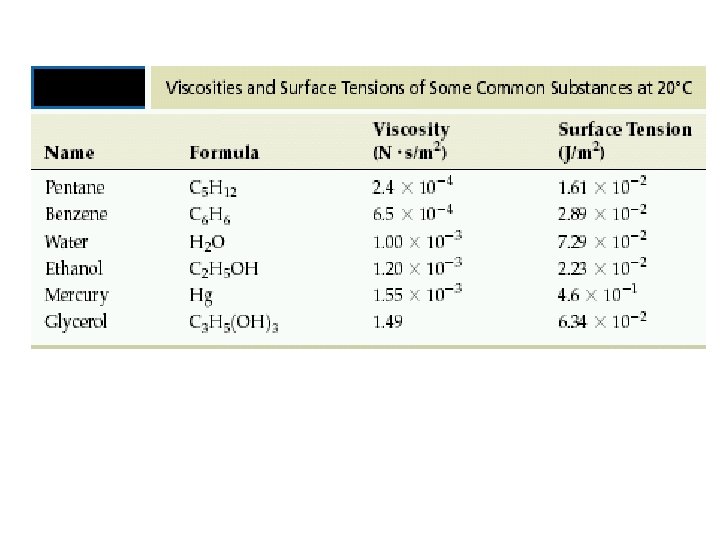
Some Properties of Liquids Kohezyon kuvvetleri Benzer moleküller arası kuvvetlerdir. Adhezyon kuvvetleri Birbirinden farklı, benzemeyen moleküllerarası çekim kuvvetleri. Yüzey gerilimi Sıvının yüzeyindeki moleküllerin bir kuvvetle içe doğru çekilmesi sonucudur, sıvı en en küçük yüzey alanı değeri alır. Sıvının yüzey alanını arttırmak için gerekli enerji olarak tanımlanır. Viscosity Sıvının akmaya karşı gösterdiği direnç tir. Moleküllerarası kuvvetler güçlü ise molekülleri birarada tutar ve hareketlerini sınırlandırır.
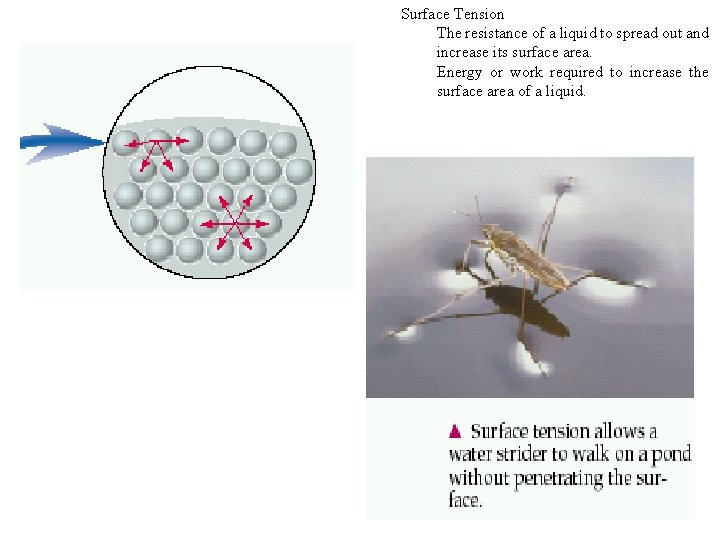
Surface Tension The resistance of a liquid to spread out and increase its surface area. Energy or work required to increase the surface area of a liquid.


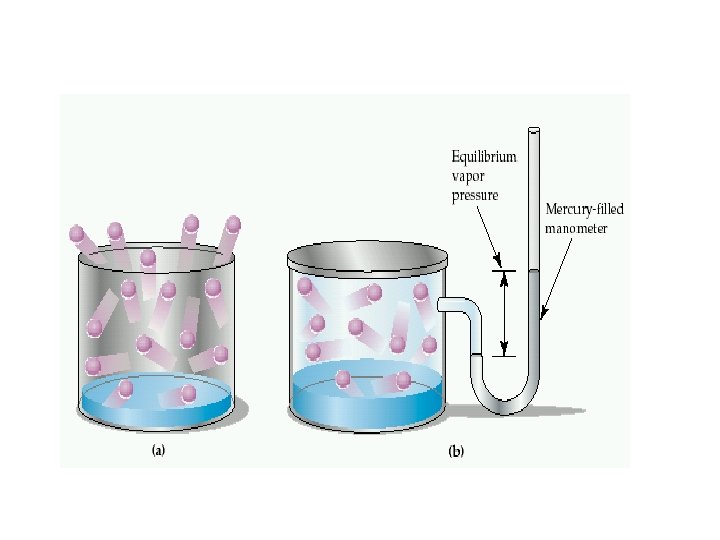
Buhar basıncı Sıvının gaz haline geçmesine buharlaşma denir. Sıvılar her sıcaklıkta buharlaşabilir. Kapalı bir kapta sıvı ile dengede olan buhar fazının basıncına buhar basıncı denir. Buhar basıncı sıcaklık artıkça artar (molekülerarası çekim kuvvetini yenen molekül sayısı artıp buhar fazına geçen molkül sayısı artacağından)
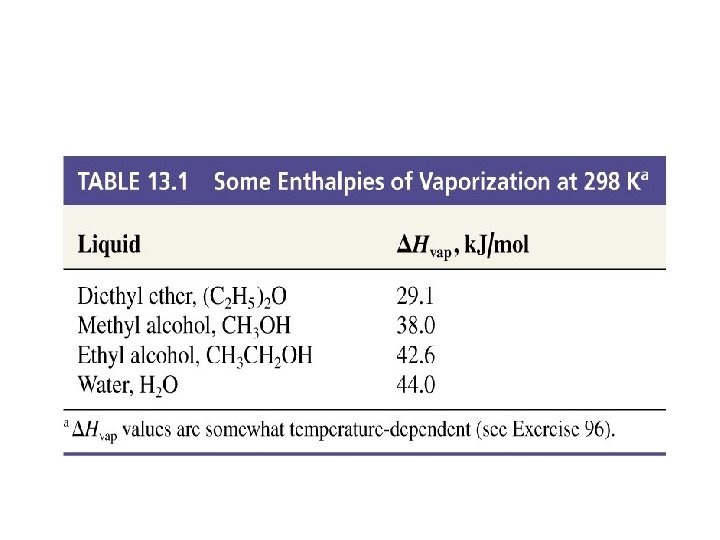

∆H buharlaşma entalpisi PBuh= T sıcaklığında sıvının buhar basıncı
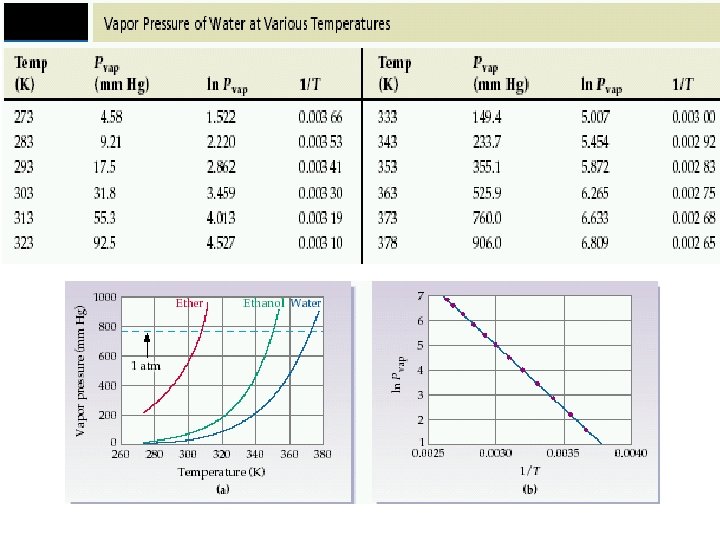
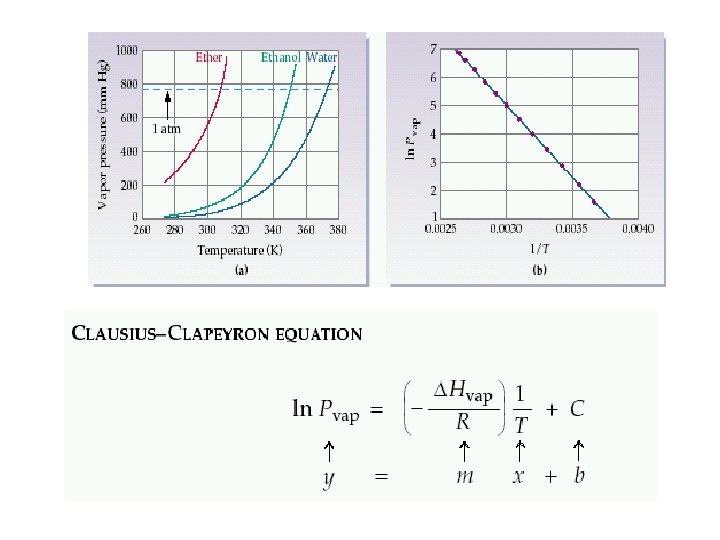


• Buharlaşma entalpisi 5. 31 x 10^4 J. mol olan ve 40°C 91. 0 mm. Hg buhar basıncı bulunan bileşiğin 25 °Cdeki buhar basıncını hesaplayınız

Naftalinin (C 10 H 8) 25 °C de buhar basıncı 0. 300 mm. Hg, İse, 500, 0 ml kapalı kap içinde sublime olan naftalin miktarını bulunuz.

Propilamin Bileşiği için aşağıdaki soruları cevaplayınız ØHangi tür moleküllerarsı kuvvetlere sahiptir ØKaynama noktasını azot, metiamin CH 3 NH 2 ve amonyum klorür ile karşılaştırın ØElektriği iletir mi? ØNormal kaynama sıcaklığı 48, 7 C normal donma noktası -83 ° C, kritik sıcaklığı 234 ° C ve katı haldeki yoğunluğu sıvı halinden daha fazla olduğuna göre faz diyagramını çiziniz ØBuharlaşma entalpisi 30, 7 k. J/mol ve normal kaynama sıcaklığı 48, 7 ° C olduğuna göre 25°C deki buhar basıncını bulunuz ØHangi sıcaklıkta 0, 500 atm buhar basıncına sahip olur. Ø 1 ml propilamin 1 L lik kapalı kaba konduğunda 22 ° C de dengehalinde kapta sıvı propiamin kalırmı? (22 ° C de propilaminin buhar basıncı 269 mm. Hg, yoğunluğu 0, 719 g/ml)
- Slides: 39